ACSL4
ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition

铁死亡是一种由谷胱甘肽过氧化物酶4(GPX4)调控的细胞坏死形式。早期研究揭示了erastin (ERA)通过抑制系统xc-来诱导铁死亡,随后GPX4抑制剂RSL3也被发现。然而,某些细胞类型对铁死亡具有抗性。为了深入理解这种抗性的分子机制,并探索在病理条件下预防铁死亡的可能性,本研究聚焦于酰基辅酶A合成酶长链家族成员4(ACSL4)。
1、ACSL4是铁死亡过程中的关键促死基因
在本研究中,作者采用了两种方法来确定铁死亡的关键基因。首先,作者创建了抗铁死亡的细胞系,这些细胞在GPX4失活后特异性地抵抗铁死亡,并且在用GPX4抑制剂RSL3处理时不会触发其他细胞死亡途径。通过对这些细胞进行基因表达分析,作者鉴定了ACSL4作为潜在的关键基因。其次,作者还利用全基因组隐性遗传筛选方法,通过慢病毒CRISPR指导的RNA(gRNA)文库,两次筛选了能够调节ERA或RSL3诱导的铁死亡敏感性的基因。结果显示,靶向ACSL4的gRNA在测序结果中占据了显著比例,进一步证实了ACSL4在铁死亡过程中的重要作用。这两种方法均独立地指出了ACSL4在铁死亡中的核心地位,表明其是铁死亡敏感性的关键因素,特别是在某些基底样乳腺癌细胞中,ACSL4的药理抑制具有巨大的治疗潜力。

图1 Acsl4是必需的促铁死亡基因
2、ACSL4对GPX4抑制后的脂质氧化至关重要
为了探究ACSL4缺失如何提供对铁死亡的保护作用,作者深入分析了铁死亡的特征性表现。通过对野生型(WT)和ACSL4敲除(KO)细胞进行电子显微镜观察,作者发现ACSL4 KO细胞对RSL3诱导的线粒体外膜破裂展现出显著增强的抵抗力。为了确认ACSL4在铁死亡中的特异性作用,作者进一步研究了其他ACSL亚型基因缺失对铁死亡敏感性的影响,结果显示这些亚型的缺失并未对铁死亡敏感性产生显著影响。此外,ACSL4 KO细胞还被发现对除RSL3以外的其他铁死亡诱导剂同样具有高度抗性,但对其他形式的细胞死亡诱导剂则无此抗性,这进一步强化了ACSL4与铁死亡诱导之间的特异性联系。这些发现表明,在GPX4被抑制后,ACSL4对于脂质氧化的发生是不可或缺的。
 图2Acsl4 WT和KO细胞的电镜分析
图2Acsl4 WT和KO细胞的电镜分析
鉴于ACSL4具备优先催化长链多不饱和脂肪酸(PUFAs)参与磷脂生物合成的独特功能,作者推测PUFAs可能是驱动铁死亡过程的关键“燃料”。为了验证这一假设,作者设计了一系列实验:首先,他们对Acsl4敲除(KO)细胞进行了富集处理,并利用RSL3诱导铁死亡,随后补充不同类型的脂肪酸。结果显示,与ω-3脂肪酸相比,ω-6脂肪酸在诱导细胞死亡方面的效率高出5至10倍。
接着,作者对铁死亡过程中可能产生的氧化磷脂进行了深入分析,并发现磷脂酰乙醇胺(PE)中富含花生四烯酸(AA)和肾上腺酸(AdA)的物质更容易成为氧化的首选目标。为了更精确地了解ACSL4在脂质合成中的作用,作者采用质谱技术和定量分析手段,发现Acsl4 KO细胞中AA-和AdA-PE的含量显著低于野生型(WT)细胞,这直接证明了ACSL4在促进AA和AdA的脂质生物合成中的关键作用。
进一步地,作者比较了RSL3处理的Acsl4 WT和KO细胞中脂质氧化的程度,并发现Acsl4的缺失显著抑制了含双氧化和三氧化的AA-和AdA-PE物质的形成。这些数据有力地表明,ACSL4的缺乏导致AA-和AdA-PE物质的含量下降,而这些物质正是GPX4缺失或失活条件下引发铁死亡的必需底物。因此,ACSL4不仅通过调节PUFAs的利用来影响磷脂的生物合成,还间接地决定了细胞在面临铁死亡压力时的命运。
 图3 ACSL4通过将AA和AdA特异性酯化成PE调节铁死亡敏感性
图3 ACSL4通过将AA和AdA特异性酯化成PE调节铁死亡敏感性
3、ACSL4增强基底样乳腺癌细胞对铁死亡的敏感性
有研究表明,特定乳腺癌细胞系对系统xc-所必需的谷氨酰胺代谢有显著依赖,这可能预示着它们与铁死亡之间存在某种关联。进一步地,谷氨酰胺营养缺陷的细胞系对RSL3表现出明显的敏感性。基于这些线索,作者深入分析了这些细胞,并发现ACSL4在一系列基底样乳腺癌细胞系中呈现出优先表达的特点。值得注意的是,ACSL4的表达水平与这些细胞系对RSL3诱导的铁死亡的敏感性之间存在高度相关性。
尤为重要的是,尽管作者对其他已知的铁死亡调节因子进行了详细检查,如细胞内谷胱甘肽(GSH)水平、系统xc-的活性以及GPX4的活性等,但在这些对铁死亡敏感的细胞系中,并未观察到这些因子的显著下调。这一发现进一步强调了ACSL4在基底样乳腺癌细胞铁死亡敏感性中的独特且核心的作用,为针对这类肿瘤的铁死亡疗法提供了新的潜在靶点。

图4 ACSL4在基地样乳腺癌细胞中的表达
作者进一步利用CRISPR–Cas9基因编辑技术,在MDA-MB-157乳腺癌细胞中特异性地消除了ACSL4的表达。随后,通过BODIPY染色进行脂质过氧化分析,结果显示这些ACSL4缺失的细胞对脂质过氧化过程表现出了显著的抗性。为了验证这一发现的特异性,作者又在这些ACSL4敲除的细胞中重新引入了带有Flag标签的ACSL4(即ACSL4-Flag),并发现恢复ACSL4的表达后,细胞重新获得了对RSL3诱导的细胞死亡和脂质过氧化的敏感性。这些实验结果表明,ACSL4在MDA-MB-157乳腺癌细胞的铁死亡过程中扮演着至关重要的角色,其表达水平的变化直接影响着细胞对铁死亡的敏感性。
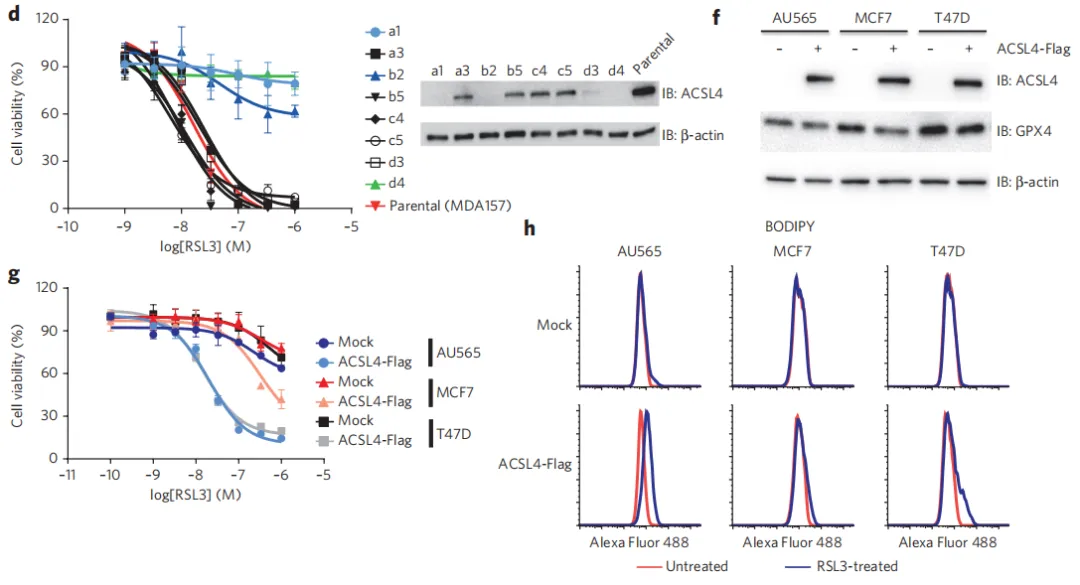 图5 ACSL4决定一组基地样乳腺癌细胞对铁死亡的敏感性
图5 ACSL4决定一组基地样乳腺癌细胞对铁死亡的敏感性
4、药理抑制ACSL4可有效阻止铁死亡的发生
为了探索ACSL4的药理学抑制作为潜在治疗铁死亡途径的可能性,作者进行了深入研究。基于早期的研究报道,噻唑烷二酮(TZDs)类药物被证实具有选择性抑制ACSL4的功能。在本研究中,作者发现TZDs家族中的罗格列酮(ROSI)、吡格列酮(PIO)以及曲格列酮(TRO)均能有效抑制Pfa1细胞中由RSL3诱导的铁死亡及脂质过氧化过程。这一发现不仅揭示了TZDs类药物在调节ACSL4活性方面的潜力,同时也为开发针对铁死亡相关疾病的新型治疗策略提供了重要线索。
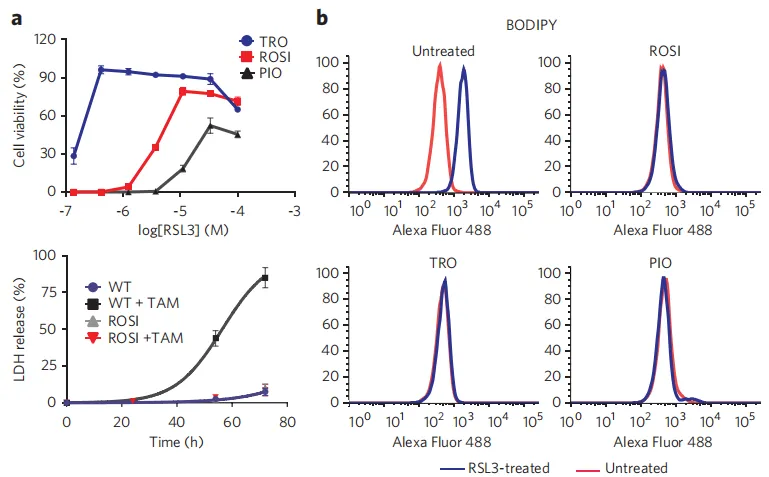 图6
图6
作者进一步发现,罗格列酮(ROSI)对RSL3诱导的铁死亡所提供的保护作用,与在ACSL4敲除(KO)细胞中观察到的现象颇为相似。为了探究ROSI的这种保护作用是否源于其能够模拟ACSL4缺乏时脂质组成的变化,作者深入分析了经ROSI处理的野生型(WT)和ACSL4敲除的小鼠胚胎成纤维细胞(MEFs)中所有主要的磷脂酰乙醇胺(PE)种类。结果显示,WT细胞在ROSI处理后,其PE的脂质体变化与ACSL4耗竭所引起的变化相一致。尤为重要的是,当对ACSL4敲除的细胞再施以ROSI处理时,含花生四烯酸(AA)和肾上腺酸(AdA)的PE含量并未进一步降低,这有力地证明了ROSI确实能够抑制ACSL4的活性。
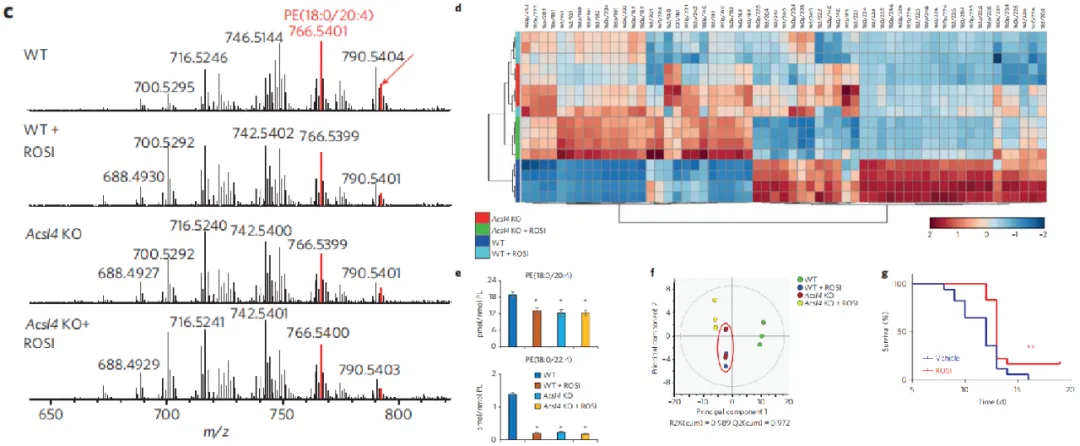 图7
图7
本篇文章深入探讨了ACSL4在调节细胞对铁死亡敏感性方面的关键作用,并明确指出ACSL4依赖性的磷脂(尤其是磷脂酰乙醇胺PE)的调节是决定细胞对铁死亡敏感性的核心因素。文章通过一系列实验,不仅揭示了ACSL4在铁死亡过程中的生物学功能,还发现了药理抑制ACSL4(如通过噻唑烷二酮TZD类药物)可能作为一种有效的药理学干预手段,用于调节和阻止铁死亡的发生。
此外,文章还提出了一个引人深思的观点:TZD类药物在不同组织病理学中展现出的某些细胞保护作用,可能与其抑制ACSL4活性、进而调节磷脂代谢和铁死亡敏感性的能力密切相关。这一发现不仅为理解TZD类药物的作用机制提供了新的视角,也为开发针对铁死亡相关疾病的新型治疗策略提供了潜在的靶点。
综上所述,本篇文章的研究成果不仅加深了我们对ACSL4和铁死亡之间关系的理解,还为未来相关领域的研究和药物开发指明了方向。这种对ACSL4依赖性磷脂调节机制的研究,以及药理抑制ACSL4作为潜在治疗手段的探讨,无疑将为铁死亡相关疾病的治疗带来新的希望和可能。
| 名称 | 货号 | 规格 |
| ACSL4 | 304506-100ug | 100ug |
| ACSL4 | 304508-100ul | 100ul |
| ACSL4 | 385302-200ul | 200ul |
| ACSL4 (F-4) | sc-365230 | 200ug/ml |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)