PARP1
在2024年2月5日,德国德累斯顿工业大学的Simon Alberti研究团队在权威科学期刊《Cell》上发表了一项题为“PARP1与DNA的共凝聚驱动DNA修复位点组装,有效阻止断裂DNA末端的分离”的重要研究成果。该研究深入探讨了DNA双链断裂(DSB)修复过程中的关键机制,特别是关于DSB位点如何组装以及断裂的DNA末端如何保持稳定性的分子层面细节。
长久以来,科学家们一直认识到DNA双链断裂对于细胞来说是极具破坏性的损伤,它可能导致染色体区域的丢失,甚至引发细胞死亡。为了应对这种挑战,细胞进化出了两种主要的修复途径:非同源DNA末端连接和同源重组,以维护基因组的稳定性。然而,关于DSB位点如何精确组装以及断裂的DNA末端如何避免分离的具体机制,在分子层面上仍缺乏全面的理解。
在这项研究中,Simon Alberti团队揭示了PARP1(多聚ADP核糖聚合酶1)在DSB修复中的核心作用。他们发现,PARP1多聚体与DNA之间形成的共凝聚物是DSB位点组装的关键。这种共凝聚不仅通过施加机械力使DNA的断裂末端紧密地结合在一起,还作为合成PAR(多聚ADP核糖)的酶活性来源,进一步促进了修复过程的进行。
更重要的是,PAR修饰在这一过程中发挥了双重作用。一方面,它帮助稳定了断裂的DNA末端,防止它们分离;另一方面,PAR修饰还促进了PARP1从DNA末端的释放,并招募了其他关键的修复效应蛋白到损伤位点。这些效应蛋白的加入进一步增强了修复过程,确保了DNA损伤能够得到及时和有效的修复。
这项研究为DSB凝聚物的分级组装提供了一个全新的、全面的模型。通过这个模型,我们可以更好地理解DNA末端连接和DNA损伤修复效应蛋白募集的分子机制。这不仅为DNA修复领域的研究开辟了新的方向,也为未来开发针对DNA损伤相关疾病的治疗策略提供了重要的理论基础和实验依据。

在细胞内部,PARP1作为一种高度丰富的核蛋白,其在细胞核内的浓度高达10至20微摩尔,凸显了其在细胞核中的重要地位。当细胞遭遇特定的DNA损伤时,PARP1会迅速响应并聚集到损伤部位。研究者在体外实验中观察到,PARP1与双链DNA的结合能力具有明确的数量关系:单个PARP1分子能够稳定地结合21个碱基对的双链DNA,而当DNA长度增加至45个碱基对时,大约需要1到2个PARP1分子进行结合;若DNA长度达到100个碱基对,则大约需要3个PARP1分子来形成稳定的结合。值得注意的是,与PARP1同源的PARP2并不具备与双链DNA形成凝聚物的能力,同时,单链DNA、单链RNA以及双链RNA也无法促进这种凝聚物的组装。
PARP1与DNA在凝聚物内部展现出了缓慢的动力学特征,这表明PARP1-dsDNA凝聚物是通过一系列可逆的相互作用而达到稳定的。研究者进一步发现,当DNA的3′和5′末端同时被阻断时,凝聚物的组装将受到完全抑制;而如果仅阻断一条DNA链的末端,凝聚物的形成则会受到部分影响。这些结果有力地证明了PARP1必须与两条DNA链同时发生相互作用,才能形成稳定的凝聚物。此外,当两条DNA链的5′端都被阻断时,凝聚物的组装也会受到损害,这进一步证实了PARP1是通过分别与DNA的5′端和3′端相互作用来稳定凝聚物的。
研究者深入揭示了PARP1与损伤DNA共凝聚的具体机制。在这一过程中,PARP1蛋白的ZnF结构域和WGR结构域之间的分子间相互作用起到了关键作用,它们驱动了PARP1二聚体的稳定形成。随后,DNA结合的PARP1分子之间的ZnF3和BRCT结构域介导的分子间蛋白质-蛋白质相互作用,进一步组装成了PARP1-DNA共凝聚体。这些分子间的相互作用在凝聚物内部产生了平衡的双向凝聚力,有效地防止了DNA末端的分离。与此同时,PARP1-DNA共凝聚与PARP1的激活过程同步发生,并在空间上严格限制了PAR在损伤部位的合成。
PAR聚合物在这一过程中发挥了招募效应蛋白的重要作用,如FET蛋白和poly (ADP) 核糖-糖水解酶(PARG),并介导了PARP1从DNA末端的释放,从而启动了凝聚物的修复过程。FET蛋白的募集到已激活的凝聚物上,不仅防止了凝聚物的溶解,还促进了凝聚物状态从刚性到动态的转变,为FET蛋白的凝聚特性提供了关键的功能作用。本研究的发现为断裂的DNA末端如何保持空间连接提供了一种全新的分子和物理机制,同时确保了修复因子能够顺利进入损伤部位进行修复。
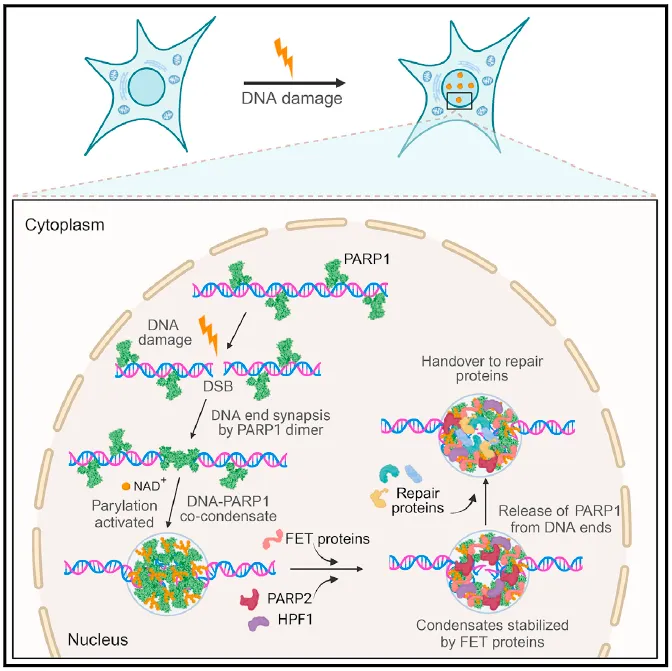
综上所述,本研究深入揭示了PARP1与DNA在DNA断裂位点共同凝聚的复杂机制,这一过程确保了断裂的DNA末端能够紧密相连,并为修复蛋白的组装提供了必要的平台。值得注意的是,当前临床上已采用PARP抑制剂,通过合成致死机制来治疗癌症,这一应用与PARP1与双链DNA形成的共凝聚物机制紧密相关。因此,本研究对于理解PARP1抑制剂如何精准调控DNA损伤凝聚物具有重要意义,有望为开发更为高效、精准的癌症治疗方法提供新的思路。
| 名称 | 货号 | 规格 |
| Rabbit anti-PARP1 Polyclonal Antibody | abs115182-50ul | 50ul |
| Mouse anti-PARP1 Monoclonal Antibody(10C2) | abs158390-100ul | 100ul |
| Rabbit anti-PARP1 Polyclonal Antibody | abs134014-50ul | 50ul |
| Rabbit anti-PARP1 Polyclonal Antibody | abs155227-50ul | 50ul |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)