cGAS-STING
cGAS-STING DNA感应信号传导路径
在脊椎动物细胞内,环化GMP-AMP合成酶(cGAS)扮演着DNA的主要侦测角色。cGAS无需区分DNA序列,便能与双链DNA(dsDNA)的糖-磷酸骨架紧密结合,进而触发其结构变化,激活GTP与ATP,促使它们合成环化GMP-AMP(cGAMP)。一旦生成,cGAMP会迅速在细胞内扩散,并与位于内质网(ER)膜上的干扰素基因刺激因子(STING)跨膜蛋白相遇并结合。
这种结合会导致STING的构型发生改变,从而揭示出特定的结合位点,这些位点能够招募tank结合激酶1(TBK1)和转录因子干扰素调节因子3(IRF3)。随后,IRF3会经历TBK1催化的磷酸化过程,形成二聚体,并转移到细胞核内,以激活干扰素(IFN)基因的转录。
除了激活IFN基因外,STING还能与NF-kB转录因子发生相互作用,共同诱导促炎症细胞因子和趋化因子的表达,从而进一步调控免疫反应。

在脊椎动物体内,任何来源的双链DNA(dsDNA)都可能激活环化GMP-AMP合成酶(cGAS),这引发了一个关于如何区分自身与非自身DNA的复杂问题。以罕见的遗传性疾病——Aicardi-Goutieres综合征(AGS)为例,该疾病的部分病例源于代谢、修饰或包裹自身DNA的酶发生突变,错误地激活了cGAS,进而引发严重的病理反应。此外,细胞衰老过程中积累的DNA损伤似乎也能激活cGAS,从而加速衰老过程,并促进“炎症老化”的发生。
然而,另一方面,越来越多的证据表明,这些相同的自我DNA反应机制在抗癌免疫保护中发挥着重要作用,特别是在辐射和化疗等治疗手段的刺激下。因此,自我DNA激活cGAS的潜力巨大,既可以导致病理效应,也可以发挥保护作用,这取决于具体的生理和病理条件。
4月9日,华盛顿大学的Daniel B. Stetson教授团队在知名免疫学期刊《Immunity》上发表了一篇题为“cGAS-STING细胞内DNA感应通路的新领域”的综述文章。在这篇综述里,作者深入剖析了cGAS的病理与保护双重角色,并着重介绍了两个最新的研究进展,这些进展为我们理解cGAS-STING通路的调控机制提供了全新的视角。
首先,文章揭示了cGAS与染色质之间紧密关联的新发现,这一发现对传统的“细胞质DNA传感”观念提出了挑战。其次,文章阐述了cGAMP作为免疫信号分子的新功能,它能够跨越细胞边界传递信号,这一发现对于免疫病理治疗及抗癌免疫的增强具有重要意义。此外,该综述还探讨了cGAS途径在识别细胞自身DNA损伤方面的作用,以及该途径在肿瘤免疫治疗和细胞衰老研究等领域的潜在应用前景,为未来的科学研究指明了方向。

cGAS的分布
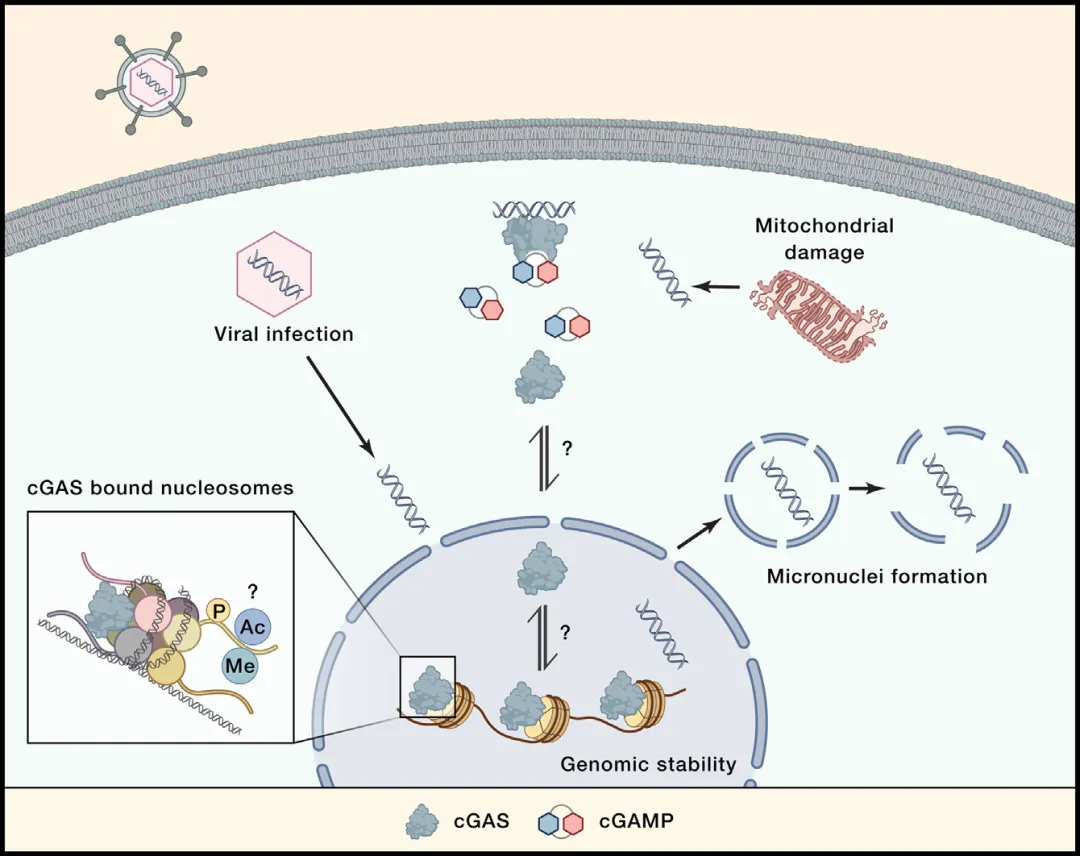
自cGAS被发现以来,它一直被视为一种位于细胞质中的模式识别受体(PRR),且因其无序列特异性,人们认为其在细胞质中的定位对于防止cGAS-STING通路异常激活至关重要,从而保护核DNA免受干扰。
然而,最新的研究成果却揭示了一个不同的景象:在多数细胞类型中,cGAS主要定位于细胞核内,并与染色质紧密结合。cGAS的N端对于其核定位以及在着丝粒DNA和长散布核元件(LINEs)上的富集至关重要。尽管cGAS在细胞核中的存在看似稳定,但具体的调控机制尚未完全明确。有研究表明,细胞周期可能影响cGAS的分布,但也有相反的观点存在。
核内的cGAS与染色质的结合异常牢固,只有在高盐浓度条件下才能被释放。这种结合并非依赖于cGAS的DNA结合能力或其N端,而是需要cGAS表面上一组进化上保守的正电荷残基,其中人类cGAS中的R236和R255两个精氨酸残基尤为关键。这些残基的突变会导致cGAS从染色质上释放并表现出高度自反应性,表明cGAS与染色质的结合对其活性具有抑制作用。
此外,cGAS的N端对于与核小体H2A/H2B酸性片区的结合至关重要,且这种结合的强度超过了cGAS与DNA的结合强度。这种结合通过三种方式抑制cGAS的激活:一是关键DNA结合残基被重新用于与酸性片区的相互作用,从而阻止其与DNA结合;二是核小体的立体位阻阻止了cGAS的二聚化,这是其激活所必需的;三是位点A无法与DNA结合。
值得注意的是,在多数细胞类型中,cGAS同时存在于细胞质和细胞核中,但调节其分布的机制尚未完全明确。cGAS的N端可能参与将其招募到细胞质中的质膜上,而核定位序列(NLSs)和核输出序列(NESs)的表达则可能是另一种调控细胞内蛋白质分布的机制。对于cGAS而言,存在两个潜在的NLSs(NLS1和NLS2)以及一个可能的NES。NLSs通过importin介导核输入过程,而NES则可能参与cGAS在激活后从细胞核向细胞质的转移。然而,关于cGAS分布的调节机制仍有待进一步深入研究。
总的来说,关于cGAS分布的调节仍存在许多未解之谜。例如,我们尚不清楚cGAS是否可以从核小体中释放、是否在细胞核和细胞质之间动态转移以及组蛋白修饰如何影响cGAS在核小体上的结合等。
核内cGAS的功能
核内cGAS的具体功能仍然是科学界亟待探索的领域。尽管核内cGAS被紧密地锚定在染色质上,看似仅作为隔离多余cGAS的“储藏室”,但这一简单解释似乎难以全面揭示其真实角色。
首先,存在类似亲和力的其他酸性区域结合蛋白,如RCC1和HMGN2,已知能够从染色质上释放并参与细胞功能,这暗示cGAS也可能具备类似的活动性。其次,若核内cGAS确实仅作为无活性的“库存”,则细胞维持如此大量的无功能蛋白似乎缺乏合理的生物学意义。因此,一个更为合理的推测是,在某些特定条件下,cGAS能够从染色质上“解脱”出来,投身于免疫反应之中。特别是在DNA病毒入侵时,cGAS或许会被释放或招募至细胞核内,以监测并应对病毒DNA的复制活动。然而,鉴于cGAS与核小体酸性区域间存在的高亲和力,要激活核内cGAS,必须克服这一强大的结合力。除了直接的核小体移位外,cGAS或组蛋白的翻译后修饰(PTMs),如磷酸化和甲基化,可能扮演着关键角色。这些修饰或许能够引发构象变化或电荷差异,从而削弱cGAS与核小体间的相互作用,为其释放和激活铺平道路。
尽管目前关于PTMs在调控cGAS分布和从核小体上动员的具体作用尚不明朗,但它们无疑为揭示cGAS的调控机制提供了重要线索。未来的研究应进一步深入探索组蛋白修饰如何影响cGAS与核小体的结合,以及cGAS在抗病毒和自身免疫反应中的具体功能和作用机制。

cGAMP信号传导和调控
cGAMP,这一由激活态cGAS生成的胞内信号分子,扮演着激活内质网上STING并触发免疫反应的关键角色。2014年,科学家们发现了一种名为外核苷酸焦磷酸酶/磷酸二酯酶1(ENPP1)的酶,它能有效切断cGAMP的两个磷酸二酯键,将其分解为GMP和AMP。值得注意的是,ENPP1主要定位于细胞外,这一发现提示我们cGAMP可能具备在细胞间传递信号的能力。
随后,在2019年,通过CRISPR筛选技术,科学家们确定了三个cGAMP导入子:SLC19A1、SLC46A2和LRRC8,它们能够介导特定细胞类型对cGAMP的导入。紧接着,在2022年,又发现了ATP结合盒C亚家族成员1(ABCC1)这一ATP依赖的cGAMP输出转运蛋白,它负责将cGAMP排出细胞,从而进一步证实了cGAMP的细胞间信号传递功能。至此,cGAMP的输出、导入和细胞外降解机制已被全面揭示,这使得cGAMP成为了一种能够远程传递信号的免疫信使分子。这一发现极大地深化了我们对cGAS-cGAMP-STING途径生物学的理解。
从理论层面来看,我们可以将cGAS-cGAMP-STING途径的生物学模型扩展为三细胞模型:其中一个细胞负责产生并输出cGAMP,另一个细胞负责导入cGAMP并激活STING进行信号传导,而第三个细胞则提供降解细胞外cGAMP的ENPP1酶。此外,最新的研究还发现了一个ENPP1的旁系同源基因ENPP3,它同样具备降解细胞外cGAMP的能力。值得注意的是,ENPP1和ENPP3具有不同的组织依赖性表达模式,这表明它们在功能上并非冗余。同时,另一种可诱导的cGAMP降解酶SMPDL3A也被新近发现,它可能在细胞内和细胞外均发挥重要作用。这些新发现无疑为我们进一步揭示cGAMP信号传导和调控的复杂机制提供了新的视角和线索。
总结
本综述论文聚焦于cGAS-STING细胞内DNA感应途径的最新科研进展,深入剖析了cGAS在自身免疫疾病、衰老及癌症免疫中所扮演的病理与保护双重角色。论文核心亮点在于两大最新科研进展的阐述:
首先,对“细胞质DNA感知”的传统观念提出了挑战,揭示了cGAS与核小体的紧密结合现象。这一发现表明,大部分cGAS并非游离于细胞质中,而是紧密锚定于核小体上,从而有效抑制其活性,避免被细胞自身的DNA所激活。这一新发现为我们重新审视cGAS的功能与调控机制提供了全新的视角。其次,论文强调了cGAMP作为一种重要的免疫传递分子,在细胞间信号传递中的关键作用。cGAMP能够借助特定的转运蛋白,在细胞间自由穿梭,进而激活STING通路,发挥免疫调节作用。这一发现不仅拓宽了我们对cGAS-STING通路的理解,还为探索细胞间免疫通信的新机制提供了重要线索。
这些前沿的研究成果为深入理解cGAS-STING通路的调控机制打开了新的窗口,同时也为利用该通路进行疾病治疗提供了更为广阔的思路和可能。论文最后还展望了未来的研究方向,包括进一步探索cGAS在细胞内的不同定位及其调控机制,以及开发针对cGAS-STING通路的新型药物,以期为该领域的研究和临床应用注入新的活力。
| 名称 | 货号 | 规格 |
| cGAS (E5V3W) Rabbit mAb | 79978S | 100ul |
| cGAS Recombinant Rabbit mAb (S-708-15) | S0B0396-1ml | 1ml |
| cGAS (D-9) | sc-515777 | 200ug/ml |
| cGAS (C-1) | sc-515802 | 200ug/ml |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)