引言
扩散的肿瘤细胞具有灵活的新陈代谢,可以利用远端器官中的营养物质,这一特性使得肿瘤细胞能够在不同环境中生存并引发转移。然而,肿瘤细胞如何适应并促进这种新陈代谢机制的具体过程仍不完全清楚。近年来,动力蛋白相关蛋白1(DRP1)在调控线粒体裂变和功能中的作用逐渐受到关注,特别是在肿瘤转移中扮演的角色。本文将对DRP1在潜伏脑转移细胞(Lat)中的功能进行解析,探讨其在脂肪酸氧化(FAO)、线粒体动力学及氧化还原平衡中的作用,并讨论其在乳腺癌脑转移中的潜在治疗应用。

一、DRP1概述
动力蛋白相关蛋白1(DRP1)是一种GTP酶,主要定位于线粒体外膜,参与调控线粒体的裂变过程。DRP1的活性受多种翻译后修饰的调节,包括磷酸化、乙酰化等。其中,DRP1第616位点的丝氨酸磷酸化(S616)是常见的调节方式,磷酸化的DRP1会向线粒体外膜募集,促进线粒体的裂变。DRP1的功能异常与多种疾病相关,包括神经退行性疾病、衰老和癌症。

二、DRP1在潜伏脑转移细胞(Lat)中的作用
1. Lat细胞吸收反应性星形胶质细胞分泌的脂肪酸(FAs)
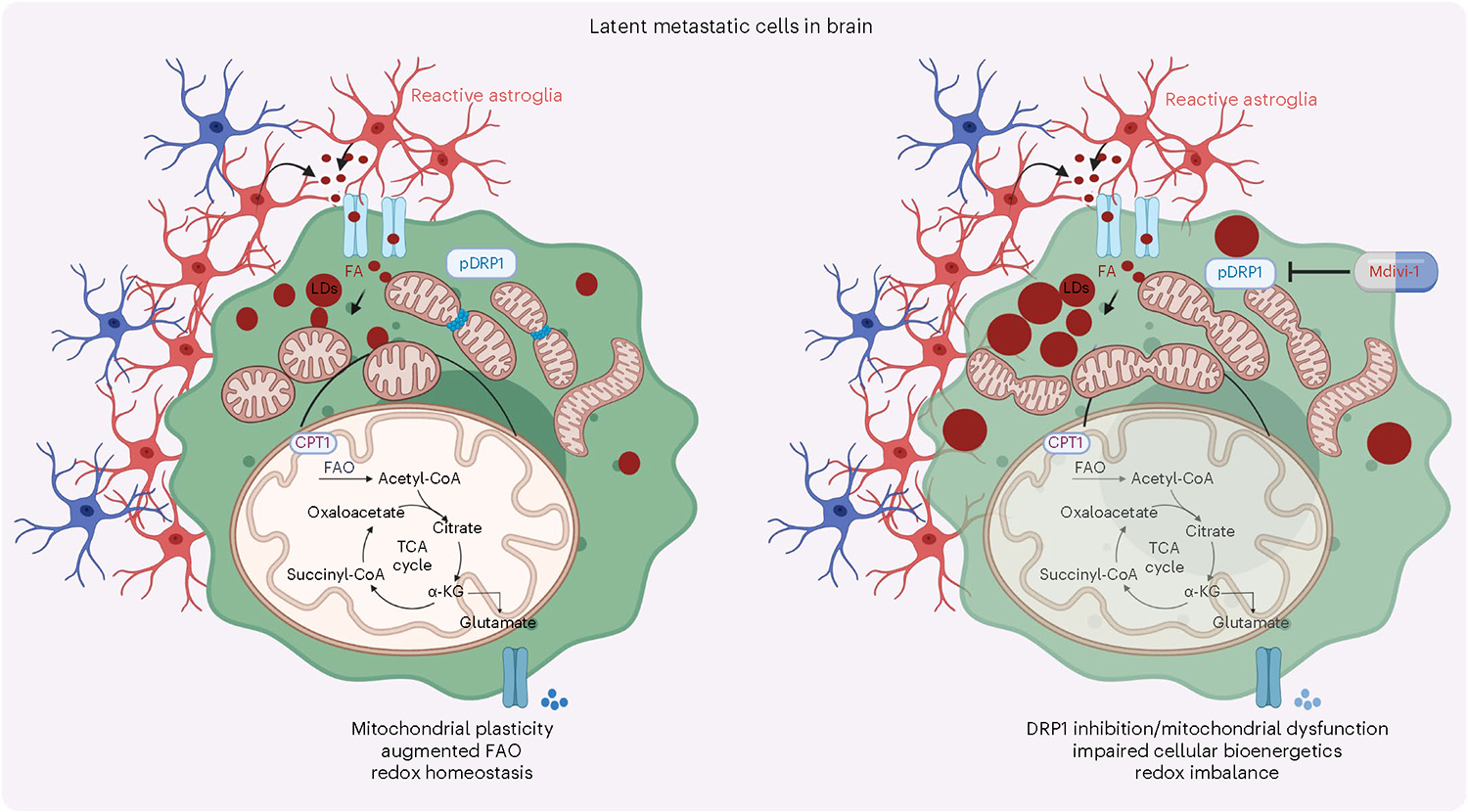
乳腺癌转移到中枢神经系统是致命的,晚期乳腺癌患者中约有25-50%出现脑转移。为了了解扩散的肿瘤细胞是如何持续存在并引发远期转移的,研究人员从小鼠体内分离出了潜伏的脑转移(Lat)细胞。通过脂质组图谱分析发现,Lat细胞中的中性脂肪酸含量较高,表明Lat细胞具有更好的吸收外源脂质的能力。进一步的研究发现,Lat细胞被反应性星形胶质细胞包围,并能从星形胶质细胞中吸收荧光标记的脂肪酸(FAs)。这表明Lat细胞能够通过吸收外源FAs来维持其代谢需求。
2. Lat细胞中丰富的线粒体碎片点状结构
通过透射电子显微镜观察发现,Lat细胞与亲代细胞相比,线粒体碎片更小,呈点状分布。TOMM20染色也证实了Lat细胞中点状线粒体的数量增加。这一发现表明Lat细胞具有独特的线粒体形态,可能与其代谢适应性和生存能力有关。
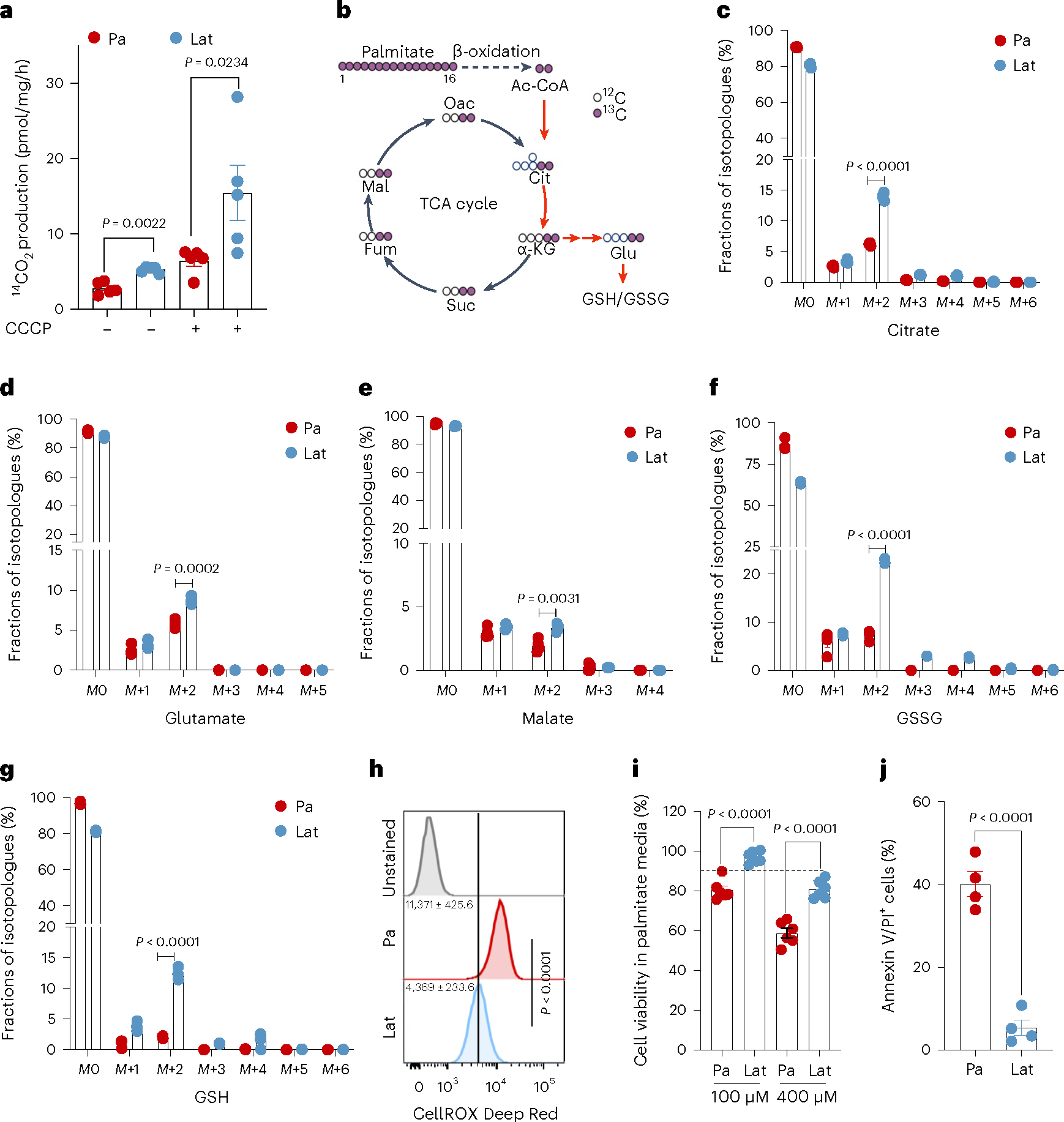
3. Lat细胞氧化内化的FAs并维持氧化还原平衡
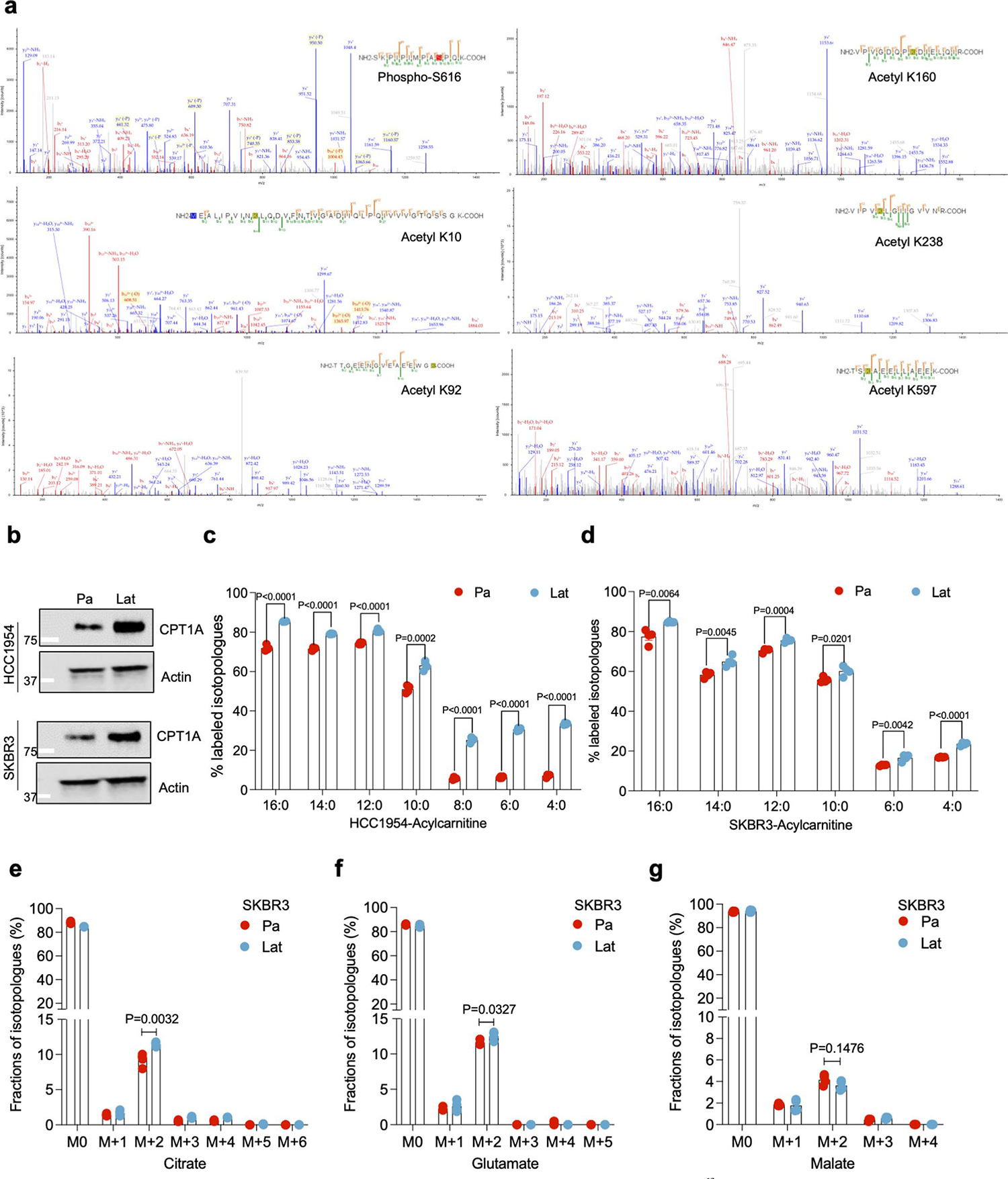
内化的脂肪酸可以被导入线粒体进行β-氧化,产生乙酰辅酶A(Acetyl-CoA),进入三羧酸(TCA)循环,促进细胞在应激或营养耗竭条件下的存活。与亲代细胞相比,Lat细胞在棕榈酸酯处理后产生更多的14CO2,表明其FAO增加。同位素追踪分析也显示Lat细胞中柠檬酸盐、谷氨酸盐和苹果酸盐的M+2同位素明显富集,表明Lat细胞能够更好地利用脂肪酸进行代谢。此外,Lat细胞中的棕榈酸酯衍生的碳富集于谷胱甘肽的还原型(GSH)和氧化型(GSSG)形式中,且ROS减少的Lat细胞中GSH/GSSG比率升高。这些结果表明Lat细胞能够通过氧化内化的FAs来维持氧化还原平衡,这对转移启动细胞至关重要。
4. DRP1驱动的线粒体动力学可实现FAO和氧化还原平衡
Lat细胞中DRP1和活化的磷酸化形式p-DRP1S616水平升高。透射电子显微镜和免疫荧光分析表明,DRP1的缺失会导致Lat细胞中线粒体长度增加,呈管状分布,点状线粒体数量减少。进一步的研究发现,DRP1的缺失导致Lat细胞对脂肪酸的利用减少,柠檬酸、谷氨酸和苹果酸的M+2同位素富集分数减小,谷胱甘肽水平下降,ROS增加,细胞活力降低。这些结果表明DRP1驱动的线粒体动力学对于Lat细胞中的FAO和氧化还原平衡至关重要。
5. DRP1驱动的线粒体可塑性促进转移潜伏期
为了评估DRP1消耗对转移潜伏期的影响,研究人员向小鼠心内注射了Ctrl和DRP1敲除的Lat细胞。与对照组相比,携带DRP1敲除的Lat细胞的小鼠中存活的潜伏细胞数量显著减少。进一步的研究发现,DRP1的缺失导致Lat细胞在NK细胞耗竭后没有观察到明显的转移,表明残余疾病已被消除。这些结果表明DRP1驱动的线粒体可塑性促进了Lat细胞的存活和转移潜伏期。
6. 人脑转移瘤中磷酸-DRP1升高
在HER2+乳腺癌患者中,DRP1的高表达与无远处转移生存率低相关。对7名HER2+乳腺癌患者的匹配原发肿瘤(PT)和转移灶进行免疫组化分析发现,与相应的匹配PT相比,p-DRP1S616在脑转移灶中的表达升高。此外,DRP1的耗竭导致脑部和脊柱/骨骼转移负荷显著减少,这是由于细胞凋亡增加所致。这些结果表明DRP1在乳腺癌脑转移中扮演重要角色。
三、DRP1抑制剂在肿瘤转移治疗中的应用
1. 药物抑制DRP1可减轻脑转移
线粒体分裂抑制剂1(Mdivi-1)是一种DRP1抑制剂,能够抑制依赖于DRP1的线粒体分裂。研究人员评估了Mdivi-1对脑转移的影响。将Lat和M-BM细胞注射到小鼠心内后,给予Mdivi-1口服治疗。结果显示,抑制DRP1可显著减少携带M-BM细胞的小鼠中存活的潜伏细胞数量,并降低脑转移发生率。这表明限制DRP1的功能,进而阻碍线粒体的可塑性,可减轻潜伏和转移的脑转移细胞的存活率。
2. DRP1抑制剂在其他癌症类型中的潜在应用
除了乳腺癌外,DRP1抑制剂也可能在其他有脑转移倾向的癌症类型中具有治疗应用。例如,胶质瘤等神经系统肿瘤也表现出线粒体形态破碎的特征,抑制DRP1可能导致肿瘤细胞死亡增加。因此,以DRP1和线粒体分裂为靶点可能对有扩散和定植脑部倾向的癌症具有更广泛的治疗适用性。
四、DRP1与线粒体动力学的调控机制
1. DRP1的磷酸化调控
DRP1的磷酸化是其活性调节的重要方式之一。肾上腺素能受体(AR)激动剂可以增加DRP1 S616的磷酸化,诱导线粒体裂变。而DRP1抑制剂可以减少AR激活诱导的心肌细胞肥大。此外,在压力超负荷的小鼠心脏中也观察到DRP1 S616磷酸化的增加。然而,DRP1 S616磷酸化在心肌细胞中的上游调控通路和线粒体代谢功能尚不清楚。
2. FAK-ERK1/2-DRP1信号通路
研究发现,细胞外纤连蛋白和肾上腺素刺激可以通过FAK-ERK1/2-DRP1通路来调控心肌细胞中的线粒体形态和功能。FAK(粘着斑激酶)通过影响DRP1 S616的磷酸化参与调节DRP1。FAK抑制剂可以减弱心肌细胞中FAK自磷酸化信号(pY397),并呈剂量和时间依赖性地降低DRP1 S616的磷酸化。此外,纤连蛋白培养的心肌细胞中ERK1/2的磷酸化水平增加,FAK抑制剂可以降低拉伸诱导的DRP1 S616磷酸化。这表明FAK通过影响DRP1 S616磷酸化参与调节DRP1介导的线粒体裂变。
3. DRP1与线粒体代谢功能的关系
DRP1不仅参与线粒体的裂变过程,还影响线粒体的代谢功能。在Lat细胞中,DRP1的缺失导致脂肪酸利用减少,柠檬酸、谷氨酸和苹果酸的M+2同位素富集分数减小,谷胱甘肽水平下降。这表明DRP1对于Lat细胞中的线粒体代谢功能至关重要。此外,DRP1的缺失还导致Lat细胞在棕榈酸酯处理后细胞死亡增加和肿瘤球形成减少。这些结果表明DRP1驱动的线粒体动力学和代谢重编程对于Lat细胞的存活和转移至关重要。
五、结论与展望
本文综述了DRP1在潜伏脑转移细胞(Lat)中的作用机制及其在乳腺癌脑转移中的潜在治疗应用。DRP1通过调控线粒体动力学和脂肪酸氧化过程,维持Lat细胞的生物能和氧化还原平衡,促进其存活和转移。药物抑制DRP1可以破坏线粒体动力学、细胞生物能和氧化还原平衡,导致脑转移减弱。这些研究结果表明以线粒体可塑性为靶点是一种很有前景的预防转移复发的治疗方法。
未来的研究可以进一步探索DRP1在其他类型肿瘤中的作用机制,以及DRP1抑制剂与其他治疗手段联合应用的疗效和安全性。此外,还可以深入研究DRP1的上游调控通路和与其他信号分子的相互作用关系,为开发更有效的抗肿瘤药物提供理论依据。
| 名称 | 货号 | 规格 |
| Phospho-DRP1 (Ser616) Antibody | 3455S | 100ul |
| Phospho-DRP1 (Ser637) Antibody | 4867S | 100ul |
| DRP1 (6Z-82) | sc-101270 | 100ug/ml |
| DRP1 (D6C7) Rabbit mAb | 8570S | 100ul |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)