Pull-Down
在生物学研究中,蛋白质相互作用是理解生命活动的基础。为了深入探究这些复杂的相互作用关系,科学家们开发了一系列体外实验技术,其中GST Pull-Down技术以其操作简便、灵敏度高而备受青睐。今天,我们就来一起揭秘这项技术的原理、实验流程、优缺点以及常见问题与解决方法,带你领略蛋白质相互作用的奇妙世界。
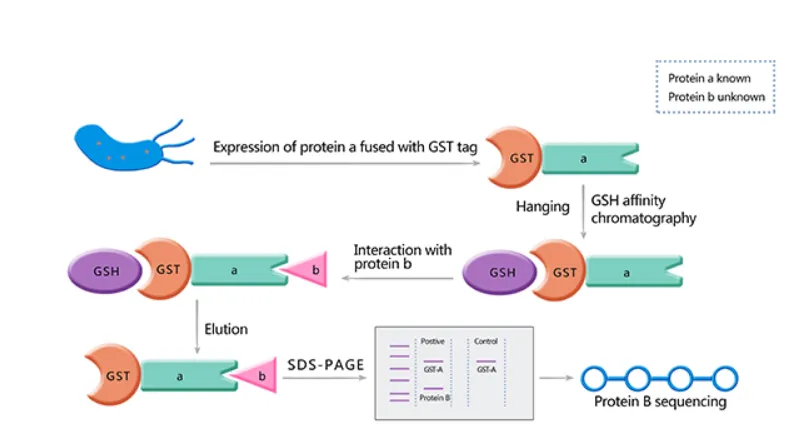
一、技术原理
Pull-Down技术的核心在于将目标蛋白质固定在一种基质上,如Sepharose。当细胞提取液流经这种基质时,能够与固相化蛋白产生相互作用的配体蛋白就会被吸附,而其他未发生作用的蛋白则会被冲洗掉。通过改变洗脱液的组成或洗脱条件,我们可以回收那些被吸附的目标蛋白。
为了提高Pull-Down技术的效能,研究者们将目标蛋白与一种易于纯化的配体蛋白结合,形成融合蛋白。谷胱甘肽S-转移酶(GST)作为一种常用的融合标签,能够与谷胱甘肽(GSH)相互作用,被吸附在固定有GSH的色谱柱上。这样,当细胞提取液通过该柱时,就能找到与“诱饵”蛋白相互作用的感兴趣蛋白。
二、实验流程
GST Pull-Down技术的实验流程主要包括以下三个步骤:
- 制备GST-融合蛋白:首先,我们需要克隆目标蛋白质的亲和结合区域基因片段到GST-融合表达载体中。然后,将重组的GST-融合表达载体转化到大肠杆菌中,进行培养并收集细胞。通过超声破碎等方法裂解细胞,得到GST-融合蛋白。
- 制备细胞裂解液:选择适当的细胞裂解缓冲液,如PBS缓冲液,并加入蛋白酶抑制剂和磷酸酶抑制剂以保护蛋白质的完整性。
- GST-Pull Down实验:将制备好的GST-融合蛋白固定在亲和柱上,如GST琼脂糖亲和树脂。将细胞裂解液与亲和柱进行孵育,使目标蛋白质与GST-融合蛋白结合。通过洗涤步骤去除非特异性结合的蛋白质后,使用洗脱缓冲液洗脱目标蛋白质与GST-融合蛋白的结合物。最后,收集洗脱液进行后续的蛋白质分析,如SDS-PAGE和质谱分析。
三、优缺点
GST Pull-Down技术具有诸多优点:
- 鉴定的蛋白是直接作用的蛋白,非间接作用的复合体,结果更加准确可靠。
- GST标记可把一些难溶蛋白变成可溶蛋白,使实验变得更易操作。
- GSH谷胱甘肽偶联球珠亲和力强,洗脱纯度高,有利于后续分析。
然而,该技术也存在一些局限性:
- 两个非同一定位的蛋白可能因电荷或是强亲和力的原因造成假阳性,需用其他方法再次验证,例如Co-IP等。
- 验证互作是在试管中进行的生化反应,不能够完全反映细胞内蛋白真实互作的状态。
- 融合表达的GST标签肽链较长,可能会改变原目的蛋白的原有的折叠结构,影响实验结果。
四、常见问题及解决方法
- IP、Co-IP、Pull-Down的区别:IP捕获目的蛋白,Co-IP捕获目的蛋白和其互作蛋白,而Pull-Down则用融合标签的重组蛋白来捕获其互作蛋白。三者各有优劣,需根据实验需求选择合适的方法。
- 如何区分蛋白表达在上清还是包涵体:通过观察超声碎菌后的菌液清澈度和沉淀情况,可以初步判断蛋白的表达位置。若菌液清亮且沉淀少,则蛋白基本可溶;若菌液浑浊且沉淀多且白,则蛋白可能表达在包涵体中。
- 如果蛋白表达在包涵体中是否可以进行后续GST Pull Down实验:虽然包涵体中的蛋白未正确折叠,但可以尝试使用高浓度的尿素或盐酸胍使其变性解聚后再进行实验。
- GST-融合蛋白的表达量较低:检查基因片段是否正确克隆到表达载体中,优化大肠杆菌的培养条件,或考虑使用其他表达系统如哺乳动物细胞表达系统。
- GST-Pull Down实验后目标蛋白质的纯度较低:增加洗涤步骤的次数和优化洗涤缓冲液的成分可以提高目标蛋白质的纯度。此外,也可以考虑使用其他亲和柱材料如Ni-NTA亲和树脂进行实验。
总之,GST Pull-Down技术作为一种有效的体外研究蛋白质相互作用的方法,在生物学研究中发挥着重要作用。
| 名称 | 货号 | 规格 |
| PIERCE MAGNETIC RNA PULL-DOWN | 20164 | KIT,20RXNS |
| PIERCE PULL-DOWN | 21115 | BIOTINYLATED-PROTEIN:PROTEIN |
| ACTIVE RHO PULL-DOWN AND | 16116 | DETECTIONKIT |
| ACTIVE RHO PULL-DOWN AND | NCI16116CST | DETECTIONCOMPONENTSFORCST |











 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)