深入解析NLRP3、NF-κB P65、TLR4与IL-1β信号通路的相互作用机制
信号通路是一种机制,它描述了当细胞需要响应某种外部刺激时,信息如何从细胞外部传递到细胞内部,并促使细胞根据这些信息做出相应的反应。这一概念最初在1972年以“信号转换”的形式被提出,而到了1980年,M. Rodbell在综述中将其命名为“信号转导”,这一术语随后被广泛采纳。
信号通路实质上是一系列酶促反应通路的集合,它们负责将细胞外的分子信号(如激素、生长因子、细胞因子、神经递质以及其他小分子化合物等,统称为配体)传递到细胞内并产生效应。这些信号通路在生物体内形成了复杂的互作调控网络,对众多生物过程进行精细调控。
以动脉粥样硬化为例,这是一种慢性血管炎性疾病,对人类健康构成严重威胁。该疾病的病理改变包括脂质代谢紊乱、炎性细胞浸润、出血及血栓形成和纤维组织增生等,是冠心病、高血压病、脑卒中等心脑血管疾病的病理基础。免疫和炎症介导的信号通路在动脉粥样硬化病变中发挥着重要作用。
科研人员通过研究这些与动脉粥样硬化病变相关的信号通路(如TLR信号通路、NLRP3炎症小体通路、PCSK9通路、JAK/STAT信号通路、MAPK通路、NF-κB信号通路以及CD40/CD40L通路等),可以深入了解这些过程的机制,从而为创造新的生物标志物和治疗方法提供有力支持。这些研究对于推动动脉粥样硬化及其相关心脑血管疾病的治疗和预防具有重要意义。
NLRP3作为炎症小体的核心组件,在先天免疫应答和炎症反应中扮演着不可或缺的角色。以下是对NLRP3功能及其信号通路的详细阐述:
NLRP3作为炎症小体的传感器,能够选择性地与ASC(凋亡相关斑点样蛋白)相互作用,形成NLRP3-ASC复合物。这一复合物在信号传导中可能作为NF-kappa-B(核因子κB)信号的上游激活因子,参与调控NF-kappa-B的活性。同时,NLRP3还具有抑制RELA(NF-kappa-B的p65亚基)转录活性的功能,从而在转录水平上对炎症反应进行精细调控。
此外,NLRP3还能抑制TNF-alpha(肿瘤坏死因子α)的活性。TNF-alpha是一种重要的炎症介质,能够诱导RELA/NF-KB p65的激活和核转运,进而促进炎症反应。NLRP3通过抑制TNF-alpha的活性,可以间接地影响NF-KB信号通路的激活状态。
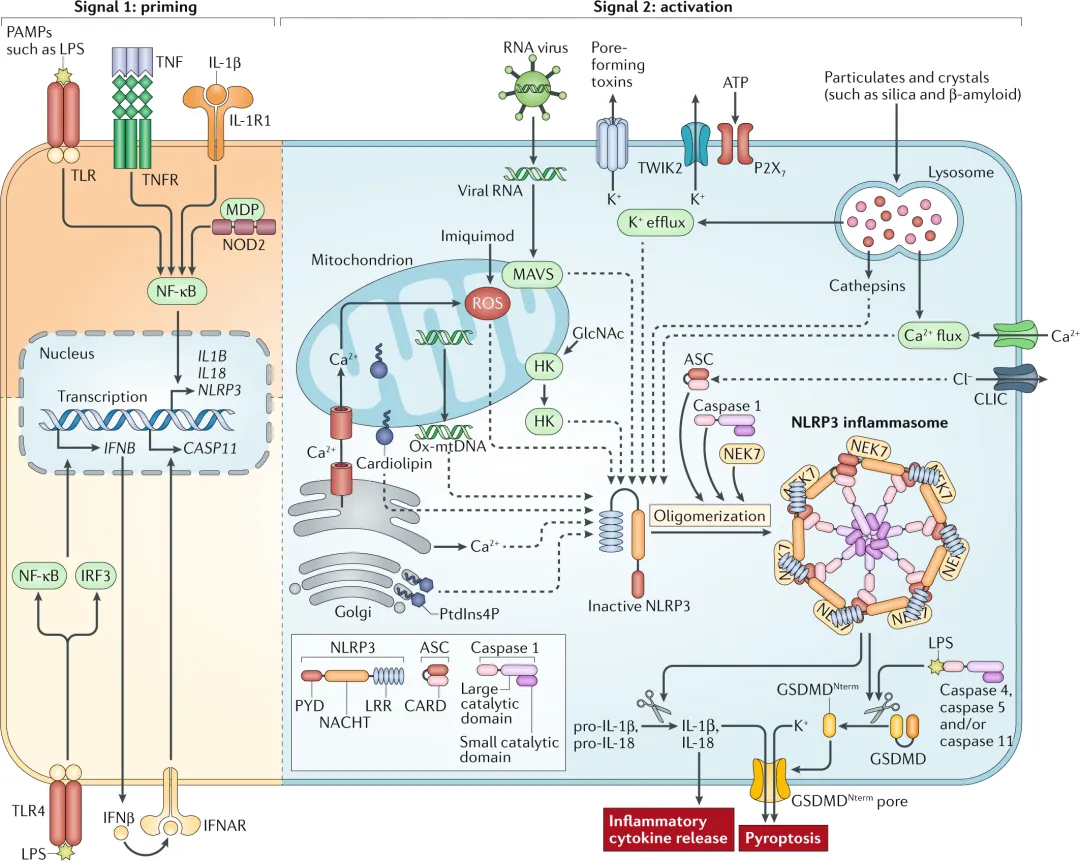
在NLRP3炎症小体的激活过程中,存在两个关键的步骤:启动和激活。启动阶段通常由内源性细胞因子或微生物分子触发,这些分子能够诱导NLRP3的表达和预组装。而激活阶段则涉及多种触发因素,如细菌或病毒感染、细胞损伤等,这些因素能够导致NLRP3构象改变,进而与ASC和caspase-1(半胱氨酸天冬氨酸特异性蛋白酶1)形成成熟的炎症小体复合物。
NLRP3炎症小体的激活包括经典和非经典两条路径。经典激活路径通过诱导caspase-1的激活,将无活性的pro-IL-1β(白细胞介素1β前体)和pro-IL-18(白细胞介素18前体)转化为具有生物活性的IL-1β和IL-18。这些活性形式的细胞因子能够进一步促进炎症反应和免疫应答。而非经典激活路径则由小鼠的caspase-11和人类的caspase-4及caspase-5诱导,它们通过间接促进pro-IL-1β/pro-IL-18的表达来参与炎症反应。
值得注意的是,活化的caspase-1和caspase-11还能够裂解GSDMD(gasdermin D),这是一种细胞膜孔道形成蛋白。GSDMD的裂解导致细胞膜孔隙的形成,进而引发细胞焦亡(一种程序性细胞死亡方式)和IL-1β/IL-18的释放。这些过程共同构成了NLRP3炎症小体介导的炎症反应和免疫应答的完整通路。
综上所述,NLRP3作为炎症小体的关键组件,在先天免疫和炎症反应中发挥着重要作用。通过精细调控NF-KB信号通路、抑制TNF-alpha活性以及介导炎症小体的激活和细胞因子的释放,NLRP3在维持机体免疫稳态和抵抗病原体感染等方面发挥着不可或缺的作用。
NF-κB p65,作为NF-κB家族的一个重要成员,是一种多效性转录因子,它在广泛的细胞类型中均有表达,并参与调控多种生物学过程,这些过程包括但不限于炎症、免疫应答、细胞分化、生长、肿瘤发生以及凋亡。NF-κB的活性受到复杂的调控机制的影响,这些机制包括翻译后修饰、亚细胞定位的变化以及与其他蛋白的相互作用。
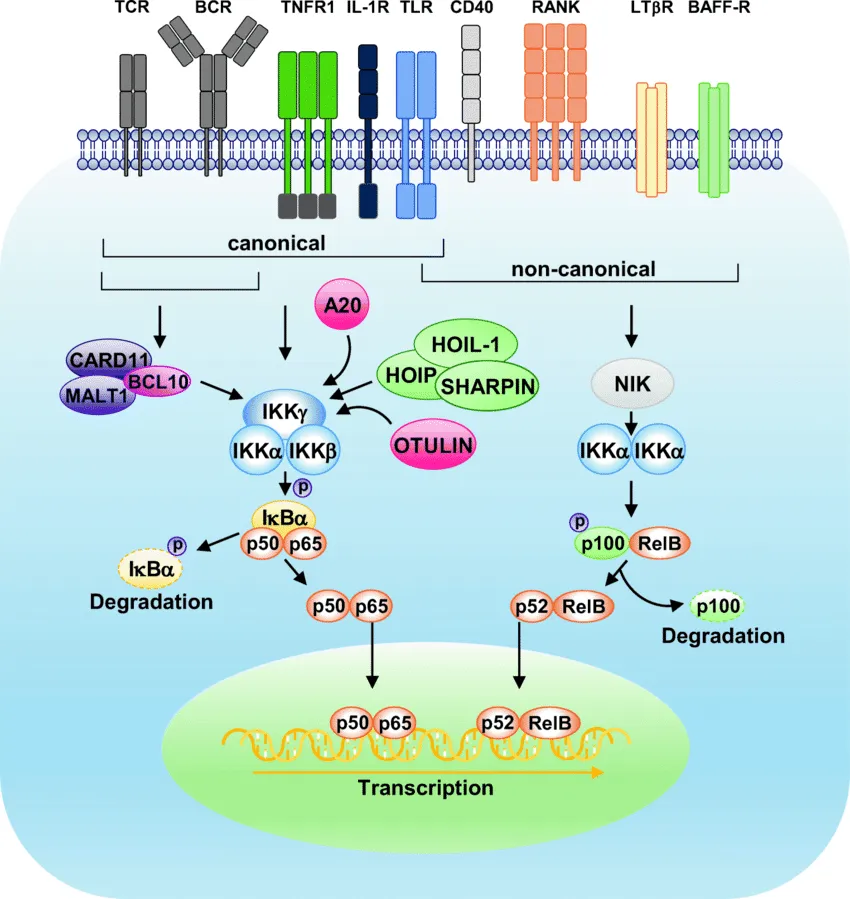
在NF-κB家族中,p65-RelA是五个亚基之一,其他还包括p50-NF-κB1、p52-NF-κB2、c-Rel和RelB。这些亚基能够形成不同的同源或异源二聚体,从而赋予NF-κB多样的功能特性。
NF-κB的转录活性受到严格的翻译后修饰调控,特别是p65-NF-κB亚基的磷酸化和乙酰化等修饰,这些修饰对于NF-κB的完全激活至关重要。
NF-κB的激活主要通过两条信号传导通路实现:经典途径和非经典途径。这两条途径都涉及IκB激酶(IKK)复合物的激活,该复合物由催化激酶亚基IKKα和/或IKKβ,以及无酶活性的调控蛋白NEMO(或称为IKKγ)组成。当细胞受到外界刺激,如自由基氧化、紫外线辐射、肿瘤坏死因子α(TNFα)、白细胞介素1-beta(IL-1β)、病原体相关分子模式(PAMPs)或细菌脂多糖(LPS)时,这些刺激会诱导NF-κB信号通路的激活。
在NF-κB信号传导通路中,p65作为关键组件,在炎症反应中发挥着重要作用。此外,NF-κB还与记忆和突触可塑性相关,这些功能对于神经系统的正常运作至关重要。然而,当NF-κB的蛋白质水平发生异常时,它可能与癌症的发生和发展密切相关。
综上所述,NF-κB p65作为一种多效性转录因子,在多种生物学过程中发挥着关键作用。其活性受到复杂的调控机制的影响,包括翻译后修饰、亚细胞定位以及与其他蛋白的相互作用。通过经典和非经典途径的激活,NF-κB能够响应外界刺激并调控下游基因的表达,从而参与调控炎症、免疫、分化、生长、肿瘤发生和凋亡等生物学过程。
TLR4(Toll样受体4)是Toll样受体家族中的重要成员,主要作为脂多糖(LPS)的受体,在识别并响应细菌等微生物成分的过程中发挥着关键作用。当LPS与TLR4结合后,会触发一系列复杂的信号传导通路,这些通路对于启动和调控炎症反应至关重要。
在TLR4信号传导过程中,MyD88(髓样分化因子88)和TRIF(TIR域含适配蛋白诱导干扰素β)依赖的信号通路被连续激活。这些通路的激活与TLR4从质膜到胞内体的重新分配密切相关。在LPS的刺激下,TLR4会经历细胞内部的易位,并最终被溶酶体降解,这一过程有助于终止炎症反应,防止过度激活导致的组织损伤。
在MyD88依赖的信号通路中,TLR4的刺激会触发MyD88与IRAK4(白细胞介素-1受体相关激酶4)的相互作用。这一相互作用进一步传递信号至NF-κB(核因子κB)和MAPK(丝裂原活化蛋白激酶),通过这一途径激活炎症因子的表达。这些炎症因子在炎症反应中发挥着关键作用,如促进白细胞募集、增强血管通透性等。
另一方面,内体TLRs(包括TLR4在内)还可以通过TRIF依赖的通路传递信号。在这一通路中,TRIF与RIP1、TRAF6和Pellino-1等蛋白相互作用,激活TAK1(转化生长因子β活化激酶1)或与非经典的TBK1和IKKε(IKK-i)一起激活干扰素调节因子3(IRF3)和IRF7。这些激活的蛋白进一步诱导炎性细胞因子和干扰素的产生,从而增强免疫反应并限制病原体的复制和传播。
综上所述,TLR4作为LPS的主要受体,在识别并响应细菌等微生物成分时,通过MyD88和TRIF依赖的信号通路触发复杂的炎症反应。这些通路的精确调控对于维持机体的免疫稳态和抵抗病原体感染至关重要。同时,TLR4信号通路的异常激活也可能与多种炎症性疾病和自身免疫病的发生和发展密切相关。因此,深入研究TLR4及其信号通路的功能和调控机制对于开发新的治疗策略具有重要意义。
| 名称 | 货号 | 规格 |
| Rabbit anti-NF-KB p65 Monoclonal Antibody(3H2) | abs159619-100ul | 100ul |
| p-NFκB p65 (27.Ser 536) | sc-136548 | 200ug/ml |
| NF-kappaB p65 (D14E12) XP ® Rabbit mAb | 8242S | 100ul |
| NF-kappaB p65 (L8F6) Mouse mAb | 6956T | 20ul |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)