抗体偶联药物
在癌症治疗的广阔领域中,基于抗体的免疫疗法和基于化学药物的化学疗法一直占据着举足轻重的地位。这两种策略各有千秋,共同构成了临床上对抗癌症的两大武器。抗体药物,以其精准靶向肿瘤细胞过度表达的抗原如HER2、EGFR、CD20等为特色,已经在临床上取得了显著的疗效。曲妥单抗、西妥昔单抗、利妥昔单抗等治疗性单抗药物的广泛应用,无疑为众多癌症患者带来了新的希望。这些抗体药物能够特异性地识别并结合到癌细胞上,从而触发免疫反应或直接抑制癌细胞的生长。
与此同时,化学疗法也以其独特的机制在癌症治疗中发挥着重要作用。烷化剂(如氮芥等)、抗体代谢剂(如氨甲喋呤等)以及抗肿瘤抗生素(如阿霉素等)等多种化学药物的出现,为遏制肿瘤增生提供了有力的手段。这些药物通过干扰癌细胞的DNA复制、代谢过程或蛋白质合成等途径,实现对癌细胞的杀伤。
然而,在临床实践中,这两种治疗方法也各自存在着局限性。治疗性抗体虽然靶向性强,但由于其分子量较大,难以穿透实体瘤的致密结构,因此治疗效果有限。而小分子的化学药物虽然具备对癌细胞的高度杀伤效力,但由于其选择性较差,往往会对正常细胞造成误伤,引发严重的副作用。
为了克服这些局限性,科学家们开始探索将抗体与化学药物相结合的创新策略——抗体偶联药物(Antibody-Drug Conjugates, ADCs)。这种药物通过特定的连接技术,将具有高度选择性的抗体与小分子的高效杀伤性化学药物偶联在一起。这样,抗体能够精准地将化学药物输送到癌细胞表面,而化学药物则能够在抗体的引导下,对癌细胞进行高效而精确的杀伤。
抗体偶联药物的出现,无疑为癌症治疗带来了新的突破。它结合了免疫疗法和化学疗法的优点,既保留了抗体的靶向性,又发挥了化学药物的高效杀伤性。这种创新的治疗策略,有望在未来成为癌症治疗领域的重要方向之一。综上所述,抗体偶联药物作为癌症治疗的一种创新融合策略,正在逐步展现出其独特的优势和潜力。随着科学技术的不断进步和临床实践的深入探索,我们有理由相信,抗体偶联药物将在未来的癌症治疗中发挥越来越重要的作用。

一百多年前,德国杰出的免疫学家保罗·欧立希(Paul Ehrlich)首次提出了单克隆抗体的“黄金子弹”学说。这一学说构想了一种革命性的治疗方式:利用单克隆抗体对抗原的特异性结合能力,实现对癌变细胞的精准靶向治疗。这一设想在当时虽然充满了挑战,但却为后来的癌症治疗研究指明了方向。随着基因工程抗体制备技术的不断成熟,以及新型化学连接技术的涌现,抗体偶联药物(Antibody-Drug Conjugates, ADCs)的概念逐渐从理论走向了现实。抗体偶联药物通过将具有高度靶向性的单克隆抗体与具有细胞毒性的抗肿瘤药物通过特定的连接片段偶联在一起,实现了抗体的高度选择性与药物的抗肿瘤活性的完美结合。
2000年,随着第一个ADCs药物Mylotarg经美国食品药品监督管理局(FDA)批准上市,用于治疗急性髓系白血病,ADC技术正式步入了大发展的阶段。这一里程碑式的事件标志着抗体偶联药物在癌症治疗领域的应用取得了实质性的突破。抗体偶联药物之所以能够在癌症治疗中发挥重要作用,是因为它实现了两大类治疗药物的优势互补。一方面,它继承了单克隆抗体的高度靶点选择性,能够精准地识别并结合到癌细胞上;另一方面,它又结合了细胞毒性抗肿瘤药物的高效杀伤性,能够对癌细胞进行有力的打击。这种结合不仅提高了药物的疗效,还扩大了药物的治疗窗口范围,使得更多的患者能够从中受益。
抗体偶联药物的整体结构相对复杂,由三个不同的结构模块组成:抗体、细胞毒性药物及连接区。这三个部分在性质上有所不同,对药效的影响也各有差异。同时,它们之间还具有一定的空间可移动性,这使得抗体偶联药物在体内能够灵活地应对各种复杂的生理环境。综上所述,抗体偶联药物作为癌症治疗领域的一种创新药物形式,已经展现出了巨大的潜力和价值。随着科学技术的不断进步和临床实践的深入探索,我们有理由相信,抗体偶联药物将在未来的癌症治疗中发挥越来越重要的作用,为更多的患者带来希望和福音。
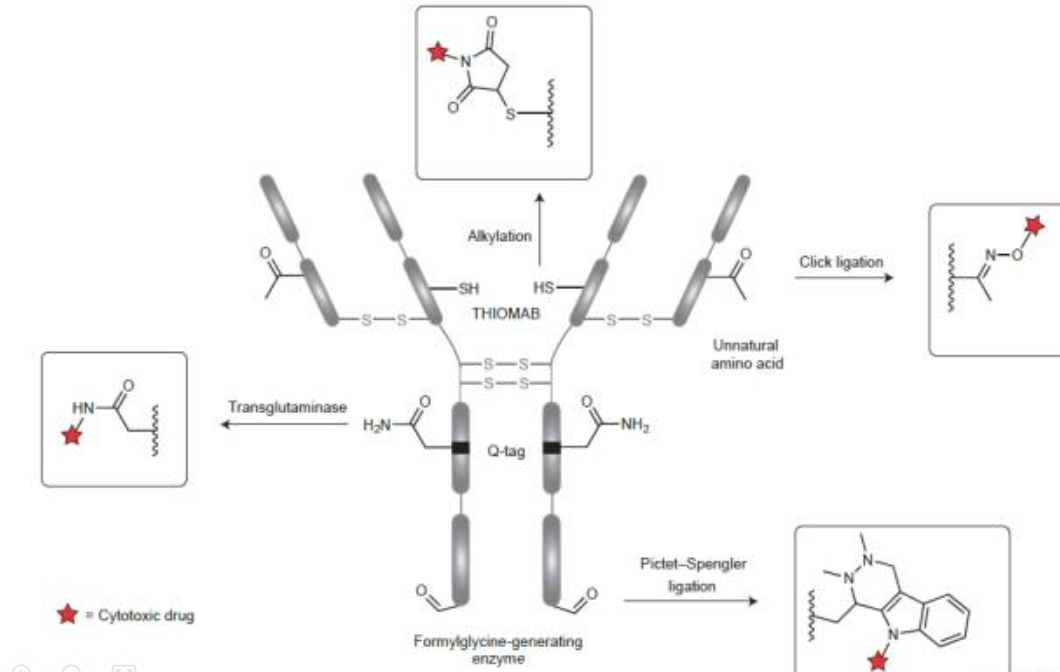
在抗体偶联药物(ADC)的研发过程中,选择理想的抗原靶点是至关重要的。一个理想的抗原靶点应具备以下特征:
首先,该抗原应在肿瘤细胞中高表达,且表达水平显著高于正常组织,同时表现出较低的肿瘤组织异质性。以T-DM1所靶向的HER-2受体为例,其在HER-2阳性细胞中的表达量可达正常组织细胞的数百倍。这种高表达特性使得ADC能够精准地识别并攻击癌细胞。其次,抗原从细胞上脱落的概率应较小,以确保药物在治疗循环中能够持续作用于靶细胞。如果抗原容易脱落,那么ADC可能无法有效地与靶细胞结合,从而影响治疗效果。第三,抗原对应的抗体应在受体介导的内吞过程中被有效地内源化,且在此过程中不被修饰。内源化是ADC发挥疗效的关键步骤之一,它允许ADC进入癌细胞内部,从而释放细胞毒性药物并杀死癌细胞。
此外,经过ADC治疗后,细胞中的靶点抗原表达水平不应发生明显下调。如果抗原表达水平下降,那么ADC可能无法再次有效地识别并攻击癌细胞,从而导致治疗失败。除了上述特征外,还有一些其他因素也应被考虑在内,如抗原-抗体复合物的内源化速度、结合能力的强弱、细胞毒性药物的有效载荷以及连接区的稳定性等。这些因素都可能影响ADC的疗效和安全性。尽管目前已有一些ADC药物成功上市或处于研发后期,但如何判定某一抗原适合于作为ADC药物开发的靶点,至今仍是一个具有挑战性的问题。目前的研究已经确定了抗原靶点的多项特征,但尚未建立明确的判定标准。
为了克服现有ADC药物的局限性,研究人员正在探索其他药物设计策略。其中一项重要策略是靶向细胞基质及血管。临床前及临床试验数据表明,新生血管内皮细胞外基质及肿瘤细胞基质中的一些组分是非常有价值的靶点性抗原。例如,纤维连接蛋白的ED-B结构域是新生血管的生物标志物之一,在侵袭性实体瘤的血管中特异性高表达。研究人员已将靶向于ED-B的人体单克隆抗体L19与其他效应分子联合使用,并作为有潜力的ADC药物进行了深入研究。这一策略为ADC药物的应用提供了新的思路。
另外,还有一些研究聚焦于肿瘤起始细胞或肿瘤干细胞(TICs)中的抗原。TICs是肿瘤细胞中具有侵袭性的亚群,对病程进展具有重要影响。通过靶向TICs中的抗原,ADC药物可能更有效地控制肿瘤细胞的增殖、转移和复发。综上所述,抗原靶点的选择是ADC药物开发的关键。通过深入研究抗原靶点的特征及其与ADC疗效的关系,我们可以为ADC药物的研发提供更加精准的指导,从而为癌症患者带来新的治疗希望和福音。
| 名称 | 货号 | 规格 |
| AF647荧光抗体偶联服务 | bulk-AF647 | bulk |
| AF647荧光抗体偶联服务 | bulk-AF647 | bulk |
| AF647荧光抗体偶联服务 | bulk-AF647 | bulk |
| AF647荧光抗体偶联服务 | bulk-AF647 | bulk |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)