Drp1
脓毒症,一种由感染触发的全身炎症性反应综合征,常导致多器官损伤及长期发病率和死亡率的上升。其中,脓毒症相关性脑病(SAE)作为脓毒症患者的严重并发症,尤其值得关注。SAE常见于严重体内感染而中枢神经系统未明显受累的病人,临床上与高死亡率紧密相关。
尽管脓毒症性脑病的病理生物学机制尚未完全明了,但已有多种假说提出。当前研究认为,脑灌注障碍和氧合失调导致的血脑屏障(BBB)改变,在脓毒症引发的神经功能障碍中扮演重要角色。此外,“细胞病理性缺氧”,即脓毒症中细胞生物能量学的干扰,特别是线粒体损伤,已被揭示为影响终末器官衰竭和最终死亡率的关键因素。线粒体衰竭的作用不仅与脓毒症性脑病相关,还与其他神经系统疾病,如中风、阿尔茨海默病(AD)、帕金森病(PD)、亨廷顿病和癫痫中的BBB功能障碍有关。
值得注意的是,先前研究已证实肽P110的治疗潜力。这是一种由7个氨基酸组成的肽,代表动力相关蛋白1(Drp1)和Fission 1蛋白(Fis1)之间的同源序列,能够减少多种神经退行性疾病中的病理性线粒体功能障碍。近期,美国斯坦福大学医学院的研究进一步评估了Drp1/Fis1相互作用在脓毒症情况下对线粒体衰竭及随后BBB功能障碍的介导作用,为脓毒症性脑病的治疗提供了新的视角。

Drp1-Fis1介导的线粒体功能障碍:LPS诱导脑微血管通透性的核心机制
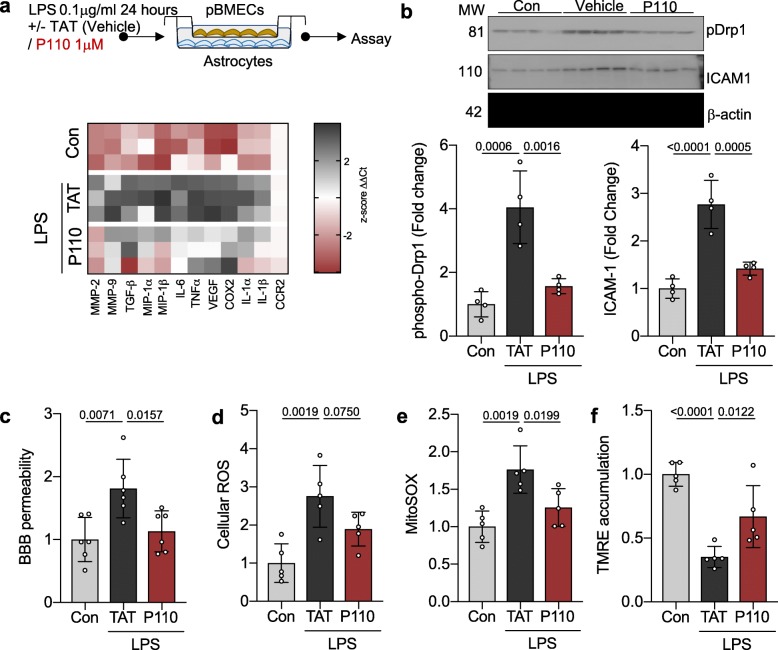
在脂多糖(LPS)处理(浓度为0.1 μg/ml,持续24小时)后,与星形胶质细胞共培养的原代脑微血管内皮细胞展现出显著的促炎表型转变,并激活了影响血管内皮通透性的关键介质(见图1a)。此变化与病理性线粒体分裂蛋白Drp1的激活密切相关,其通过丝氨酸616位点的磷酸化水平升高得以体现,标志着线粒体向分裂状态转变(见图1b)。
进一步观察显示,LPS处理导致微血管内皮细胞中的线粒体受损,伴随血脑屏障(BBB)完整性丧失。这与线粒体特异性超氧化物生成(MitoSox检测)、总氧化应激水平上升以及线粒体膜电位(TMRE检测)降低相关联(见图1c-f)。
值得注意的是,通过P110处理能够有效改善LPS介导的血管内皮功能紊乱。P110限制了影响血管内皮通透性的关键酶的激活,同时也抑制了Drp1的激活及其在线粒体的定位。此外,P110处理促进了BBB完整性的恢复,改善了线粒体健康状态,表现为氧化应激水平降低和线粒体膜电位的提升(见图1)。这些发现强调了Drp1-Fis1介导的线粒体功能障碍在LPS诱导的脑微血管通透性增加中的关键作用,并为潜在的治疗干预提供了依据。
抑制Drp1-Fis1介导的线粒体功能障碍:预防LPS诱导的神经元损伤的新策略
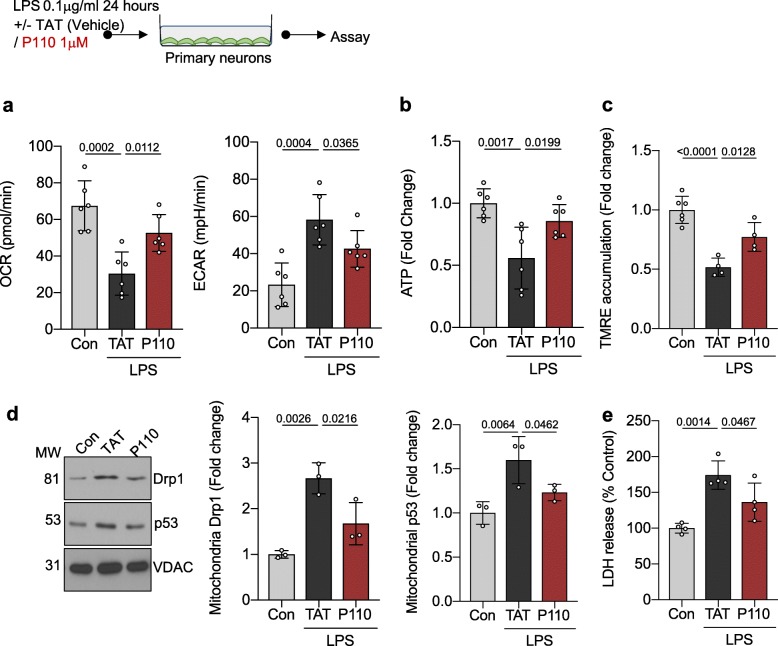
在原代神经元的评估中,LPS处理导致了显著的线粒体损伤,具体表现为氧化磷酸化过程受阻,并促使细胞代谢转向糖酵解途径。线粒体膜电位的下降以及腺苷三磷酸(ATP)生成量的减少进一步证实了线粒体受损的情况(见图2 a-c)。与脑微血管内皮细胞类似,LPS处理的原代神经元中Drp1的活化程度及其在线粒体的定位均有所增加,这凸显了在脓毒症环境下Drp1对线粒体功能衰竭进展的关键作用。此外,LPS处理还导致p53与线粒体膜的结合增强,进而增加了细胞死亡率(通过LDH检测)。
进一步的实验证据支持了Drp1-Fis1在LPS刺激下线粒体功能紊乱中的核心作用。具体而言,肽P110处理的神经元展现出了线粒体功能的改善,以及随之而来的糖酵解途径依赖减少,这导致了ATP生成量的增加。更重要的是,P110处理通过有效抑制p53的活化及其引发的细胞死亡,成功消除了LPS处理的下游负面效应。这些发现为通过抑制Drp1-Fis1介导的线粒体功能障碍来预防LPS诱导的神经元损伤提供了新策略。
抑制Drp1/Fis1介导的线粒体功能障碍对脓毒性脑病小鼠模型具有保护作用
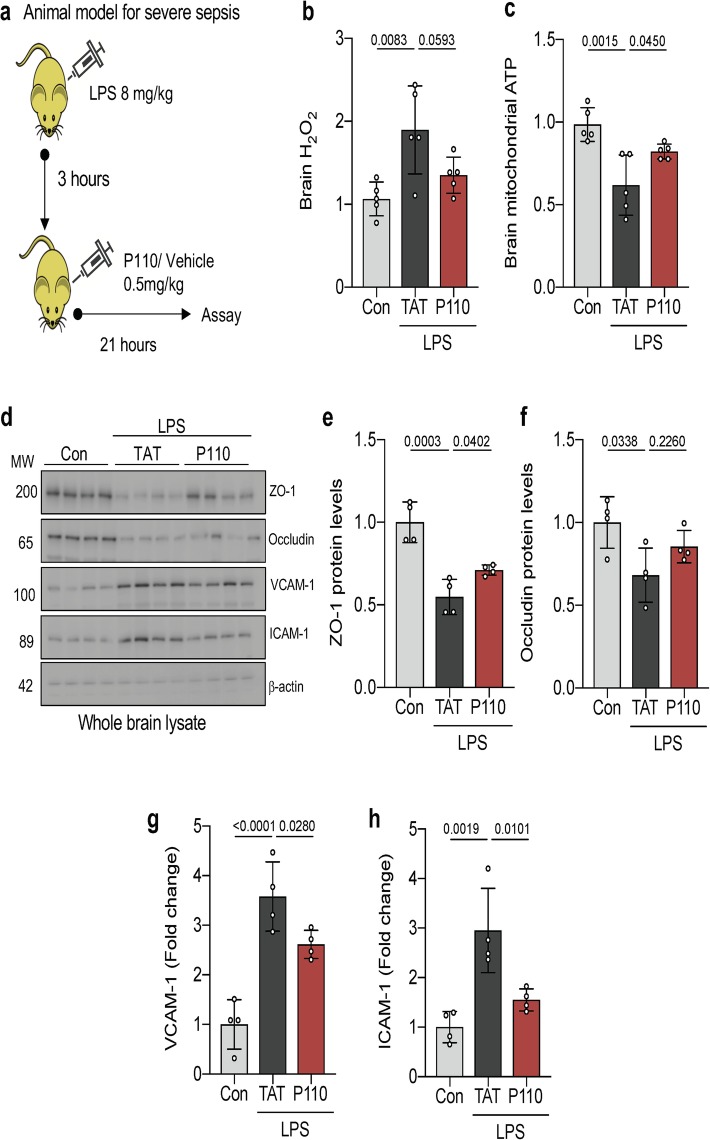
在5至7周龄的雌性BALB/c小鼠中,采用已确立的脓毒症LPS模型,实验深入探究了Drp1/Fis1相互作用在脓毒症所致脑病中的关键作用。结果显示,脓毒症小鼠的脑组织线粒体功能显著受损,具体表现为氧化应激水平升高和ATP含量下降,而这一现象在P110处理后得到了显著改善(见图3 b、c)。
在评估血脑屏障(BBB)完整性时,研究发现LPS处理导致构成血管紧密连接的关键蛋白质ZO-1和occludin显著减少,同时血管白细胞粘附分子VCAM-1和ICAM-1表达上调,这明确指示了BBB完整性的受损。值得注意的是,P110处理有效逆转了这些变化,恢复了BBB的完整性(见图3 d-h)。这些发现强调了抑制Drp1/Fis1介导的线粒体功能障碍在脓毒性脑病治疗中的潜在保护作用。
抑制Drp1/Fis1相互作用减轻脓毒症小鼠脑组织线粒体功能紊乱与降低死亡率
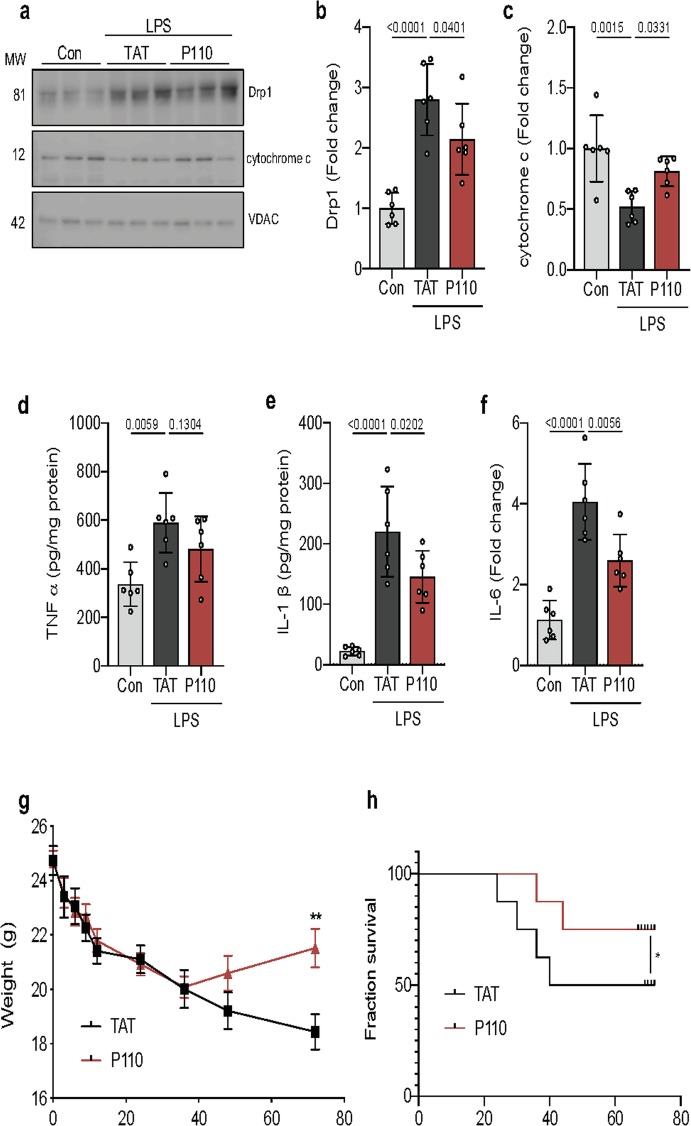
与使用细胞培养模型所得结果相一致,LPS诱导的脓毒症小鼠脑组织中线粒体功能紊乱与Drp1的激活密切相关,具体表现为Drp1磷酸化水平上升以及其在线粒体的定位增加。这些变化伴随着细胞死亡通路的激活,特别是线粒体细胞色素C的释放,这是一种强效的细胞凋亡诱导因子(见图4 a-c)。通过P110抑制Drp1/Fis1相互作用,有效降低了脓毒症小鼠线粒体细胞色素C的释放水平,并减轻了神经炎症,表现为肿瘤坏死因子TNFα、白介素ILI-β和白介素IL-6等炎症标志物的水平下降(见图4 d-f)。
在评估败血症小鼠模型的疾病严重程度和死亡率时,P110处理显著减轻了临床疾病的表现,体重减轻程度大幅减少,且体重恢复速度更快(见图4 g)。尤为重要的是,与仅接受LPS处理的小鼠相比,P110处理在48小时至94小时的观察期间内,将死亡率降低了50%(见图4 h)。这些发现进一步证实了抑制Drp1/Fis1相互作用在减轻脓毒症小鼠脑组织线粒体功能紊乱、降低神经炎症以及提高生存率方面的潜在疗效。
综上所述,本研究有力地证明了Drp1/Fis1相互作用是脓毒症相关性脑病(SAE)发病机制中的关键环节。通过这一发现,我们确定了一种具有潜力的新型治疗策略,旨在降低SAE相关的高死亡率和发病率风险。然而,为了全面评估这一机制途径和治疗靶点在减轻脓毒症环境下神经元损伤方面的实际价值,未来有必要开展大型动物实验和临床研究。这些后续研究将对于推动SAE治疗策略的进步具有重要意义。
| 名称 | 货号 | 规格 |
| Phospho-DRP1 (Ser616) Antibody | 3455S | 100ul |
| Phospho-DRP1 (Ser637) Antibody | 4867S | 100ul |
| DENR His Tag, Human | S0A2064-1mg | 1mg |
| DRP1 (D6C7) Rabbit mAb | 8570T | 20μl |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)