Th细胞
在我们看似平静的外表之下,机体内部无时无刻不在进行着一场场规模庞大的对抗“异抗原”的战斗,以确保机体的稳定状态,而免疫细胞正是这些战斗中的主力部队。免疫细胞家族庞大,其中广为人知的有T淋巴细胞和B淋巴细胞等。特别地,有一类T淋巴细胞表面表达CD4分子,被称为Th细胞,也就是辅助性T细胞。Th细胞主要通过释放多种细胞因子来调节整个免疫系统,它们在免疫反应中扮演着指挥官的角色,是名副其实的“免疫战略家”。

战事一触即发,各路军师各司其职,协同作战
Th细胞群体功能多样,依据其功能特性被细分为多个亚群,包括Th1、Th2、Th9、Th17、Th22、滤泡辅助T细胞(Tfh)及诱导型调节性T细胞(iTreg)。未遭遇抗原刺激的初始CD4+T细胞,即Th0细胞,在抗原与不同细胞因子的诱导下,可分化为具有特定功能的Th细胞亚群。Th1细胞特征性地分泌IL-2、IFN-γ、TNF-α,以T-bet为关键转录因子,主导细胞免疫应答,常通过检测胞内IFN-γ或核内T-bet来鉴定;Th2细胞则主要分泌IL-4、IL-5、IL-6等细胞因子,GATA3为其分化关键,主导体液免疫与免疫耐受,鉴定时通常检测胞内IL-4或核内GATA3;Th9细胞以分泌IL-9为标志,与抗寄生虫感染及过敏性疾病诱导紧密相关;Th17细胞特征分泌IL-17,RORγt为其核心转录因子,对自身免疫病及机体防御至关重要;Th22细胞则以分泌IL-22为特征,在调控慢性炎症性疾病进展中发挥关键作用;Tfh细胞以CXCR5、PD-1和ICOS为主要标记,促进生发中心B细胞分化为记忆B细胞或浆细胞;iTreg则由外周Th0细胞诱导表达FOXP3转化而来,区别于胸腺来源的nTreg,主要执行免疫抑制功能。这些‘军师’们相互协作又相互制约,在机体微环境中各展所长,共同维系着机体的免疫平衡。
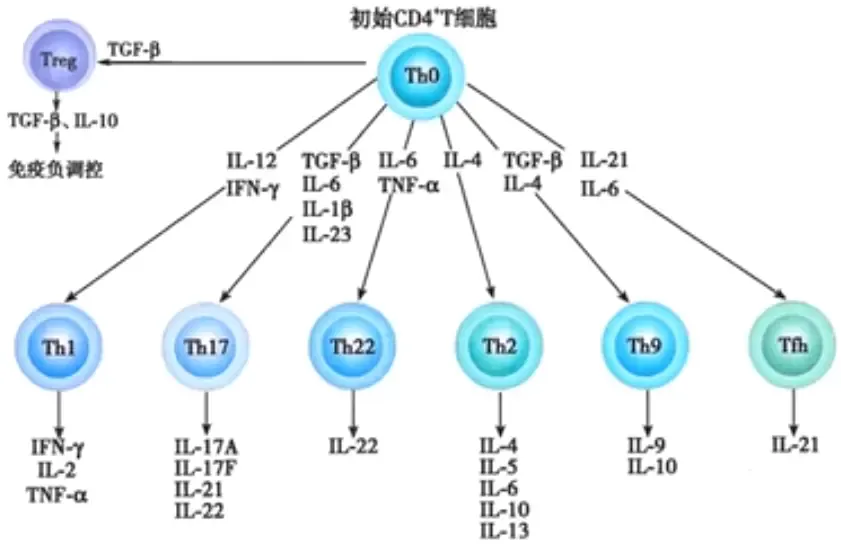
各“军师”——即Th细胞亚群——的分化过程及其功能发挥如下
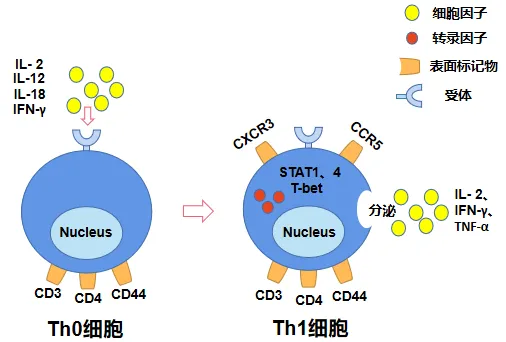
①Th1细胞:它们源自初始CD4+T细胞,在IL-2、IL-12、IL-18和IFN-γ等细胞因子的共同作用下分化而成,其中IL-12的作用尤为关键。当IL-12与初始CD4+T细胞表面的受体结合后,会激活STAT4信号通路,进而推动Th1细胞的分化和发育。同时,IFN-γ以自分泌的方式,通过激活STAT1信号通路来增强T-BET基因的表达,进一步促进Th1细胞的极化。Th1细胞能够分泌IL-2、IFN-γ和TNF-α等细胞因子,这些因子能够增强巨噬细胞的吞噬能力,促进Tc细胞的增殖、分化和成熟,同时抑制Th2细胞的分化,从而在细胞免疫应答中发挥核心作用。在抗肿瘤、抗感染等生理过程中,Th1细胞扮演着重要角色。然而,在免疫功能紊乱的情况下,Th1细胞也可能参与自身免疫性疾病的发生和发展,如类风湿关节炎(RA)、Ⅰ型糖尿病以及多发性硬化症(MS)等。
②Th2细胞:其分化主要由IL-4这一细胞因子所诱导。当IL-4与相应的受体结合后,会触发STAT6的磷酸化和激活,进而诱导GATA-3基因的表达。随后,GATA-3作为一个关键的转录因子,会转录激活多种Th2细胞特异性的细胞因子,如IL-4、IL-5和IL-13等。这些细胞因子在促进B细胞的增殖、分化和成熟方面发挥着重要作用,同时也能够抑制Th1细胞的分化,从而介导机体的体液免疫应答并诱导免疫耐受。
与Th1细胞的功能有所不同,Th2细胞具有诱导免疫耐受的能力,这在一定程度上有助于减轻自身免疫性疾病的病情。然而,由于Th2细胞会抑制Th1细胞的功能,当Th2细胞功能过强时,会导致机体的细胞免疫能力下降。这种免疫失衡可能会促进肿瘤的发生,并且肿瘤的恶性程度与Th2细胞抑制Th1细胞的程度呈现出正相关关系。
③Th9细胞:它们的起源是初始CD4+T细胞,在TGF-β与IL-4的协同刺激下,通过激活IRF4、STAT6和PU.1等转录因子,进而分化为Th9细胞。Th9细胞的主要功能是分泌IL-9和IL-10细胞因子,这些因子在增强过敏反应和对抗寄生虫感染方面发挥着关键作用。值得注意的是,Th9细胞与过敏性疾病及自身免疫性疾病之间存在着密切联系。在哮喘患者、皮炎患者以及系统性红斑狼疮患者的体内,均观察到了Th9细胞的高表达现象。此外,Th9细胞在肿瘤的发生过程中也扮演着一定角色,它们能够通过分泌IL-9和IL-21来激活NK细胞和肥大细胞,并促进Th17细胞的分化,从而诱导肿瘤细胞凋亡。然而,IL-9也展现出对肿瘤细胞的双重作用,一方面能抑制其凋亡并促进其增殖,另一方面则降低肿瘤细胞对化疗药物的敏感性。
④Th17细胞:在细胞因子TGF-β与IL-6的共同作用下,IL-6首先激活STAT3信号通路,而TGF-β则诱导RORγt转录因子的产生,这两者的协同作用促使初始CD4+T细胞向Th17细胞方向分化。Th17细胞的主要功能是分泌IL-17A、IL-17F、IL-21和IL-22等细胞因子,这些因子在激活嗜中性粒细胞和增强固有免疫效应方面发挥着重要作用。Th17细胞与多种自身免疫性疾病密切相关,包括类风湿性关节炎、多发性硬化症、系统性红斑狼疮和银屑病等,这些患者的体内均可检测到高水平的IL-17A表达。由于IL-17是一种具有强大招募中性粒细胞能力的前炎性细胞因子,能够促进多种细胞释放炎性因子,因此它不仅能够引起气道的高反应性,还在哮喘的气道重塑过程中发挥着关键作用。
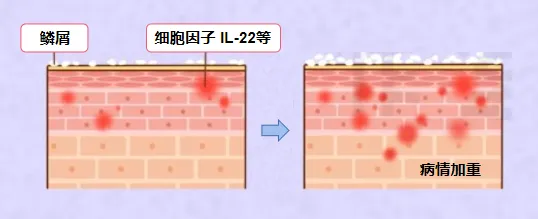
⑤Th22细胞:它们的分化过程是由IL-6和TNF-α这两种细胞因子共同诱导初始CD4+T细胞而完成的。Th22细胞具有分泌IL-22、IL-13和TNF-α等细胞因子的能力,这些细胞因子在介导角质细胞增殖和上皮细胞再生方面发挥着关键作用,对皮肤表皮的重塑过程具有重要意义。Th22细胞在多种炎症性疾病的发病机制中扮演着重要角色,与银屑病、过敏性哮喘、类风湿性关节炎以及多发性硬化症等疾病的发生和发展密切相关。它们的功能主要通过IL-22来实现,研究发现在银屑病患者的血清中,IL-22的水平显著高于正常人,并且IL-22的水平含量与疾病的严重程度呈现出正相关关系。
⑥滤泡辅助T细胞(Tfh):Tfh细胞的分化过程依赖于IL-21和IL-6这两种细胞因子的介导,它们通过激活STAT3信号通路,对初始CD4+T细胞产生作用,进而诱导其分化为Tfh细胞。此外,BCL-6作为Tfh细胞分化所必需的特异性转录因子,也在此过程中发挥着关键作用。Tfh细胞的主要功能是辅助B细胞分化为浆细胞,促进抗体的产生以及免疫球蛋白(Ig)抗体的类别转换。此外,Tfh细胞还参与次级淋巴滤泡的生成,对维持机体的体液免疫应答具有重要意义。然而,当Tfh细胞功能出现缺陷或亢进时,都会导致机体免疫状态的紊乱。特别是当Tfh细胞过表达时,会对B细胞产生过强的辅助信号,导致大量针对自身抗原的抗体的分泌,从而引发自身免疫性疾病。
⑦外周诱导调节性T细胞(iTreg):iTreg细胞是由外周的Th0细胞在TGF-β的诱导下分化而来的。在这个过程中,特异性转录因子FOXP3发挥着至关重要的作用。iTreg细胞主要分泌TGF-β和IL-10等细胞因子,这些因子在抑制效应性T细胞的增殖和细胞因子分泌方面发挥着关键作用。此外,研究发现iTreg细胞还参与肿瘤的免疫逃逸过程,通过抑制免疫应答来促进肿瘤的发生和发展。
总结
Th细胞群在激活后主要通过分泌各种细胞因子来发挥其免疫功能,这些细胞因子能够调整不同细胞的免疫状态。由于产生的细胞因子的种类不同,Th细胞最终发挥的效应也有所不同。在机体处于健康状态时,Th细胞通过分泌不同种类的细胞因子来维持机体的免疫平衡。然而,当这些细胞因子的含量过高、过低或比例出现失衡时,就会导致免疫紊乱,进而引发疾病的发生和发展。我们体内的“免疫大军”在Th细胞这位“军师”的精密指挥下,能够有效地进行免疫应答,为我们的健康提供坚实的保障。
| 名称 | 货号 | 规格 |
| TH1L ANTIBODY | PA544841 | 100microliter |
| ANTI-TH1L | PA519407 | EA |
| Mouse anti-TH1L Monoclonal Antibody(JMMR-2126) | abs154657-100ul | 100ul |
| Goat Polyclonal TH1L Antibody | NBP1-52112 | 0.1mg |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)