ERK通路
一、研究背景
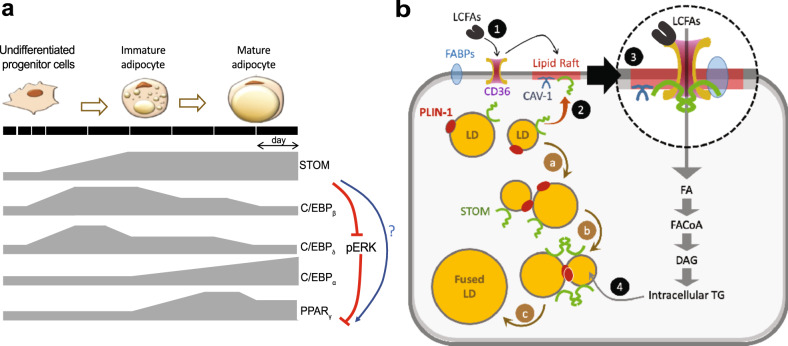
气孔蛋白(stomatin)是一种高度保守的蛋白质,作为脂筏的重要标志蛋白,通过发夹样跨膜结构域插入胞质,广泛分布于质膜、内吞体及脂滴(lipid droplet,LD)膜上。研究表明,气孔蛋白在人和小鼠的多种组织细胞中广泛表达,参与脂筏结构的装配、囊泡运输、物质的跨膜转运,以及对离子通道和细胞骨架的调节等生理过程。然而,气孔蛋白在调控脂质生成方面的功能尚不清楚。
二、重要发现及亮点
(一)脂肪生成过程中气孔蛋白表达增加,促进脂滴融合
通过组学分析,研究发现气孔蛋白在人的脂肪组织中高表达,提示其可能参与脂肪生成过程。利用小鼠3T3-L1前脂肪细胞分化体系,进一步发现气孔蛋白与主要的脂肪生成基因(PPARγ,C/EBPα和Perilipin)一样,表达逐渐增加。在3T3-L1细胞中过表达人气孔蛋白基因(hSTOM)对脂质积累程度无明显影响,但能促进LD-LD融合,引起LD增大。
(二)气孔蛋白与CD36相互作用从而促进脂肪酸摄取
通过蛋白质组学检测、免疫沉淀及邻位连接法(PLA),研究发现气孔蛋白与CD36(脂肪酸转位酶)和caveolin-1存在相互作用。脂肪酸摄取实验证明,过表达气孔蛋白可使细胞更多、更快地摄取脂肪酸,说明CD36与气孔蛋白诱导的脂质积累相关。综上,气孔蛋白通过招募效应分子(如CD36转位酶)到脂筏,促进细胞从胞外摄取脂肪酸,导致脂质增加。
(三)HFD喂养的STOM Tg小鼠出现代谢损伤表型
研究者在小鼠中过表达hSTOM基因,获得了STOM转基因小鼠(STOM Tg)。与细胞表型一致,HFD喂养下STOM Tg小鼠体重增加与脂肪酸摄取均更多,且出现脂肪细胞肥大、总胆固醇含量增加、肝肿大等代谢损伤表型。相反,采用shRNA方法敲低气孔蛋白基因,可降低脂生成相关基因表达,抑制脂质积累。
(四)STOM通过ERK通路调节脂肪形成
为了探究气孔蛋白调控脂质积累的分子机理,研究者对野生型和shSTOM-1细胞进行了转录组分析,结果显示敲低气孔蛋白显著抑制脂肪生成和PPARγ信号通路,但激活ERK(胞外信号调节激酶)通路。进一步研究证明,ERK通路的激活可以抑制PPARγ,从而阻止脂肪细胞分化和脂肪形成,这与已有报道相符。综上,气孔蛋白通过激活ERK通路调控脂肪生成。
三、对领域贡献
本研究揭示了气孔蛋白参与调节脂肪细胞分化、脂质储存、脂质分解和脂质分泌等脂质稳态的各个方面。报道了气孔蛋白调节脂肪酸摄取和LD生长的新功能,为通过调控气孔蛋白治疗肥胖提供了新的思路。
四、存在问题及分析
研究发现ERK抑制剂并不能逆转shSTOM-1细胞的脂质积累缺陷表型,而PPARγ激动剂能够部分修复脂质积累缺陷,这表明存在一种独立于ERK的机制正调控PPARγ并激活脂肪生成。此外,文章还报道了气孔蛋白敲除可显著降低脂肪样细胞中的胆固醇含量,这表明气孔蛋白似乎与胆固醇代谢有关,但具体的调控机制尚不清楚。以上这些问题仍需进一步探究。
| 名称 | 货号 | 规格 |
| Erk5 Antibody | 3372S | 100ul |
| Phospho-Erk5 (Thr218/Tyr220) Antibody | 3371S | 100ul |
| Erk3 Antibody | 4067S | 100ul |
| Rabbit anti-ERK1/2 Polyclonal Antibody | abs130092-50ug | 50ug |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)