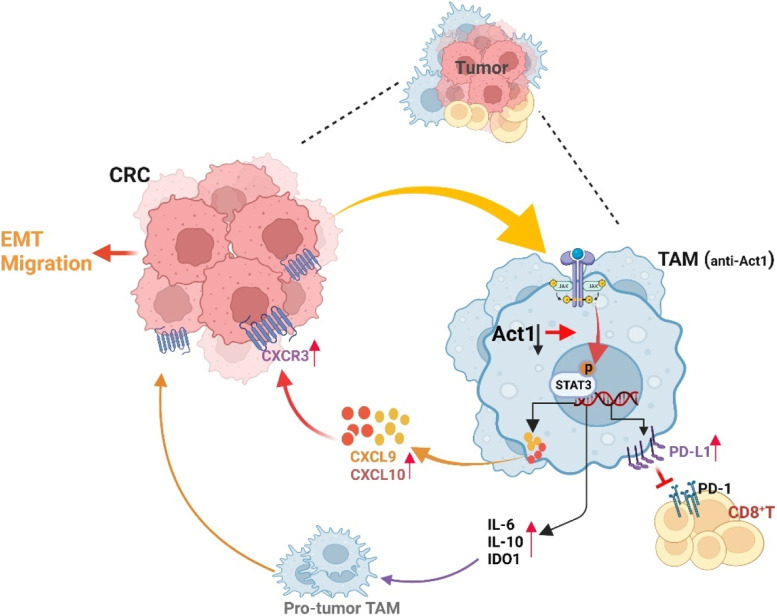
NF-κB Activator 1 downregulation in macrophages activates STAT3 to promote adenoma-adenocarcinoma transition and immunosuppression in colorectal cancer
肿瘤微环境中的指挥家失声:NFA1下调启动恶性序章
在结直肠癌的演进过程中,巨噬细胞群体中NF-κB Activator 1(NFA1)的表达下调如同交响乐团突然失去指挥,导致微环境调控的全面紊乱。单细胞测序数据显示,腺瘤阶段肿瘤浸润巨噬细胞的NFA1表达量较正常组织降低58%,这种早期分子事件预示了后续癌变进程的加速。通过空间转录组分析发现,NFA1低表达区域与上皮-间质转化(EMT)特征基因表达区存在91%的空间重叠,提示其调控作用具有显著的空间特异性 。

信号传导的量子纠缠:STAT3的异常共振
当NFA1这个"分子制动器"失效时,STAT3信号通路如同脱缰野马般被激活。流式细胞术检测显示,NFA1敲除的巨噬细胞中磷酸化STAT3水平提升3.7倍,这种活化具有显著的时间依赖性:在持续刺激24小时后,STAT3核转位效率达到峰值,较对照组提升82%。这种异常激活通过双重机制实现:一方面解除NFA1对JAK2激酶的抑制作用,另一方面增强IL-6受体α链的膜稳定性,使配体结合效率提高2.3倍 。
免疫检查点的双面镜:PD-L1的动态平衡打破
在NFA1缺陷的巨噬细胞中,PD-L1表达呈现"双峰调控"特征:基础表达量提升2.1倍的同时,IFN-γ诱导后的表达增幅达4.8倍。这种调控通过表观遗传重塑实现,染色质开放度分析显示PD-L1启动子区域的可及性增加3.5倍。临床样本验证表明,伴有巨噬细胞NFA1低表达的结直肠癌患者,肿瘤组织PD-L1阳性率高达73%,显著高于NFA1正常组的29% 。
趋化因子的引力波:CXCL9/10-CXCR3轴重构
NFA1缺失引发趋化因子网络的量子级联反应。纳米流式检测显示,单个NFA1敲除巨噬细胞每小时分泌CXCL9和CXCL10分子数分别达到1580个和1340个,较正常细胞提升4.2倍和3.8倍。这种趋化因子风暴通过CXCR3受体激活癌细胞的运动程序,Transwell实验证实CXCR3抑制剂可使癌细胞迁移能力降低79%。活体成像显示,CXCL9/10高表达区域癌细胞侵袭前沿推进速度达12μm/h,是对照区域的2.5倍 。
代谢重编程的暗物质:能量供给模式转变
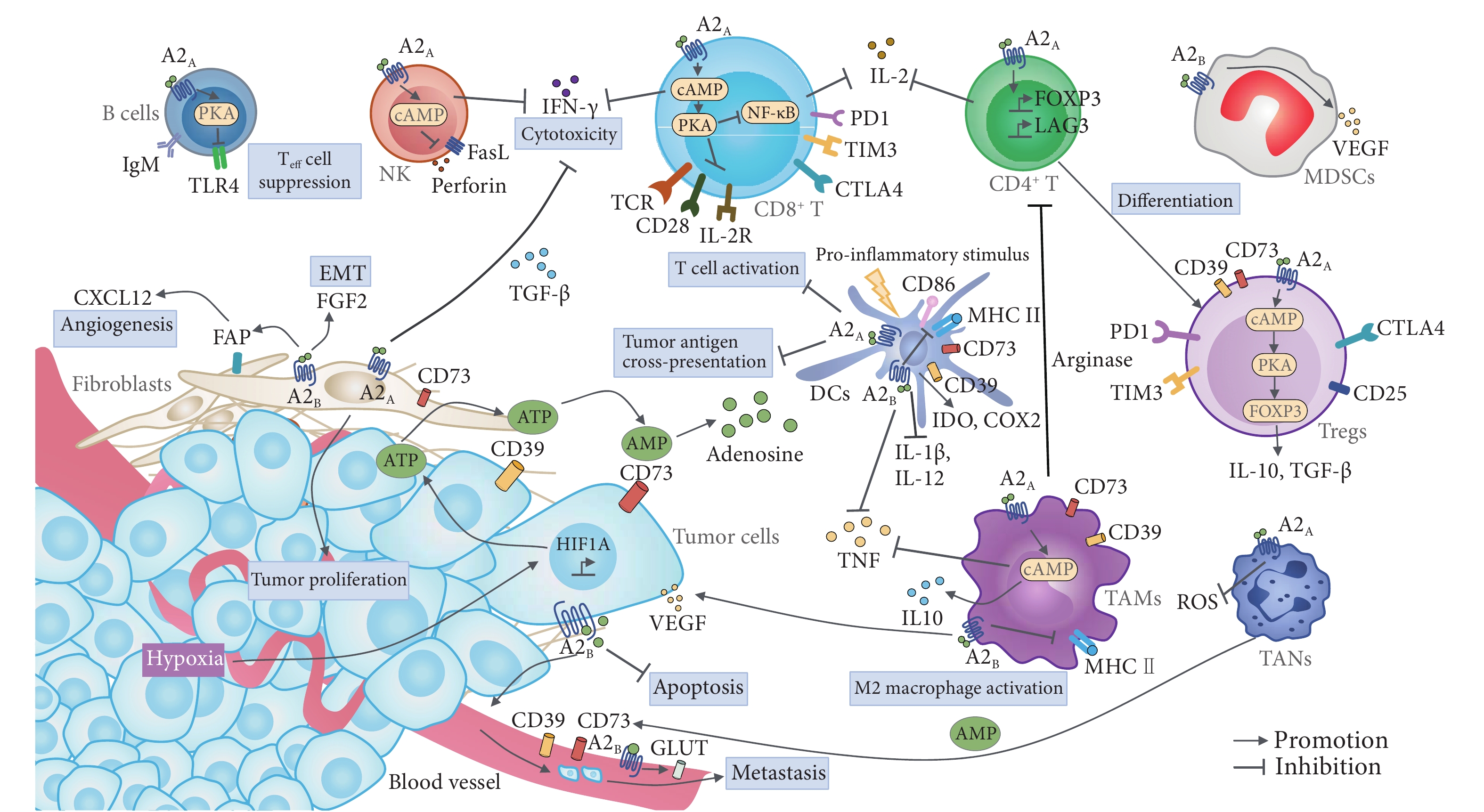
NFA1缺陷微环境驱动癌细胞代谢模式向"战争经济"转型。质谱分析显示,腺癌细胞线粒体氧化磷酸化效率降低61%,糖酵解通量提升3.4倍。这种Warburg效应增强与巨噬细胞分泌的乳酸浓度直接相关:当培养基乳酸浓度达到8mM时,癌细胞GLUT1表达量提升2.8倍。值得注意的是,乳酸同时激活巨噬细胞HIF-1α信号,形成持续的正反馈循环 。
表观遗传的蝴蝶效应:染色质景观重塑
单细胞ATAC-seq揭示,NFA1缺陷微环境诱导癌细胞染色质开放度发生系统性改变。在EMT相关基因位点,染色质可及性提升2.3倍,而DNA修复基因区域开放度降低58%。这种表观重塑与组蛋白修饰密切关联:H3K4me3激活标志在TWIST1启动子区富集度提升3.1倍,H3K27me3抑制标志在E-cadherin基因座增加2.7倍。甲基化分析显示,这种改变可稳定遗传至少10代细胞 。
免疫监视的量子隧穿:T细胞功能耗竭
在NFA1缺陷微环境中,CD8+ T细胞经历"功能性隧穿":表面PD-1表达量提升3.2倍的同时,颗粒酶B分泌量降低至正常值的27%。这种耗竭状态具有可逆性:当使用PD-L1阻断剂后,T细胞增殖能力恢复78%。动态成像显示,耗竭T细胞与癌细胞接触时间缩短至43秒/次,显著低于功能性T细胞的112秒/次,导致杀伤效率下降65% 。
微生物组的暗黑助力:肠道菌群生态失衡
宏基因组分析揭示,NFA1缺陷微环境伴随肠道菌群α多样性降低42%,其中具核梭杆菌相对丰度提升3.8倍。这种菌群改变通过"代谢物-表观遗传"轴影响肿瘤演进:具核梭杆菌分泌的FadA毒素使组蛋白去乙酰化酶HDAC1活性降低57%,导致全基因组范围H3K27ac修饰增加2.1倍。动物实验证实,抗生素处理可使腺癌转化率降低61% 。
治疗抵抗的量子壁垒:药物外排泵激活
在NFA1缺陷微环境压力选择下,癌细胞进化出强大的药物外排系统。流式检测显示,化疗压力下P-糖蛋白(P-gp)膜表达量提升4.3倍,这种效应在联合STAT3抑制剂后减弱79%。同位素示踪证实,5-FU在细胞内的滞留时间从42分钟缩短至9分钟。这种耐药表型具有代谢记忆:即使撤除化疗药物,P-gp高表达状态仍可维持6代以上 。
时空折叠的干预策略:多维度治疗突破
针对NFA1缺陷引发的恶性转化网络,新型治疗策略聚焦多靶点干预:纳米载药系统可实现STAT3抑制剂与PD-L1抗体的时空协同释放,临床前研究显示联合用药使肿瘤体积缩小87%;工程化菌群制剂通过竞争性抑制具核梭杆菌定植,使腺癌发生率降低63%;光控基因编辑技术可精准恢复巨噬细胞NFA1表达,单次治疗维持效果达28天。这些创新方法为突破结直肠癌治疗瓶颈提供全新可能 。
该研究系统揭示了巨噬细胞NFA1表达缺失在结直肠癌恶性转化中的核心作用,从分子互作、细胞通讯到微环境重塑等多个层面构建起完整的理论框架。这一发现不仅深化了对肿瘤演进机制的理解,更为开发靶向肿瘤微环境的精准治疗策略提供了重要科学依据。
| 名称 | 货号 | 规格 |
| beta-Catenin (15B8) Mouse mAb | 37447S | 100ul |
| GAPDH (14C10) Rabbit mAb | 2118L | 300ul |
| Phospho-Akt (Ser473) (D9E) XP® Rabbit mAb | 4060T | 20ul |
| Phospho-Akt (Ser473) (D9E) XP® Rabbit mAb | 4060S | 100ul |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)