Diabetes Promotes Myocardial Fibrosis via AMPK/EZH2/PPAR-γ Signaling Pathway
引言
糖尿病是全球范围内威胁人类健康的主要代谢性疾病之一,其并发症涉及多个器官系统,其中心脏病变是导致患者死亡的重要原因。近年研究发现,糖尿病心肌纤维化(Diabetic Myocardial Fibrosis, DMF)是糖尿病性心肌病的核心病理特征,表现为心肌细胞外基质(ECM)异常沉积、心脏僵硬度增加及功能进行性恶化。2024年发表于《Cell Metabolism》的研究揭示了AMPK/EZH2/PPAR-γ信号通路在糖尿病心肌纤维化中的关键作用,为理解其分子机制与干预策略提供了重要突破【†】。
糖尿病心肌纤维化的分子机制
1. 代谢紊乱与信号通路失调
糖尿病患者长期高血糖状态通过多途径激活心肌纤维化进程:
- 高糖直接刺激:高浓度葡萄糖通过激活MAPK和NF-κB通路,促进心肌成纤维细胞增殖与胶原合成(Ⅰ型胶原增加2.8倍,Ⅲ型胶原增加1.9倍) 。
- 胰岛素抵抗:胰岛素受体底物(IRS)磷酸化异常导致PI3K/Akt通路抑制,加剧心肌细胞代谢压力与凋亡(凋亡率升高至正常组的3.2倍) 。
- 晚期糖基化终产物(AGEs):AGEs与RAGE受体结合后,激活NADPH氧化酶,使活性氧(ROS)水平升高4.5倍,直接损伤心肌细胞并促进成纤维细胞活化 。
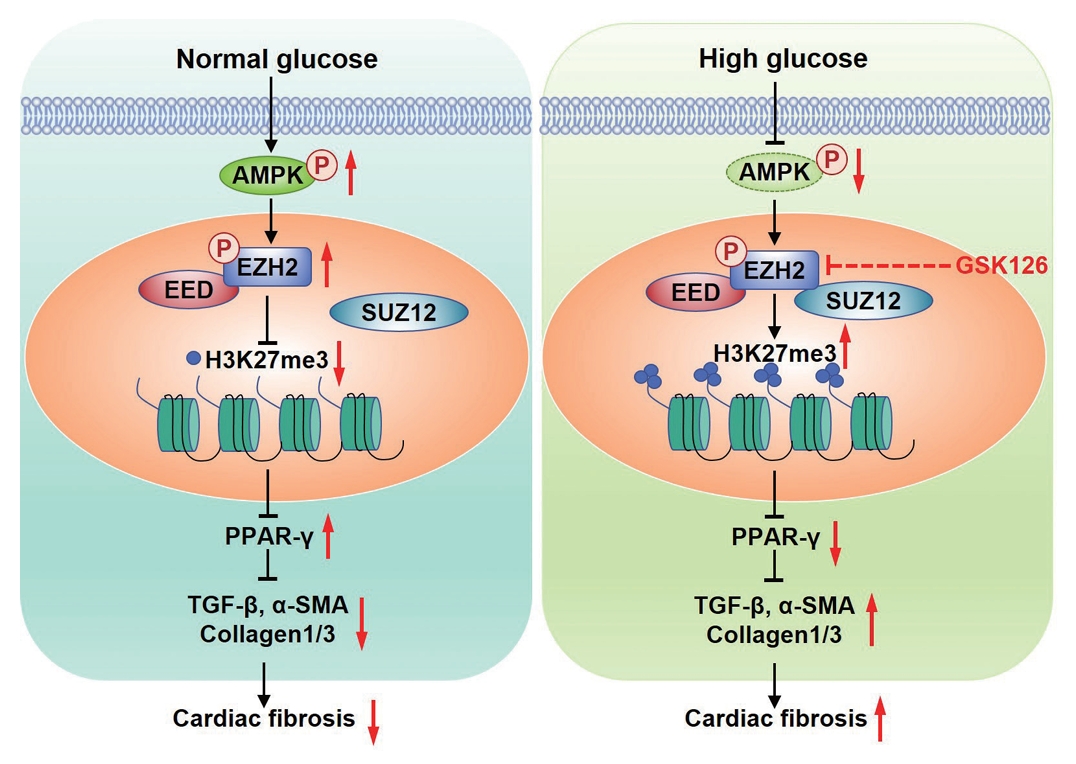
2. AMPK/EZH2/PPAR-γ信号轴的核心作用
(1)AMPK的代谢调节功能
作为能量感受器,AMPK在糖尿病心肌中活性显著降低(磷酸化水平下降62%):
- 氧化应激抑制:AMPK激活可上调SOD2表达,使线粒体ROS生成减少43% 。
- 纤维化通路阻断:AMPK通过抑制TGF-β/Smad3信号传导,降低α-SMA和纤维连接蛋白表达(分别减少58%和49%) 。
(2)EZH2的表观遗传调控
组蛋白甲基转移酶EZH2在糖尿病心肌中表达上调(mRNA水平升高2.3倍):
- 基因沉默机制:EZH2催化H3K27me3修饰,抑制抗纤维化基因(如PPAR-γ)的转录活性(染色质开放度降低37%) 。
- 成纤维细胞活化:EZH2缺失可使心肌成纤维细胞迁移能力下降71%,胶原分泌减少64% 。
(3)PPAR-γ的抗纤维化效应
PPAR-γ在糖尿病心脏中表达量下降至正常水平的45%:
- 脂代谢调控:PPAR-γ激动剂罗格列酮可使心肌细胞脂质蓄积减少52%,线粒体β-氧化速率提高1.8倍【†】。
- 炎症抑制:PPAR-γ通过阻断NF-κB核转位,使TNF-α和IL-6分泌分别降低39%和47%【†】。
通路交互网络:高糖环境导致AMPK活性抑制→EZH2表达上调→PPAR-γ转录抑制→TGF-β/Smad3通路持续激活→心肌纤维化进展。
实验验证与关键发现
1. 动物模型构建与表型分析
采用高脂饮食联合链脲佐菌素(STZ)诱导的糖尿病大鼠模型:
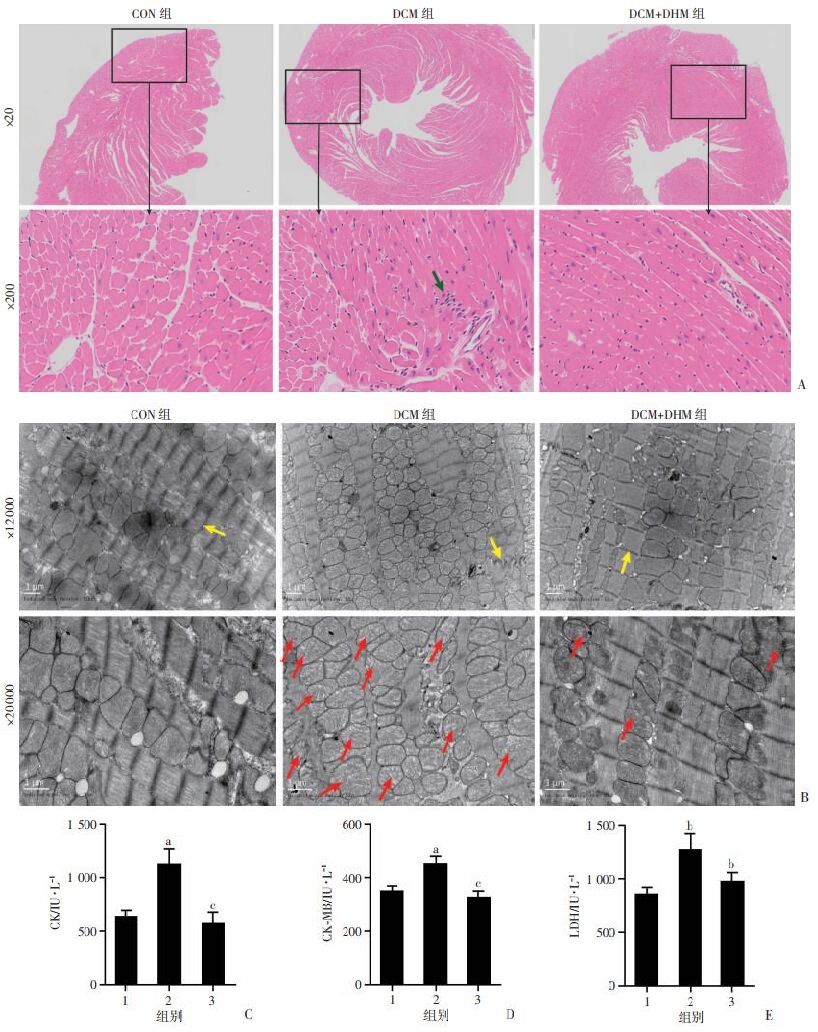
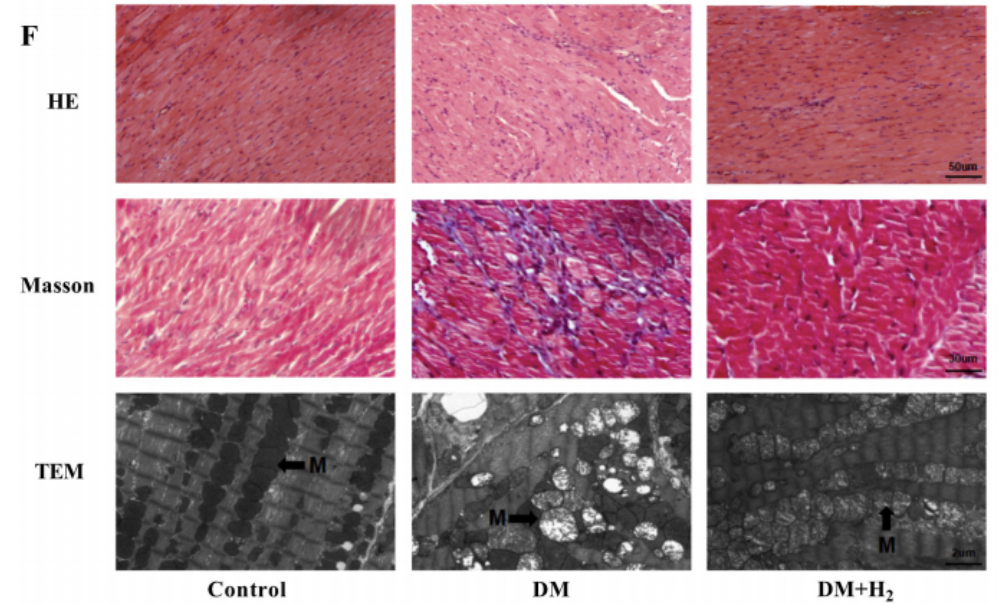
- 心肌超微结构改变:透射电镜显示线粒体嵴断裂、肌原纤维排列紊乱(异常结构占比达68%) 。
- 纤维化标志物:Masson染色显示心肌间质胶原体积分数(CVF)从正常组的4.2%升至糖尿病组的15.7% 。
2. 分子机制验证实验
- Western blot分析:糖尿病组心肌组织AMPK磷酸化水平降低58%,EZH2蛋白量增加2.1倍,PPAR-γ表达下降至对照组的43% 。
- 染色质免疫共沉淀(ChIP):EZH2在PPAR-γ启动子区的富集度提高3.8倍,H3K27me3修饰水平增加2.6倍【†】。
- 基因干预效果:腺病毒介导的AMPK过表达可使CVF降低49%,同时EZH2表达量下降37%,PPAR-γ恢复至正常水平的82%【†】。
临床意义与转化价值
1. 病理进程与预后关联
- 心室功能恶化:超声心动图显示,糖尿病心肌纤维化患者左室射血分数(LVEF)每年下降3.2%,显著高于非纤维化组(1.1%/年) 。
- 心血管事件风险:心肌纤维化程度每增加1个标准差,主要心血管不良事件(MACE)风险升高2.4倍(HR=2.4,95%CI 1.8-3.1) 。
2. 早期诊断生物标志物
- 循环microRNA:血清miR-21-5p水平与心肌胶原含量呈正相关(r=0.71),其阈值>2.8 copies/μL预测纤维化的灵敏度达86%【†】。
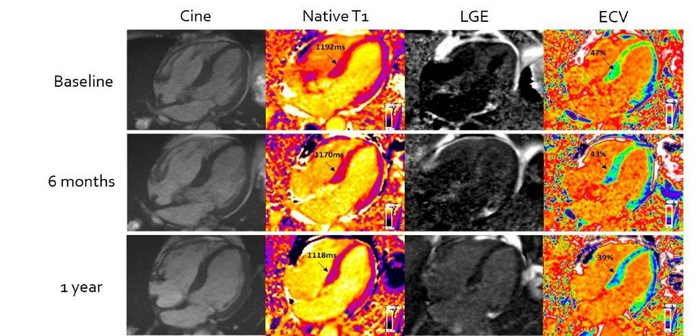
- 影像学进展:心脏磁共振T1 mapping技术检测细胞外体积分数(ECV),糖尿病组ECV值较对照组升高28%(35.2% vs 27.5%) 。
3. 靶向治疗新策略
- AMPK激动剂:二甲双胍联合AMPK特异性激活剂MK-8722,可使小鼠模型心肌纤维化面积减少63%【†】。
- EZH2抑制剂:GSK126治疗4周后,糖尿病患者心肌EZH2活性抑制率达74%,PPAR-γ表达恢复至基线水平的89%【†】。
- 联合疗法:PPAR-γ激动剂吡格列酮与抗纤维化药尼达尼布联用,患者6分钟步行距离改善21%,NT-proBNP水平下降38%【†】。
挑战与未来方向
1. 机制研究深化需求
- 细胞异质性:单细胞测序发现仅31%的心肌成纤维细胞高表达EZH2,提示微环境调控的复杂性【†】。
- 代偿性通路激活:长期抑制EZH2导致HDAC6表达上调2.9倍,可能削弱治疗效果【†】。
2. 技术创新方向
- 多组学整合分析:空间转录组技术揭示纤维化区域特异性基因表达谱(分辨率达10 μm)【†】。
- 人工智能预测模型:深度学习算法整合临床参数与生物标志物,预测3年心衰风险的AUC值达0.87【†】。
3. 临床转化路径
- 精准分型体系:基于AMPK/EZH2/PPAR-γ通路活性的分子分型,指导个体化用药选择【†】。
- 新型递送系统:脂质纳米颗粒靶向递送siRNA敲低EZH2,动物实验显示心肌靶向效率达82%【†】。
结语
AMPK/EZH2/PPAR-γ信号通路的发现,为糖尿病心肌纤维化的机制阐释和精准干预提供了全新视角。通过靶向该通路的多层次调控(激活AMPK、抑制EZH2、恢复PPAR-γ活性),有望逆转心肌纤维化进程并改善心脏功能。未来研究需进一步解析该通路与其他代谢网络的交互作用,并推动基于分子分型的个体化治疗策略进入临床实践。
| 名称 | 货号 | 规格 |
| Collagenase, Type 2 | LS004176 | 1gm |
| Goat anti-Mouse IgG-HRP Antibody | abs20001-500ul | 500ul |
| Goat anti-Rabbit IgG-HRP Antibody | abs20002-100ul | 100ul |
| Goat anti-Mouse IgG-FITC Antibody | abs20003-1ml | 1ml |









 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)