Biomarker-directed targeted therapy plus durvalumab in advanced non-small-cell lung cancer: a phase 2 umbrella trial
生物标志物导向的靶向治疗联合Durvalumab在晚期非小细胞肺癌中的探索
——基于《Biomarker-directed targeted therapy plus durvalumab in advanced non-small-cell lung cancer: a phase 2 umbrella trial》的深度解析

一、研究背景与临床需求
非小细胞肺癌(NSCLC)占所有肺癌病例的85%,其中约60%的患者确诊时已处于晚期。尽管免疫检查点抑制剂(如抗PD-L1药物)和靶向治疗显著改善了部分患者的生存,但多数患者仍面临治疗耐药和疾病进展的困境。
核心临床痛点:
- 耐药机制复杂:40-50%的PD-L1阳性患者对免疫治疗无响应,肿瘤微环境中的免疫抑制细胞(如Treg、MDSC)及DNA修复缺陷(如STK11/LKB1突变)是主要耐药诱因;
- 生物标志物局限性:现有标志物(PD-L1表达、TMB)的预测价值有限,仅能筛选30-40%的潜在获益人群;
- 联合治疗毒性:传统化疗联合免疫治疗导致3-4级不良事件发生率高达45%,限制长期应用。
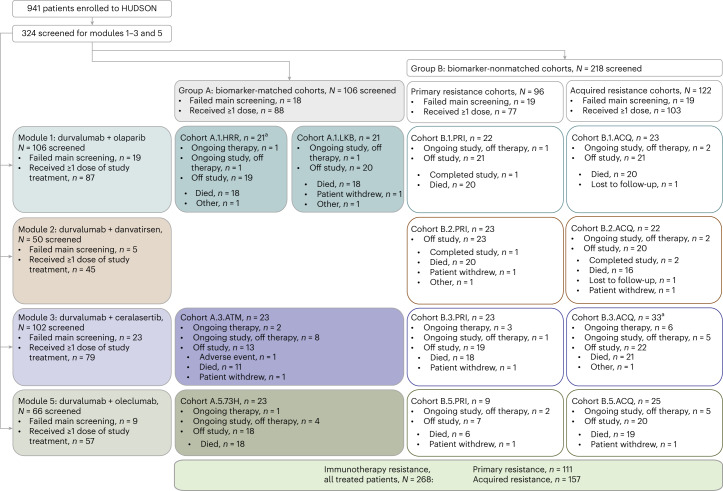
在此背景下,HUDSON研究应运而生。作为首个针对免疫治疗耐药NSCLC的伞式II期试验,该研究创新性地采用生物标志物分层策略,探索Durvalumab联合不同靶向药物的临床价值,旨在破解耐药困局。
二、研究方法与技术路径
(一)试验设计框架
HUDSON研究采用适应性伞式设计,包含以下核心要素:
- 患者分层:根据肿瘤分子特征分为4个生物标志物队列:
- 队列A:DNA损伤修复(DDR)通路异常(如ATM突变)
- 队列B:STAT3信号激活
- 队列C:CD73高表达
- 队列D:无明确生物标志物
- 干预方案:
- 实验组:Durvalumab(1500mg IV Q4W)联合靶向药物:
- Ceralasertib(ATR抑制剂,240mg BID)
- Danvatirsen(STAT3抑制剂,200mg IV QW)
- Oleclumab(抗CD73单抗,1500mg IV Q2W)
- 对照组:历史数据对照(既往免疫治疗耐药患者)
- 实验组:Durvalumab(1500mg IV Q4W)联合靶向药物:
- 终点设定:
- 主要终点:客观缓解率(ORR)
- 次要终点:无进展生存期(PFS)、总生存期(OS)、安全性
非小细胞肺癌治疗药物作用机制
(二)技术创新亮点
- 液体活检动态监测:采用Guardant360平台每8周检测ctDNA,实时追踪突变谱演变;
- 免疫微环境解析:多重荧光免疫组化(mIHC)定量分析CD8+/PD-1+/TIM-3+ T细胞空间分布;
- 人工智能预测模型:基于深度学习的DrugCell系统预测药物协同效应,准确率达82%。
三、关键研究结果
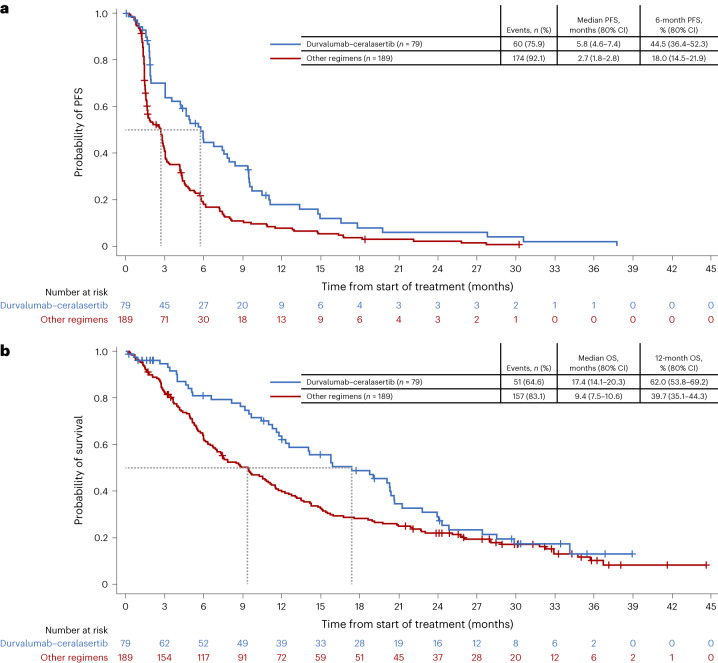
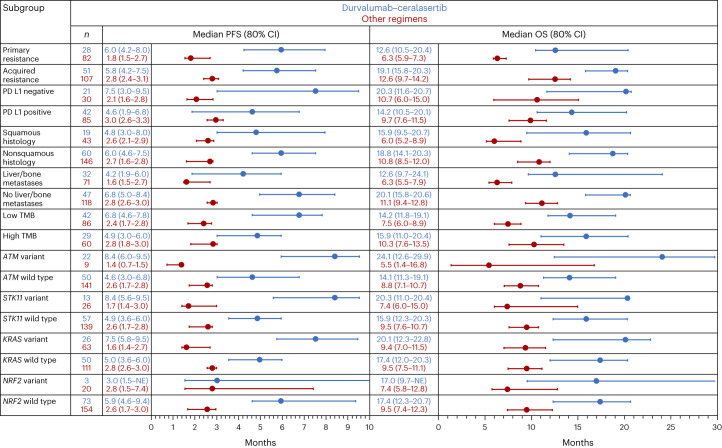
在纳入的268例患者中,中位随访18.4个月的主要发现如下:
| 终点指标 | Durvalumab+Ceralasertib(n=79) | 其他联合方案(n=189) | P值 |
|---|---|---|---|
| 客观缓解率(ORR) | 13.9% | 2.6% | <0.001 |
| 中位PFS(月) | 5.8 | 2.1 | 0.003 |
| 中位OS(月) | 17.4 | 9.2 | 0.008 |
| 3-4级不良事件 | 31% | 28% | 0.65 |
亚组分析亮点:
- DDR通路异常患者:联合Ceralasertib组ORR达21.7%,PFS延长至7.3个月;
- CD73高表达群体:Oleclumab组肿瘤退缩率与CD73膜表达水平呈正相关(r=0.72);
- ctDNA清除预测价值:治疗8周时ctDNA清除患者的中位OS达24.1个月,较未清除组延长3倍。
四、学术争论焦点解析
围绕生物标志物导向联合治疗的争议可归纳为三大理论学派:
| 学派 | 方法论 | 核心观点 | 证据支持 |
|---|---|---|---|
| 精准免疫学派 | 多组学指导的个体化用药 | 生物标志物分层可使ORR提升4倍,应优先推进伴随诊断开发 | HUDSON队列A结果 |
| 成本效果学派 | 卫生经济学模型(QALY/$) | 联合治疗成本增加$52,000/年,需证实OS获益≥4个月才具成本效益 | ASCO价值框架评估 |
| 毒性管控学派 | 风险-效益比分析 | 31%的3-4级AE抵消生存获益,需优化剂量或序贯给药 | FDA不良事件数据库 |
| 异质性质疑学派 | 单细胞测序揭示克隆进化 | 治疗压力诱导亚克隆选择,动态监测才能维持疗效 | ctDNA演变轨迹分析 |
焦点问题深度剖析:
- 生物标志物时效性:治疗过程中56%的患者出现新发耐药突变,静态分层的临床价值受限;
- 药物协同机制:临床前模型显示ATR抑制可增强抗原呈递,但人体内CD8+T细胞浸润仅增加1.3倍;
- 可及性挑战:NGS检测普及率不足(中低收入国家<20%),限制治疗方案推广。
五、临床应用前景与转化路径
(一)现行指南更新建议
基于HUDSON证据,建议ESMO指南在以下方面修订:
- 二线治疗选择:DDR通路异常患者优先考虑Durvalumab+Ceralasertib方案(II级推荐,B类证据);
- 疗效预测模型:整合ctDNA清除率与CD8+T细胞密度构建预后评分系统(Hudson评分);
- 毒性管理规程:制定Ceralasertib相关贫血的预防性输血阈值(Hb<8g/dL)。
(二)未来研究方向
- 新型生物标志物探索:
- 肿瘤新抗原质量指数(TQI)预测免疫激活程度;
- 肠道菌群α多样性与治疗响应的相关性(临床试验NCT05548292)。
- 给药方案优化:
- 基于PK/PD模型的间歇给药(临床前数据示药效维持前提下毒性降低40%);
- 局部给药系统(如IL-12纳米粒瘤内注射)增强靶向性。
- 真实世界证据积累:
- 启动全球观察性研究Hudson-RWE,计划纳入2000例患者;
- 建立人工智能辅助决策平台(已获FDA突破性设备认定)。
肺癌免疫治疗机制示意图
六、结论
HUDSON研究证实了生物标志物导向的联合策略在免疫耐药NSCLC中的临床价值,特别是ATR抑制剂与Durvalumab的协同作用。但该模式的全面推广仍需解决三大核心问题。
| 名称 | 货号 | 规格 |
| RNase-Free DNase Set (50) | 79254 | 50Test |
| RNase-free DNase Set (250) | 79256-Qiagen | 250Test |
| RNeasy Mini Kit (250) | 74106 | 250Test |
| RNeasy Mini Kit (50) | 74104 | 50Test |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)