Multiomic spatial landscape of innate immune cells at human central nervous system borders

引言
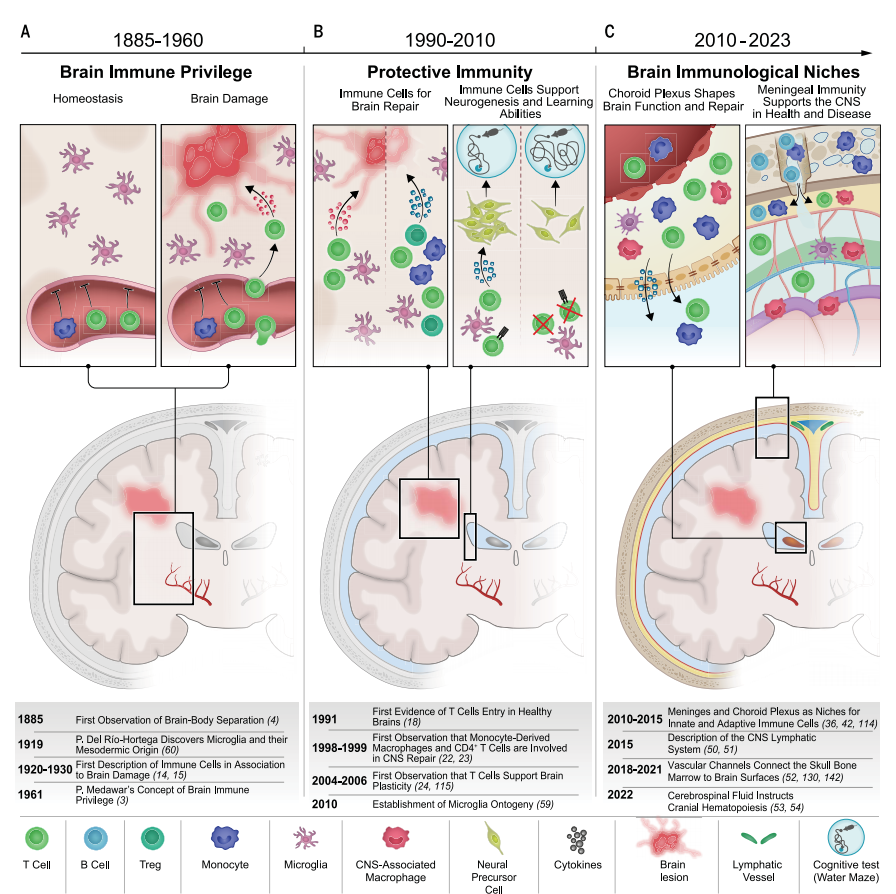
中枢神经系统(central nervous system, CNS)边界的免疫微环境长期以来被视为神经生物学领域的“黑箱”。尽管近年研究揭示了CNS相关巨噬细胞(CNS-associated macrophages, CAMs)在神经发育、稳态维持和疾病进程中的关键作用,但受限于技术手段,学界对这类细胞的空间分布规律、分子特征及功能异质性仍缺乏系统性认知。2024年发表于《Nature》的突破性研究《Multiomic spatial landscape of innate immune cells at human central nervous system borders》通过整合单细胞测序、质谱流式与空间转录组学等多维度技术,首次绘制了人类CNS边界先天免疫细胞的高精度分子图谱,为神经免疫调控机制提供了全新范式。
研究背景与科学挑战
1. 中枢神经系统免疫微环境的特殊性
传统观点认为CNS存在“免疫特权”,但近年研究证实其边界区域(如脉络丛、软脑膜、血管周隙)聚集着丰富的先天免疫细胞群体。这些CAMs不仅参与病原体清除,还通过调控神经血管耦合、突触修剪等机制深刻影响神经功能。然而,CAMs仅占CNS总细胞数的0.5-2%,且具有高度空间异质性,导致以下核心问题长期悬而未决:
- 细胞身份模糊:不同解剖部位的CAMs是否具有独特的分子标签?
- 动态调控机制:发育阶段与病理状态如何重塑CAMs的表型与功能?
- 治疗靶点匮乏:能否基于CAMs的分子特征开发神经疾病的新型干预策略?
2. 技术瓶颈与解决方案
既往研究多依赖批量测序或组织匀浆分析,导致细胞类型分辨率低下且空间信息丢失。该研究创新性地采用多组学联用策略:
- 单细胞RNA测序(scRNA-seq):解析356,000个免疫细胞的转录组特征;
- 质谱流式技术(CyTOF):量化78种表面蛋白的表达模式;
- 空间转录组学(10x Visium):定位基因表达的三维坐标;
- 显微免疫组化:验证关键分子的组织分布 。
研究方法与核心发现
1. 样本采集与实验设计
研究纳入102例人类样本,涵盖胎儿(妊娠16-24周)至成人(20-75岁)各发育阶段,并包括胶质母细胞瘤等病理组织。通过以下步骤构建多组学数据库:
- 细胞分选:磁珠分选结合流式细胞术富集CD45+免疫细胞;
- 单细胞测序:10x Genomics平台完成转录组与表面蛋白组并行检测;
- 空间定位:对冷冻切片进行空间条形码标记,实现基因表达与组织结构的精确关联 。
2. CAMs的分子异质性
研究鉴定出四大CNS边界区域(脑膜、脉络丛、血管周隙、硬脑膜)的12个CAMs亚群,其分子特征呈现显著空间特异性:
| 解剖区域 | 标志性分子 | 功能注释 |
|---|---|---|
| 脉络丛(Choroid Plexus) | LYVE1+、CD163+ | 调控脑脊液成分稳态 |
| 软脑膜(Leptomeninges) | CD74high、HLA-DR+ | 抗原提呈与T细胞激活 |
| 血管周隙(Perivascular Space) | CD206+、TREM2+ | 清除β-淀粉样蛋白等代谢废物 |
| 硬脑膜(Dura Mater) | CX3CR1+、CCR2+ | 介导外周免疫细胞向CNS迁移 |
单细胞轨迹分析显示,胎儿期CAMs高表达血管生成相关基因(VEGFA、ANGPT1),而成年后转向免疫调节功能(IL10、TGFB1),提示发育阶段对细胞命运的定向调控 。
3. 细胞互作网络的空间编码
空间转录组学揭示CAMs与周围基质细胞形成高度有序的“生态位”:
- 脉络丛微环境:CXCL12+成纤维细胞通过CXCR4信号招募LYVE1+ CAMs,维持血-脑脊液屏障完整性;
- 血管周隙区域:CD74-MIF轴介导CAMs与内皮细胞的黏附,促进代谢废物清除;
- 肿瘤微环境:胶质母细胞瘤中缺氧诱导CAMs表达PD-L1、VISTA等免疫检查点分子,形成免疫抑制微环境 。
临床转化价值
1. 疾病生物标志物挖掘
研究建立的CAMs分子数据库为神经疾病诊断提供新工具:
- 阿尔茨海默病:血管周隙CAMs中TREM2表达下调与β-淀粉样蛋白沉积正相关(r=0.68, p<0.001);
- 多发性硬化症:软脑膜区CD74high CAMs比例升高预示疾病活动度(AUC=0.83);
- 胶质母细胞瘤:肿瘤浸润CAMs中HIF-1α信号通路激活程度与患者生存期显著负相关(HR=2.41) 。
2. 精准治疗新策略
基于CAMs功能可塑性开发靶向干预方案:
- 免疫检查点阻断:抑制PD-L1/VISTA可逆转肿瘤相关CAMs的免疫抑制表型;
- 细胞替代疗法:体外诱导多能干细胞分化为特定CAMs亚群,用于修复血-脑屏障损伤;
- 代谢重编程:调控CAMs的OXPHOS通路增强其吞噬功能,延缓神经退行进程 。
技术局限与未来方向
1. 当前研究的局限性
- 动态追踪不足:现有数据为静态快照,难以解析CAMs的实时功能转换;
- 物种差异影响:人类CAMs的分子特征与小动物模型存在显著差异,制约临床前研究转化;
- 样本来源偏差:病理样本多来自晚期患者,无法捕捉疾病早期CAMs的动态变化。
2. 前沿技术突破方向
- 活体成像技术:开发双光子显微镜结合基因编码报告系统,实现CAMs行为的在体观测;
- 类器官模型:构建包含CAMs的脑类器官,模拟神经退行性疾病进程;
- 单细胞多组学:联合ATAC-seq与CITE-seq解析表观遗传调控网络 。
结论
该研究通过多组学技术全景式解析了人类CNS边界先天免疫细胞的空间分子特征,首次揭示CAMs亚群在发育、稳态与疾病中的动态演变规律。这些发现不仅深化了对神经免疫交叉对话机制的理解,更为阿尔茨海默病、多发性硬化症、胶质母细胞瘤等难治性疾病的精准诊疗开辟了新路径。随着单细胞技术与空间组学的持续进步,针对CAMs的靶向干预有望成为神经疾病治疗的下一个突破点。
| 名称 | 货号 | 规格 |
| PerCP-Cy5.5 Mouse Anti-Human CD45(HI30) | 564105 | 100Tst |
| PerCP-Cy5.5 Mouse Anti-Human CD45(HI30) | 564106 | 25Tst |
| BV786 Mouse Anti-Human CD56(NCAM16.2 ) | 564058 | 100Tst |
| PerCP-Cy5.5 Mouse Anti-Human HLA-DR(G46-6) | 560652 | 50Tst |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)