免疫组化(Immunohistochemistry, IHC)
免疫组化(Immunohistochemistry, IHC)是定位组织或细胞中特定蛋白质的核心技术,广泛应用于病理诊断、肿瘤研究和药物开发领域。其技术流程涵盖样本制备、抗原修复、信号放大与可视化等关键环节。
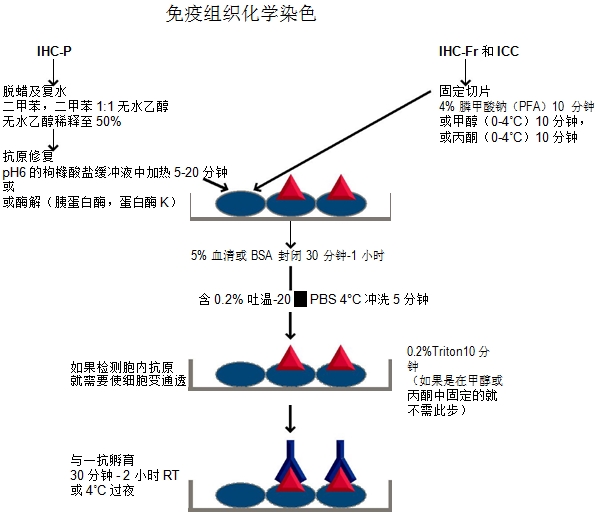
免疫组化实验流程示意图
一、样本固定
(一)目的
样本固定是整个 IHC 实验的基石,其核心目的在于确保组织样本的质量与完整性,只有经过妥善固定的样本,才能为后续的免疫染色环节打下坚实基础,保障实验结果的可靠性。
(二)操作步骤
-
取材 :从动物或人体中获取所需的组织样本,在此过程中,需严格把控组织块的大小,务必保证其大小适中,不宜过大,以便固定液能够毫无阻碍地充分渗透,实现对组织样本的全面固定。
-
初步处理 :倘若组织样本表面附着有血液或其他体液,为避免这些物质对固定效果产生不良影响,应立即使用生理盐水或 PBS 对其进行冲洗,彻底清除杂质。
-
固定 :将经过初步处理的组织样本小心放入固定液中,常用的固定液包括 4% 多聚甲醛溶液,针对冰冻切片或神经组织,OCT 包埋剂也是不错的选择。在固定时,固定液的用量应为组织体积的 10 - 20 倍,以此确保组织能够完全浸入固定液之中,实现均匀固定。对于体积较大的组织标本,为防止中间部分出现自溶解腐败的情况,应提前将其切开后再进行固定。固定时间会因组织类型以及实验要求的不同而有所差异,一般情况下,在室温下固定 18 - 24 小时即可达到较为理想的固定效果。
-
固定后的处理 :固定完成后,将组织样本从固定液中取出,随即用流水冲洗数分钟,这一操作旨在去除残留的固定液以及可能产生的结晶,避免其对后续实验环节造成干扰。
(三)注意事项
-
固定时间的把控至关重要,过长的固定时间极有可能导致组织过度硬化,进而引发抗原性的丧失,影响后续抗体与抗原的结合效率。
-
固定的温度通常选择室温或 4°C,应严格避免高温环境,因为高温极易对组织造成不可逆的损伤,破坏组织结构与抗原特性。
-
在固定过程中,务必要确保组织样本始终完全浸入固定液中,一旦出现未固定的部分,将严重影响实验结果的准确性,可能导致该部分组织无法正常进行免疫染色或染色异常。
-
用于固定的容器必须保持干净、无杂质,任何外来的污染物都可能对组织样本造成污染,进而影响整个实验的进程与结果。
二、包埋
(一)目的
包埋环节的主要目的是对组织样本进行有效的保护与支撑,使其在切片操作过程中能够维持完整的形态结构。通过将组织样本精准嵌入到合适的固体介质中,能够制作出厚度适宜、便于在显微镜下观察的薄切片,为后续的免疫组化染色创造良好条件。
(二)基本步骤
根据样本类型的不同,IHC 可分为石蜡切片免疫组化(IHC-P)和冰冻切片免疫组化(IHC-F)。其中,石蜡切片免疫组化尽管操作流程相对复杂,但由于其在保持组织形态结构、切片厚度控制(便于染色与观察)以及常温保存等方面具有显著优势,能够长时间保存样本且保证其可用性,因此在实际实验中更为常用。
-
脱水 :在组织样本完成固定后,首要任务是去除其中的水分,为包埋介质的顺利渗透创造条件。通常采用酒精梯度脱水的方法,具体步骤为:将组织样本依次置于 75% 乙醇中浸泡 1 小时、85% 乙醇中浸泡 1 小时、95% 乙醇中浸泡 1 小时、100% 乙醇中分别浸泡 50 分钟(共三次),逐步提高乙醇浓度,使组织内的水分被充分置换出来。
-
透明 :经过脱水处理后,组织样本往往会呈现不透明的状态,此时需要借助透明剂(例如二甲苯)来去除其中残留的酒精以及其他溶剂,从而使组织样本恢复透明,便于后续石蜡的渗透。具体操作为:将组织样本分别置于二甲苯中浸泡三次,每次时长为 40 分钟。
-
浸蜡 :将完成透明处理的组织样本放入熔化的石蜡中,确保石蜡能够充分渗透到组织样本的各个部位。这一过程通常需要在温箱中进行,以维持石蜡的液态状态,保证其均匀渗透,一般在 63℃的条件下,将组织样本分别置于石蜡中浸泡三次,每次时长为 50 分钟。
-
包埋 :将浸蜡后的组织样本迅速放入特制的模具中,随后倒入适量的熔化石蜡,待石蜡冷却凝固后,组织样本就被稳固地包埋在石蜡之中,形成了便于切片的蜡块。
(三)注意事项
-
在包埋过程中,温度与时间的精准控制尤为关键,只有这样才能确保石蜡均匀渗透到组织样本中,同时避免因温度过高或时间过长而对组织造成损伤,破坏其结构完整性。
-
包埋后的组织块需待石蜡完全冷却凝固后才能进行切片操作,在冷却过程中,应尽量避免过度冷却,因为过度冷却可能会导致石蜡碎裂或者组织发生变形,影响切片质量。
-
在进行包埋操作之前,务必要对组织样本进行充分的固定与脱水处理,这是确保样本抗原性得以保留以及完整性不受破坏的重要前提,任何环节的疏忽都可能导致后续实验的失败。
三、切片
技术选择
| 类型 | 厚度 | 保存条件 | 适用场景 |
|---|---|---|---|
| 石蜡切片(IHC-P) | 4-5 μm | 常温 | 常规病理诊断 |
| 冰冻切片(IHC-F) | 5-10 μm | -80℃ | 脂类/酶活性检测 |
(一)目的
切片环节旨在将包埋后的组织样本精准切割成薄片,其厚度需满足在显微镜下能够清晰观察并检测目标蛋白质的要求,为后续的免疫组化染色及显微镜观察做好准备。
(二)基本步骤
-
切片前的准备 :首先,要确保包埋后的组织块已经充分冷却并完全固化,达到适合切片的硬度。同时,根据组织样本的特性以及实验要求,选择合适的切片机,并对切片机进行调试,确保其处于良好的工作状态。
-
切片 :将准备好的包埋组织块牢固地固定在切片机的样本夹上,依据实验需求,调整切片机的切片厚度,一般情况下,切片厚度设定为 4 - 5 微米较为适宜。在切片过程中,要保持切片机的稳定运行,确保切出的组织切片薄厚均匀、完整无缺。
-
展片 :使用柔软的刷子或毛笔轻轻将切好的组织切片从刀片上取下,然后将其放置在预先准备好的温水(水温控制在 40℃左右)中展开,使组织切片能够平铺在水面上,避免出现褶皱或重叠的情况。
-
烤片 :将展开后的组织切片从水中取出,小心地放置在载玻片上,并将载玻片放入烤箱中,在 60℃的条件下烤片 2 小时,通过烤片操作,能够使组织切片牢固地粘附在载玻片上,防止在后续实验过程中出现切片脱落的现象。
(三)注意事项
-
在切片过程中,切片机的速度要控制得当,过快的速度可能导致切片质量下降,出现切片破碎或厚薄不均的情况;同时,切片刀必须保持锋利,钝刀不仅会影响切片质量,还可能对组织样本造成损伤。
-
切片完成后,应立即对切片进行后续处理,尽量缩短切片在外界环境中的暴露时间,以避免抗原发生损失或组织出现变性的情况,确保样本的原始特性不受影响。
-
为了保证切片能够牢固地附贴在载玻片上,在使用载玻片前,可预先对其进行适当的清洁与处理,去除表面的灰尘、油脂等杂质,并可涂抹适量的黏贴剂,增强切片与载玻片之间的粘附力。
四、脱蜡水化
(一)目的
脱蜡水化是免疫组化实验中至关重要的一环,其主要目的是将组织切片从石蜡中彻底释放出来,同时使其恢复到适合进行后续抗原检测与染色处理的状态,为后续实验的顺利开展创造条件。
(二)基本步骤
-
脱蜡 :将组织切片放置在切片架上,然后将其浸入二甲苯中,利用二甲苯能够溶解石蜡的特性,对切片进行浸泡处理,一般每次浸泡时长为 5 分钟,连续浸泡三次,以确保切片上的石蜡被完全去除。
-
水化 :完成脱蜡后,组织切片需要经过一系列不同浓度乙醇的处理,逐步实现水化。具体步骤为:将切片依次置于 100% 乙醇中浸泡两次(每次 5 分钟)、95% 乙醇中浸泡 3 分钟、85% 乙醇中浸泡 3 分钟、75% 乙醇中浸泡 3 分钟,最后在去离子水中浸泡 5 分钟,使组织切片从有机溶剂环境中逐渐过渡到水环境中,为后续的抗原修复等步骤做好准备。
(三)注意事项
-
脱蜡过程必须彻底,任何残留的石蜡都会对后续的抗原检测与染色环节产生严重干扰,导致抗体无法正常与抗原结合,影响实验结果的准确性,因此在脱蜡过程中要密切关注切片的变化,确保石蜡被完全清除。
-
在整个脱蜡水化过程中,必须始终保持切片处于湿润状态,避免切片出现干燥的情况。一旦切片干燥,不仅会导致非特异性抗体结合,还会出现高背景染色等不良现象,严重影响实验结果的特异性和可观察性。
五、抗原修复
(一)目的
在组织固定过程中,部分抗原表位可能会被隐藏或发生构象改变,从而影响抗体与抗原的正常结合。抗原修复的目的就在于通过特定的方法与试剂,将这些被隐藏或改变的抗原表位重新暴露出来,显著提高抗体的结合效率,增强免疫组化染色的效果,使目标蛋白质能够被更准确地检测与定位。
(二)抗原修复的方法
-
微波热修复 :首先,在染色盒中加入适量的抗原修复液,然后将组织切片小心放入其中,置于微波炉中,选择中火加热 8 分钟,随后停火 7 分钟,再转小火加热 8 分钟,最后取出染色盒,让其自然冷却至室温。
-
水浴热修复 :在染色盒中加入抗原修复液,并放入组织切片,随后将染色盒置于水浴锅中加热,期间要不断使用温度计监测温度,当抗原修复液的温度达到 92℃时,维持该温度 40 分钟,之后取出染色盒,冷却至室温。
-
高压热修复 :将抗原修复液加入到染色盒中,放入组织切片,然后将染色盒置于高压锅内,加热至锅内达到饱和压力后,继续加热 5 分钟,关闭电源,待 10 分钟后取出染色盒,冷却至室温。
-
酶解修复 :常用的消化酶包括胰蛋白酶、胃蛋白酶、蛋白酶 K 等。将组织切片置于含有相应酶解液的载玻片上,在适宜的温度(通常为 37°C)和湿度条件下进行酶解处理,一般酶解时长为 20 分钟。酶解完成后,同样需要将切片冷却至室温,再进行后续的实验处理。
(三)注意事项
-
在进行加热修复(如微波热修复、水浴热修复、高压热修复)后,务必让染色盒自然降温至室温,切忌在高温状态下直接取出切片进行后续操作,以免因温度差异导致组织切片受损或出现其他不良现象。
-
在进行抗原修复时,要使用过量的抗原修复液,确保组织切片能够充分浸泡在修复液中,保证修复效果的均匀性与有效性。
-
修复液的不同 pH 值对染色结果有着显著的影响,不同的抗体可能需要不同 pH 值的修复液才能达到最佳的染色效果,因此在实验前应充分查阅相关资料,根据所使用的抗体特性选择合适 pH 值的抗原修复液。
-
没有一种抗原修复缓冲液能够适用于所有的抗原,不同的抗体由于其特异性与靶抗原的特性差异,往往需要不同的抗原修复方法与条件。因此,在实验过程中,需要根据具体的实验要求以及所使用的抗体特性,灵活选择合适的抗原修复方法,以获得最佳的染色效果。
六、灭活
(一)目的
灭活步骤的主要目的是消除细胞或组织中内源性酶以及活性物质对实验结果的潜在影响,通过有效降低背景噪音,显著提高实验的特异性和敏感性,使目标蛋白质的检测信号更加清晰、准确。
(二)基本步骤
-
灭活内源性过氧化物酶 :当使用 HRP(辣根过氧化物酶)检测系统时,为避免内源性过氧化物酶对显色反应产生干扰,常用 3% 过氧化氢水溶液对切片进行处理,在室温条件下孵育 10 分钟,利用过氧化氢的氧化作用,使内源性过氧化物酶失去活性。
-
洗涤 :灭活处理完成后,使用 PBS 或 TBS 等缓冲液对切片进行洗涤,浸泡两次,每次时长为 5 分钟,以彻底去除残留的灭活试剂以及其他可能存在的杂质,确保切片表面干净,为后续实验创造良好的条件。
(三)注意事项
-
H2O2 需现用现配,并且在 4℃避光保存条件下使用,否则 H2O2 极易分解失效,进而可能引发非特异性背景染色,严重影响实验结果的准确性。
-
H2O2 孵育时间不宜过长,过长的孵育时间不仅不能进一步提高灭活效果,反而可能导致组织切片出现脱片现象,影响实验的正常进行。
-
除内源性过氧化物酶外,部分组织还可能含有内源性碱性磷酸酶,对于这类组织,可采用左旋咪唑进行灭活处理,以确保实验结果的可靠性。
七、封闭
(一)目的
封闭步骤的核心目标是封闭组织切片上存在的非特异性结合位点,通过阻断这些位点,有效防止抗体与非特异性位点结合,从而显著减少背景信号,使免疫组化染色结果更加清晰、特异,便于观察与分析目标蛋白质的表达情况。
(二)基本步骤
-
非特异位点封闭 :将适量的封闭液精准滴加到组织切片上,确保封闭液能够均匀覆盖整个组织区域,无遗漏之处。随后,将切片放入湿盒中,在室温或 37°C 的条件下孵育 30 分钟,使封闭液有足够的时间与组织切片上的非特异性结合位点充分作用,发挥封闭效果。
-
洗涤 :封闭结束后,使用 PBS 或 TBS 等缓冲液对切片进行洗涤,以去除未结合的封闭液以及可能存在的杂质,避免这些物质对后续的抗体孵育环节产生不良影响。
八、一抗孵育
(一)目的
一抗孵育是免疫组化实验中极为关键的步骤之一,其主要目的在于利用特异性的一抗识别并结合组织切片中的目标抗原,为后续的检测提供准确、可靠的标记,确保实验结果能够真实反映目标蛋白质的表达情况。
(二)基本步骤
-
选择一抗 :根据具体的实验目的,精心挑选特异性高、亲和力强的一抗。所选一抗必须与目标抗原的种属来源、类型等特性高度匹配,这样才能保证一抗能够准确识别并结合目标抗原,避免非特异性结合导致的假阳性结果。
-
稀释一抗 :依据一抗的效价以及实验要求,使用适当的稀释液(如 PBS、TBS 等)对一抗进行稀释,确定合适的稀释比例,既能保证一抗与抗原的有效结合,又能避免一抗浓度过高导致的背景染色等问题。
-
涂覆一抗 :将稀释好的一抗均匀涂覆在已经完成封闭处理的组织切片上,操作过程中要确保抗体能够充分接触组织切片上的每一个可能含有抗原的部位,避免出现抗体分布不均的情况。
-
孵育 :将涂覆好一抗的组织切片放入湿盒中,在室温(或 37°C)条件下孵育 1 小时,给予足够的时间让一抗与抗原充分结合,形成稳定的抗原 - 抗体复合物,为后续的检测步骤奠定基础。
(三)注意事项
-
在实验前,务必确保一抗的质量与特异性,避免使用过期或质量不佳的一抗,因为劣质的一抗可能导致实验结果出现偏差,如灵敏度降低、特异性下降等,严重影响实验的可靠性。
-
在一抗孵育结束后,要充分洗涤组织切片,使用合适的洗涤液(如 PBST 或 TBST)缓慢摇动洗涤切片,以去除未结合的一抗以及其他杂质,减少背景染色,使目标蛋白质的染色信号更加清晰可辨。一般洗涤需要重复多次,每次洗涤时间根据实际情况而定,通常为 5 - 10 分钟。
九、二抗孵育
(一)目的
二抗在免疫组化实验中扮演着至关重要的角色,其主要作用是与一抗特异性结合,形成抗原 - 抗体 - 抗体复合物。通过二抗上携带的标记酶(如 HRP、AP 等),在后续的显色步骤中能够产生可见的染色信号,极大地增强了信号的强度与特异性,便于在显微镜下清晰地观察目标抗原在组织中的分布和表达情况。
(二)基本步骤
-
稀释二抗 :参考二抗的说明书,根据其推荐的稀释比例以及实验要求,使用封闭液或其他适当的溶液对二抗进行稀释,确保二抗在适宜的浓度下工作,既能保证与一抗的有效结合,又能避免浓度过高导致的非特异性染色。
-
孵育二抗 :将稀释好的二抗均匀滴加在已经完成一抗孵育并经过充分洗涤的组织切片上,根据实验需求,在室温条件下孵育 30 分钟至 60 分钟不等,给予足够的时间让二抗与一抗充分结合,形成稳定的复合物。
-
洗涤 :孵育完成后,使用洗涤液(如 PBST 或 TBST)在摇床上缓慢摇动洗涤切片,以去除未结合的二抗以及其他杂质,减少背景染色,使目标信号更加突出。洗涤通常需要重复多次,每次洗涤时间一般为 5 - 10 分钟,确保切片表面干净无残留。
十、显色反应
(一)目的
显色反应是免疫组化实验中将抗原所在位置可视化的重要环节,通过显色检测,能够在组织切片上直观地呈现出目标蛋白质的分布与表达水平,为实验结果的观察与分析提供直接依据。
(二)基本步骤
-
加入酶的底物 :根据所使用的标记酶类型,加入相应的酶底物。例如,当使用 HRP 作为标记酶时,其底物为 DAB;而使用 AP 作为标记酶时,底物则为 BCIP/NBT。
-
显色反应 :在酶的催化作用下,底物发生化学反应,生成有色沉淀物。对于 HRP - DAB 系统,通常会形成棕色沉淀物;而对于 AP - BCIP/NBT 系统,则会生成蓝色沉淀物。这些有色沉淀物会精准地沉积在抗原所在的位置,通过显微镜观察组织切片上的颜色变化,就能够确定抗原在细胞或组织中的具体位置和表达水平。
-
终止反应 :在显色过程中,要密切观察切片的显色程度,一般显色时间为 3 - 8 分钟。一旦达到满意的显色效果,应及时用蒸馏水洗脱,防止显色过深,影响对实验结果的观察与判断。
(三)注意事项
-
DAB 工作液必须现用现配,因为 DAB 具有一定的不稳定性,长时间放置后可能会影响显色效果,甚至产生非特异性染色。
-
在选择检测系统时,要根据实验目的以及样本特性进行综合考虑,选择合适的酶标记系统与相应的底物,以确保能够获得最佳的显色效果和实验结果。
-
为了获得最佳的检测结果,在实验前应对一抗、二抗的浓度、孵育时间和温度等条件进行优化,通过预实验等方式摸索出最适合当前实验体系的条件参数。
-
在显色操作过程中,需注意防护措施,因为 DAB 为联苯偶氮化合物,具有一定的致癌性,可诱发皮肤癌和膀胱症等疾病,操作人员应佩戴手套、口罩等防护用品,避免直接接触皮肤与吸入气体。
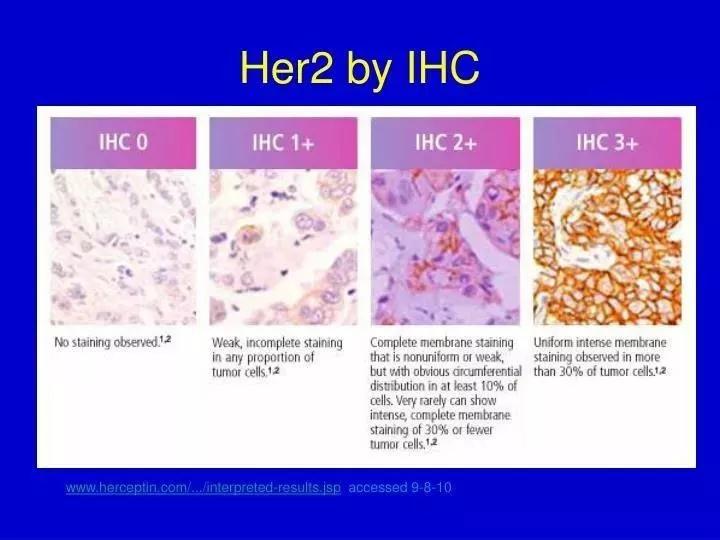
免疫组化染色效果对比图
十一、复染
(一)目的
复染操作的主要目的是为了在组织切片上形成清晰的细胞轮廓,通过复染后的颜色对比,更好地定位目标蛋白在细胞中的具体位置,使实验结果更加直观、易于观察与分析。
(二)基本步骤
将 80 - 100 μL 苏木素染色液均匀滴加至组织切片上,确保染色液完全覆盖整个组织区域,在室温条件下孵育 5 分钟。随后,使用 1% 盐酸酒精对切片进行分化处理,分化时间仅为 1 秒,以去除切片上过多的苏木素染色,使细胞核等结构呈现出清晰的蓝色。最后,用自来水稍作冲洗,再进行自来水返蓝处理 5 分钟,使细胞核的蓝色更加鲜明,便于在显微镜下观察。
(三)注意事项
-
复染时间需要根据实际情况进行摸索与调整,这与苏木精的配制浓度、染色液的新鲜程度等因素密切相关。如果染色过浅,可适当延长染色时间或重复染色;反之,如果染色过深,则可使用盐酸进行分化处理,通过控制分化时间来调整染色深度,直至达到理想的染色效果。
-
在复染过程中,要密切关注切片的染色变化情况,避免因染色时间过长或过短而导致染色效果不佳,影响对目标蛋白的定位与观察。
十二、封片观察
(一)目的
封片观察是免疫组化实验的最后一个关键步骤,其主要目的是保护组织切片免受外界环境的干扰与损伤,同时增强切片的对比度与稳定性,使切片能够在显微镜下进行长期、稳定的观察与分析,为实验结果的记录与后续研究提供便利。
(二)封片步骤
-
脱水 :在完成所有染色步骤后,首先需要对组织切片进行脱水处理,以去除切片上的水分。具体操作为:将切片依次置于 70%、85%、95% 乙醇以及无水乙醇 I、无水乙醇 Ⅱ 中分别浸泡 1 分钟,逐步提高乙醇浓度,使切片中的水分被充分置换出来。
-
透明 :脱水完成后,切片需要进行透明处理,以便封片剂能够均匀分布在切片上,同时使光线能够更好地穿透切片,提高观察效果。通常使用二甲苯浸泡两次,每次浸泡时长为 1 分钟。
-
封片 :将适量的封片剂滴在组织切片上,然后用盖玻片轻轻覆盖,操作过程中要确保没有气泡产生,并且盖玻片与切片之间紧密贴合,避免出现缝隙或气泡影响观察效果。封片剂的选择应根据实验要求以及标本类型来确定,常用的封片剂有中性树胶、甘油明胶等。
-
干燥 :封片完成后,让封片剂自然干燥,或者根据实际情况,可将切片放入温箱中加速干燥过程。干燥后的切片能够长期保存,并且可以随时用于显微镜观察,为后续的研究工作提供稳定的样本支持。
免疫组化(IHC)技术凭借其能够精确定位组织切片中特定蛋白质的优势,在生物医学研究、疾病诊断等多个领域发挥着不可替代的重要作用。通过严格遵循上述实验流程,从样本固定到封片观察的每一个环节都精心操作,科研人员便能够获得高质量的 IHC 实验结果,为深入探究蛋白质的表达与分布情况提供有力保障,推动相关领域的研究不断向前发展。
| 名称 | 货号 | 规格 |
| Anti-Rabbit and Mouse HRP&DAB IHC detection kit | S0C1001-5ml(for50slides) | 5ml (for 50 slides) |
| Anti-Rabbit HRP-DAB IHC detection kit | S0C2031-5ml-for50slides | 5ml(for50slides) |
| Multiple IHC | mIHC-001-1次 | 1次 |
| 多色免疫组化试剂盒 | bulk-IHC-kit | kit |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)