表皮生长因子受体
一、EGFR的结构与功能
表皮生长因子受体(Epidermal Growth Factor Receptor, EGFR)是表皮生长因子受体(HER)家族成员之一,该家族包括HER1(erbB1,EGFR)、HER2(erbB2,NEU)、HER3(erbB3)及HER4(erbB4)。EGFR是一种糖蛋白,属于酪氨酸激酶型受体,细胞膜贯通,分子量170KDa。EGFR广泛分布于哺乳动物上皮细胞、成纤维细胞、胶质细胞、角质细胞等细胞表面,EGFR信号通路对细胞的生长、增殖和分化等生理过程发挥重要的作用。
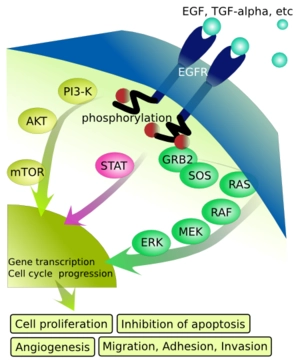
EGFR分为三区:胞外配体结合区,跨膜区和胞内激酶区。胞外配体结合区负责与配体结合,包括EGF和TGFα(transforming growth factor α)等。跨膜区是一个单链的疏水区域,将受体锚定在细胞膜上。胞内激酶区含有酪氨酸激酶活性,负责受体的自磷酸化和下游信号的传导。
二、EGFR的信号通路
EGFR激活后,会通过多种信号通路调控细胞的增殖、分化和存活。主要的信号通路包括:
-
Ras-Raf-MEK-ERK通路:促进细胞进入细胞周期和增殖。
-
PI3K/Akt/mTOR通路:抑制细胞凋亡,促进细胞存活。
-
PLC-γ/PKC通路:调节细胞内钙离子浓度和细胞骨架重排。
三、EGFR与肿瘤
研究表明,在许多实体肿瘤中存在EGFR的高表达或异常表达。EGFR与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关。其可能机制包括:
-
EGFR的高表达引起下游信号传导的增强。
-
突变型EGFR受体或配体表达的增加导致EGFR的持续活化。
-
自分泌环的作用增强。
-
受体下调机制的破坏。
-
异常信号传导通路的激活等。
EGFR的过表达在恶性肿瘤的演进中起重要作用,胶质细胞、肾癌、肺癌、前列腺癌、胰腺癌、乳腺癌等组织中都有EGFR的过表达。对胶质细胞瘤的研究发现EGFR的高表达主要与其基因扩增有关。但有时EGFR表达水平的调节异常也存在于翻译及翻译后。EGFR在肿瘤中的高表达还可能与活化后降解减少有关,一些研究指出c-Src可通过抑制受体泛素化和内吞作用而上调EGFR水平。
四、EGFR的突变与耐药性
EGFR的突变在许多肿瘤中普遍存在,突变型EGFR的作用可能包括:
-
具有配体非依赖型受体的细胞持续活化。
-
由于EGFR的某些结构域缺失而导致受体下调机制的破坏。
-
异常信号传导通路的激活。
-
细胞凋亡的抑制等。
突变体的产生是由于EGFR基因的缺失、突变和重排。常见的EGFR突变包括18-21外显子的突变,其中19和21号外显子突变覆盖突变的90%。这些突变可能导致对EGFR抑制剂的耐药性,例如T790M突变是第一代EGFR酪氨酸激酶抑制剂(TKIs)耐药的主要机制之一。
五、EGFR与肿瘤治疗
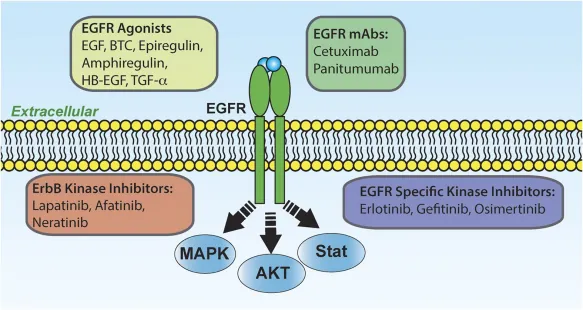
EGFR作为肿瘤治疗的重要靶点,已有多种针对EGFR的治疗策略被开发出来,包括单克隆抗体和酪氨酸激酶抑制剂。这些药物通过阻断EGFR的配体结合或抑制其激酶活性,从而抑制肿瘤细胞的增殖和存活。
单克隆抗体
单克隆抗体如西妥昔单抗(Cetuximab)和帕尼单抗(Panitumumab)能够竞争性抑制EGFR配体的结合,从而阻断EGFR信号通路。
酪氨酸激酶抑制剂
酪氨酸激酶抑制剂如吉非替尼(Gefitinib)、厄洛替尼(Erlotinib)和布加替尼(Brigatinib)等小分子药物,通过结合EGFR的胞内激酶结构域,抑制其激酶活性,从而阻断下游信号传导。
六、结论与展望
EGFR作为一种重要的受体酪氨酸激酶,在细胞的生长、增殖和存活中发挥关键作用。其在多种肿瘤中的异常表达和突变使其成为肿瘤治疗的重要靶点。尽管针对EGFR的治疗策略已取得显著进展,但耐药性仍是当前面临的主要挑战。未来的研究应进一步探索EGFR在肿瘤中的具体作用机制,以及开发新的治疗策略以克服耐药性,为肿瘤患者提供更有效的治疗选择。
| 名称 | 货号 | 规格 |
| Anti-EGFR Monoclonal Antibody(Cetuximab) | S0B0558-1mg | 1mg |
| EGFR (delE746-A750) Recombinant Rabbit mAb (S-451-168) | S0B0457-1ml | 1ml |
| EGFR Recombinant Rabbit mAb (SDT-R110) | S0B2145-10μl | 10μl |
| EGFR (L858R) Recombinant Rabbit mAb,PBS Only (SDT-421-202) | S0B2355P-1mg | 1mg |










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)