Designed mosaic nanoparticles enhance cross-reactive immune responses in mice
引言
SARS-CoV-2变体,尤其是Omicron,通过持续进化改变抗原表位以增强免疫逃逸,这对全球公共卫生构成了重大挑战。此外,类SARS人畜共患乙型冠状病毒(sarbecoviruses)的跨物种溢出也可能引发未来的大流行。因此,开发能够预防SARS-CoV-2变体和由sarbecovirus衍生的新病毒的通用疫苗至关重要。
研究背景
SARS-CoV-2通过其刺突三聚体的受体结合域(RBD)与宿主受体血管紧张素转换酶2(ACE2)结合以进入宿主细胞。通用疫苗需要能够产生针对刺突蛋白三聚体上保守表位的抗体。此前,利用SpyCatcher-SpyTag系统开发的mosaic-8b RBD纳米颗粒(RBD NPs)展示了SARS-CoV-2和7种人畜共患sarbecovirus的RBD,能够促进交叉反应抗体的产生,并在动物模型中证明了其保护效果。
研究方法
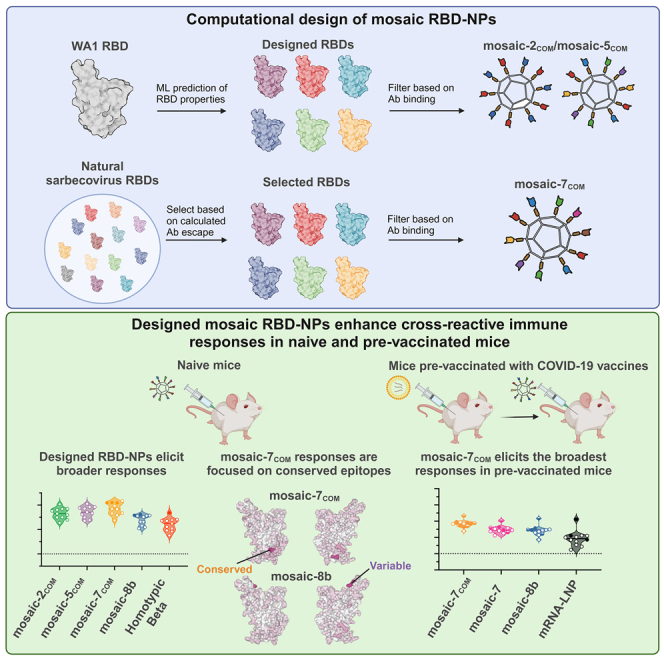
麻省理工学院Arup K. Chakraborty团队结合计算和实验方法设计并测试了新的mosaic-RBD NPs。研究团队从NCBI数据库中获取了246个非冗余sarbecovirus RBD序列,使用ClustalW将其与WA1 RBD进行比对,并选择氨基酸序列一致性最低的RBD用于合成新的mosaic NP。通过与已知的L蛋白抑制剂进行对接研究,研究团队揭示了抗病毒药物耐药性的潜在机制。
研究结果
-
mosaic-7COM RBD NP的设计与测试:新设计的mosaic-7COM RBD NP在小鼠体内引发了更高的结合效价,并对一系列病毒株表现出更广泛和更有效的中和能力。
-
免疫反应评估:mosaic-7COM RBD NP免疫的小鼠显示出对所有测试RBD的最高结合效价,尽管对未展示的SARS-CoV-2 WA1和BA.5 RBD的中和效价较低。
-
先前疫苗接种的影响:在先前接种COVID-19疫苗(WA1辉瑞mRNA-LNP疫苗和二价WA1/BA.5 mRNA-LNP疫苗)的BALB/c小鼠中,mosaic-7COM诱导了更广泛和更有效的中和抗体。
研究意义
该研究通过计算优化蛋白质序列,增加了纳米颗粒展示的RBD多样性,从而诱导更广泛有效的交叉反应性抗体。这一发现为开发针对SARS-CoV-2及其变体的通用疫苗提供了重要的科学依据,并为未来应对新兴病毒威胁提供了新的策略。
结论
mosaic-7COM的设计和测试结果证明,通过计算方法优化蛋白质序列以增加纳米颗粒展示的RBD多样性,可以诱导更广泛有效的交叉反应性抗体。这种策略不仅解决了现有疫苗的局限性,还为开发泛sarbecovirus候选疫苗提供了新的方向。
| 名称 | 货号 | 规格 |
| Goat Anti-Mouse IgG H&L (HRP) | ab6789-1mg | 1mg |
| Sensiscript RT Kit (50) | 205211 | 50Test |
| M-MLV Reverse Transcriptase | M1701 | 10,000u |
| M-MLV Reverse Transcriptase | M1705 | 50,000u |











 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)