2024年全球新药审批:53款创新药如何重塑难治性疾病治疗格局?
2025年4月,《British Journal of Pharmacology》(英国药理学杂志)发布年度重磅综述,深度解析2024年欧洲药品管理局(EMA)、美国FDA和英国MHRA三大机构批准的53款新药。尽管总数较2023年(70款)有所回落,但亮点频现:21款孤儿药和28款全球首创(FIC)药物表现突出,靶向机制的创新突破与罕见病治疗的全面发力成为两大核心方向。本文带您全景式解读年度新药“成绩单”,探讨精准医疗如何突破“无药可治”瓶颈,为患者带来新希望。

一、年度数据速览:从“量”到“质”的突破
📊 三大关键数据
-
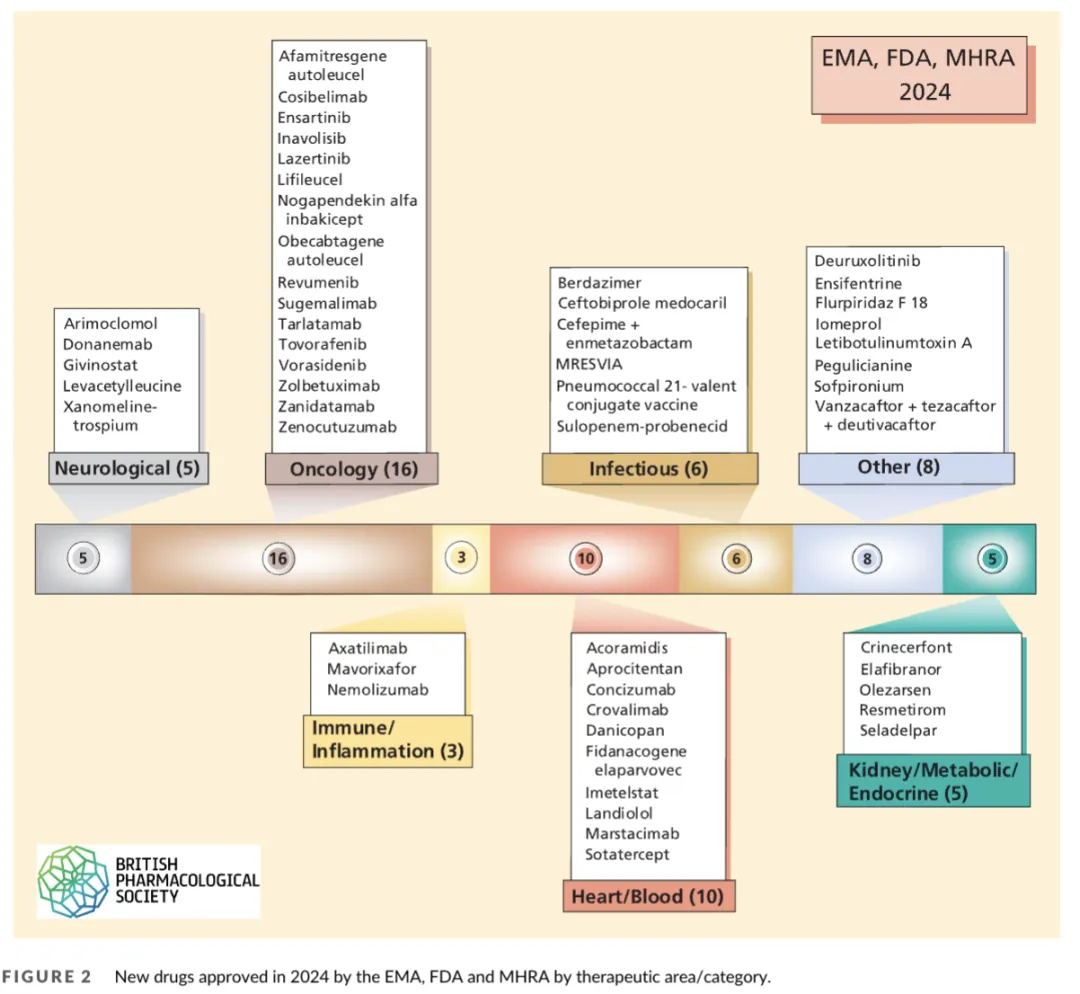
53款新药获批
2024年,三大机构共批准53款新药,涵盖小分子(30款)、蛋白质/抗体(15款)、先进疗法(ATMPs,6款)及疫苗(2款)。其中孤儿药占比高达40%(21款),罕见病治疗领域持续升温。 -
28款全球首创(FIC)
首次针对特定靶点或机制的创新药物占比达53%,包括首个“对接-阻断”抗体、新型精神分裂症药物等,多项治疗领域实现“零突破”。 -
区域审批差异
FDA批准29款,EMA批准18款,MHRA批准13款。EMA对阿尔茨海默病药物lecanemab的“先拒后批”决策引发行业对风险评估标准的广泛讨论。

二、六大领域突破性药物:重新定义“难治性疾病”
1. 肿瘤治疗:从“精准打击”到“细胞革命”
-
实体瘤细胞疗法破冰
-
Lifileucel(美国FDA):全球首款用于实体瘤的肿瘤浸润淋巴细胞(TIL)疗法,通过从患者肿瘤中提取并扩增T细胞后回输,使晚期黑色素瘤患者的客观缓解率达31.4%,中位缓解持续时间超过27个月。
-
Afamitresgene autoleucel(美国FDA):首个靶向MAGE-A4抗原的TCR-T细胞疗法,针对滑膜肉瘤患者缓解率达37%,为软组织肉瘤治疗带来新希望。
-
-
机制创新药物
-
Zenocutuzumab(美国FDA):全球首个“对接-阻断”双特异性抗体,通过结合HER2与HER3阻断NRG1融合致癌信号,覆盖肺癌、胰腺癌等难治性肿瘤。
-
Imetelstat(美国FDA):首个端粒酶抑制剂,通过抑制癌细胞端粒延长,使39.8%的骨髓增生异常综合征患者摆脱输血依赖,开辟“基因层面抗癌”新赛道。
-
2. 罕见病:从“孤儿”到“曙光”
-
神经罕见病双药获批
-
Arimoclomol(美国FDA):联合miglustat治疗Niemann-Pick病,通过诱导热休克蛋白保护神经细胞,延缓病情进展65%,填补超罕见病治疗空白。
-
Levacetylleucine(美国FDA):首个通过改善线粒体功能治疗神经退行性疾病的药物,24周内使患者共济失调评分降低1.97分,提供代谢调控新策略。
-
-
代谢疾病突破
-
Olezarsen(美国FDA):首款靶向载脂蛋白CIII的反义寡核苷酸,使家族性乳糜微粒血症患者甘油三酯水平下降43.5%,急性胰腺炎年均发作次数从11次降至1次。
-
3. 免疫与炎症:从“抑制”到“精准调控”
-
瘙痒症特效药
-
Nemolizumab(美国FDA):全球首个IL-31受体拮抗剂,针对结节性痒疹的瘙痒缓解率达56.3%,打破“抓挠-结节”恶性循环,改写顽固性瘙痒治疗指南。
-
-
移植并发症新解
-
Axitilimab(美国FDA):靶向CSF-1R阻断巨噬细胞活化,使慢性移植物抗宿主病总缓解率达74%,显著改善造血干细胞移植患者的生存质量。
-
4. 心脑血管:从“替代”到“机制革新”
-
血友病治疗范式转变
-
Marstacimab(美国FDA):首款不依赖凝血因子补充的药物,通过抑制TFPI恢复Xa因子活性,使血友病A/B患者年化出血率降低92%,实现从“每周注射”到“皮下长效给药”的转变。
-
-
高血压耐药突破
-
Aprocitentan(欧盟EMA):首个双重内皮素受体拮抗剂,使难治性高血压患者收缩压额外降低3.8 mmHg,为约10%的“药物抵抗型”患者提供全新治疗选择。
-
5. 精神疾病:30年靶点新突破
-
Xanomeline-trospium(美国FDA):首个针对M1/M4毒蕈碱受体的激动剂组合,通过激活大脑特定受体改善精神分裂症症状,5周内使患者阳性/阴性症状评分降低30%,且无传统抗精神病药物的代谢副作用,被誉为“30年来该领域最大突破”。
6. 疫苗领域:mRNA技术再拓新版图
-
MRESVIA(美国FDA):继新冠疫苗后首款mRNA疫苗,针对呼吸道合胞病毒(RSV),在60岁以上人群中的预防有效率达78.7%,为通用型mRNA疫苗研发奠定基础。
这些突破性药物不仅展示了精准医疗的强大潜力,也为攻克“无药可治”的医学难题提供了全新解决方案。
三、监管争议与行业启示:从“风险博弈”到“全球协同”
⚖️ 两大焦点事件
-
Lecanemab审批“反转剧”
美国FDA(2023年)和英国MHRA(2024年)先后批准lecanemab用于早期阿尔茨海默病治疗。尽管该药可能引发20%-40%患者出现脑肿胀(ARIA)风险,但欧洲药品管理局(EMA)在“风险-获益”评估中最初拒绝批准,最终于2024年11月“反转”批准。这一事件凸显了全球监管机构在“疗效 vs 安全性”上的动态平衡考量。 -
孤儿药政策倾斜
2024年批准的21款孤儿药中,15款通过FDA的“优先审评”或“突破疗法”通道加速获批。例如,治疗白血病的Revumenib仅用8个月完成审批,体现了“以患者为中心”的监管创新。
🌟 行业启示
-
机制创新为王
双特异性抗体(10款)、基因与细胞疗法(6款)成为研发热点,“一药多靶”“精准靶向”成为攻克难治性疾病的关键路径。 -
罕见病不再“罕见”
随着基因测序和个体化医疗的进步,孤儿药研发的回报率显著提升。预计未来五年,全球罕见病药物市场的年复合增长率将超过15%。
结语:当“无药可治”成为过去
2024年的53款新药不仅是数字,更是千万患者的“生命密码”。从实体瘤细胞疗法的“抗癌革命”,到罕见病药物的“精准破局”,再到精神疾病治疗的“靶点破冰”,人类正以前所未有的速度突破疾病边界。正如文章作者Stavros Topouzis所言:“这些创新不仅改写指南,更预示着‘疾病agnostic’治疗时代的到来——未来,药物或将不再局限于病种,而是针对共同的分子缺陷,让更多‘绝症’变为‘可控慢性病’。”
数据来源与期刊背景
本文数据来源于《British Journal of Pharmacology》2025年4月综述“Novel drugs approved by the EMA, the FDA and the MHRA in 2024: A year in review”。《British Journal of Pharmacology》:药理学领域的“年度风向标”,创刊于1908年,专注于药物作用机制、新药发现及监管科学,最新影响因子为7.7(2023年)。其年度新药综述因覆盖三大机构、深度解析机制创新,已成为全球医药行业、监管机构及临床医生的“决策参考手册”。










 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)