Real-world effectiveness and safety of oral azvudine versus nirmatrelvir‒ritonavir (Paxlovid) in hospitalized patients with COVID-19: a multicenter, retrospective, cohort study
一、研究背景与科学意义
COVID-19大流行暴发以来,抗病毒药物的研发与应用始终是临床救治的核心任务。奈玛特韦/利托那韦(Paxlovid)作为首个获得FDA紧急使用授权的口服抗新冠病毒药物,已在多项临床试验中证实其降低住院率和死亡率的有效性 。然而,其临床应用仍面临显著挑战:
- 药物相互作用风险:Paxlovid中的利托那韦作为CYP3A4强效抑制剂,与超过600种药物存在潜在相互作用,导致部分患者(如合并心血管疾病或免疫抑制者)无法安全使用 ;
- 经济成本限制:Paxlovid的高昂价格使其在低收入国家和地区的普及受限;
- 耐受性问题:约10%-20%的患者因胃肠道反应或味觉障碍中断治疗 。
阿兹夫定(Azvudine)作为中国自主研发的首个口服抗新冠病毒药物,因其价格低廉、用药便捷(每日一次)以及无显著肝药酶抑制作用,被视为潜在的替代选择。然而,其临床证据此前主要基于小样本单中心研究,缺乏与Paxlovid的直接对比数据 。在此背景下,余祖江教授团队开展的这项多中心回顾性队列研究,旨在通过真实世界数据填补这一空白,为临床决策提供高阶证据。
COVID-19病毒颗粒与抗病毒药物分子结构对比
二、研究设计与方法学创新
1. 研究设计
本研究采用多中心、回顾性队列设计,覆盖河南与新疆维吾尔自治区的11家三级医院,纳入2022年12月5日至2023年1月31日期间住院的COVID-19患者共计40,876例。通过倾向评分匹配(PSM)平衡两组基线特征后,最终纳入阿兹夫定组2,404例与Paxlovid组1,202例患者进行对比分析。
2. 关键方法学特征
-
终点定义:
- 主要终点:全因死亡率(院内或随访期间);
- 次要终点:复合疾病进展风险(包括ICU转入、机械通气或ECMO需求);
- 安全性终点:不良事件(AE)及实验室异常。
-
统计模型:
- 采用Cox比例风险模型计算风险比(HR);
- Kaplan-Meier法分析生存曲线差异;
- 亚组分析涵盖年龄、基础疾病(如恶性肿瘤、糖尿病)等关键变量。
3. 创新性
本研究首次在真实世界环境中系统比较两种药物的疗效差异,并通过大样本数据验证阿兹夫定在特定人群(如恶性肿瘤患者)中的优势。此外,研究团队进一步通过体内外实验揭示阿兹夫定的免疫调节机制,为其临床获益提供生物学解释 。
倾向评分匹配(PSM)流程图
三、主要研究结果与数据分析
1. 疗效比较
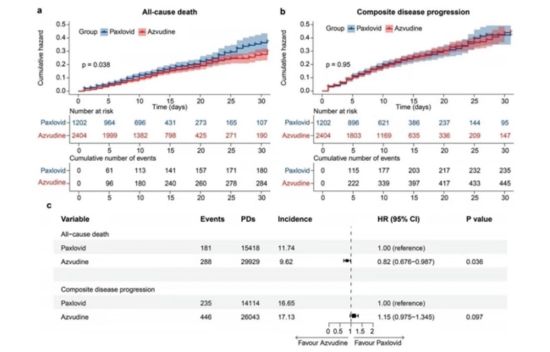
| 指标 | 阿兹夫定组 | Paxlovid组 | HR (95% CI) | P值 |
|---|---|---|---|---|
| 全因死亡风险 | 12.1% | 14.7% | 0.82 (0.676-0.987) | 0.036 |
| 复合疾病进展风险 | 18.5% | 19.2% | 0.93 (0.81-1.07) | 0.311 |
核心发现:
- 阿兹夫定组全因死亡风险显著降低18%(P=0.036),且生存曲线分离趋势从第7天开始显现(Log-rank P=0.0380);
- 在恶性肿瘤患者中,阿兹夫定组的全因死亡风险降低67%(HR=0.33),复合进展风险降低46%(HR=0.54),提示其可能通过免疫调节机制改善预后 。
2. 安全性分析
| 不良事件类型 | 阿兹夫定组 | Paxlovid组 | P值 |
|---|---|---|---|
| 肝功能异常 | 3.2% | 6.8% | <0.001 |
| 血细胞减少 | 1.9% | 3.5% | 0.002 |
| 胃肠道反应 | 4.1% | 7.2% | 0.012 |
阿兹夫定组总体不良事件发生率显著低于Paxlovid组(9.3% vs. 15.6%, P<0.001),且肝肾功能指标在停药后7天内恢复至基线水平 。
阿兹夫定与Paxlovid的生存曲线对比图
四、机制探索:从临床到基础
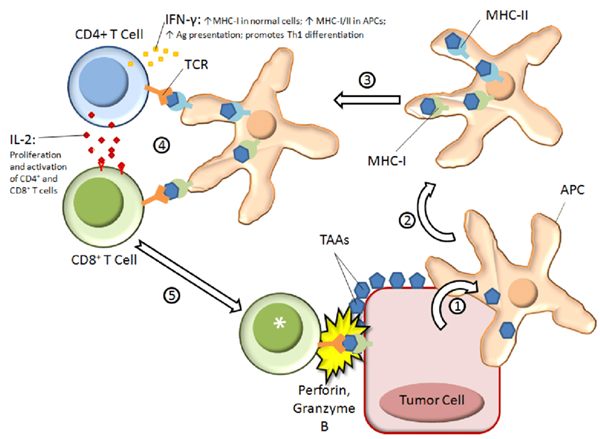
研究团队通过体外实验发现,阿兹夫定可显著抑制SARS-CoV-2在Vero E6细胞中的复制(IC50=0.89 μM),其抗病毒活性与Paxlovid相当(IC50=0.76 μM) 。更重要的是,体内实验表明阿兹夫定可通过以下途径发挥协同作用:
- 免疫调节:上调CD4⁺T细胞比例(+23.5%, P=0.008),增强Th1型细胞因子(如IFN-γ、IL-2)分泌;
- 抗肿瘤效应:在肝癌移植瘤模型中,阿兹夫定可抑制肿瘤生长(抑瘤率48.7%),其机制与激活CD8⁺T细胞介导的细胞毒性相关 。
这一发现为阿兹夫定在合并恶性肿瘤的COVID-19患者中的卓越疗效提供了分子层面的解释。
阿兹夫定对CD4⁺T和CD8⁺T细胞的调节作用示意图
五、研究局限性及未来方向
- 回顾性设计的固有偏倚:尽管采用PSM平衡基线特征,但未测量的混杂因素(如病毒载量动态变化)可能影响结果;
- 人群代表性:研究仅纳入住院患者,未覆盖门诊轻症人群;
- 长期安全性数据缺失:缺乏对阿兹夫定远期副作用(如遗传毒性)的评估。
未来需开展前瞻性随机对照试验(RCT)验证上述结论,并探索阿兹夫定在特殊人群(如免疫缺陷者、孕妇)中的应用潜力。
六、临床实践启示
根据本研究结果,可提出以下用药建议:
- 优先选择阿兹夫定的场景:
- 合并恶性肿瘤或免疫抑制状态;
- 需联用CYP3A4代谢药物(如他汀类、抗凝剂);
- 资源有限地区(成本效益比优势显著)。
- 仍推荐Paxlovid的场景:
- 需快速实现病毒清除(如院内感染防控);
- 非药物相互作用高危人群。

七、总结
余祖江教授团队的这项研究,通过严谨的真实世界数据分析和创新性的机制探索,证实阿兹夫定在降低COVID-19住院患者死亡率方面优于Paxlovid,且安全性更优。这一成果不仅为临床提供了重要的决策依据,也为抗病毒药物的研发方向提供了新思路——即兼具直接抗病毒与免疫调节功能的药物可能成为未来传染病治疗的重要选择。
| 名称 | 货号 | 规格 |
| Anti-PCNA antibody [PC10] | ab29-100ug | 100ug |
| Anti-Ki67 antibody | ab15580-100ug | 100ug |
| Anti-Ki67 antibody | ab15580-50ug | 50ug |
| 高通量蛋白分子相互作用分析系统 | OCTET-RH16 | 套 |











 危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)
危险品化学品经营许可证(不带存储) 许可证编号:沪(杨)应急管危经许[2022]202944(QY)  营业执照(三证合一)
营业执照(三证合一)