氧化应激(OS)是指机体在需要清除体内老化的细胞,或在遭受各种有害刺激时,体内高活性分子,如活性氧自由基(ROS)和活性氮自由基(RNS)产生过多,氧化程度超出氧化物的清除,氧化系统和抗氧化系统失衡,从而导致组织损伤。
为了适应高活性氧水平,肿瘤细胞会改变硫基代谢、NADPH生成和抗氧化转录因子的活性。在启动过程中,遗传变化通过激活抗氧化转录因子或通过戊糖磷酸途径(PPP)增加NADPH,使细胞在高ROS水平下存活。在肿瘤的进展和转移过程中,肿瘤细胞通过各种方式增加NADPH来适应氧化应激,包括激活AMPK、PPP、以及减少谷氨酰胺和叶酸代谢。

△点击放大图片
氧化应激相关领域的研究一直是基础研究的热点。尤其是近20年来,关于该领域研究的文章更是呈线性增长。精细研读高分文章,了解研究思路成了很多老师的入门必修课。今天小优就带大家深入学习两篇氧化应激的高水平文章!
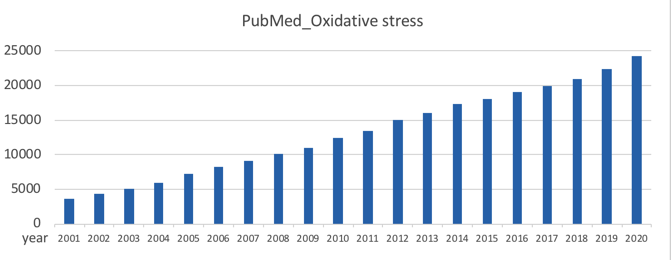
2001年-2020年PubMed 氧化应激相关文献数
△点击放大图片
1. CELL: 抗氧化剂通过稳定BACH1水平来刺激肺癌转移
瑞典卡罗林斯卡学院和哥德堡大学Martin Bergo教授团队

△点击放大图片
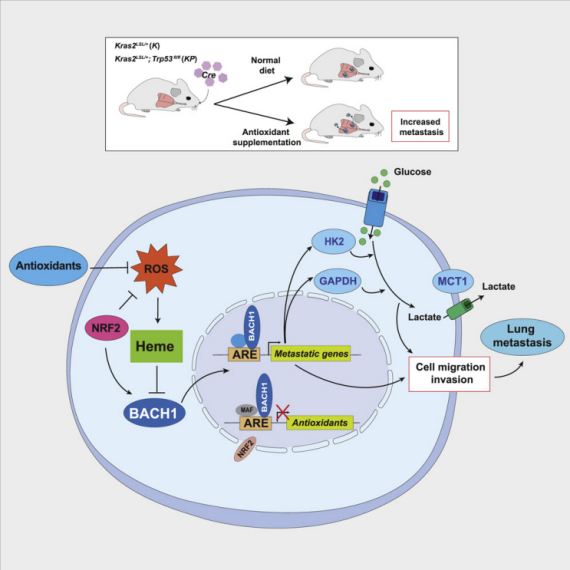
最初,ROS被认为能促进肿瘤进展和转移,这促使健康人群和肿瘤患者在饮食中添加抗氧化剂。然而近年来,新的证据显示,ROS具有抗肿瘤作用,因此,外源/内源抗氧化剂(Antioxidant)具有促肿瘤作用。抗氧化剂可以保护原发性肿瘤细胞免受ROS和DNA损伤,否则它们会激活p53并减慢肿瘤细胞增殖。此外,通过激活NRF2突变或失活KEAP1突变来刺激内源性抗氧化剂基因的转录,可以增加原发性肺肿瘤的生长。
与NRF2一样,BACH1(BTB and CNC homology 1)可响应氧化还原状态的变化而与抗氧化反应元件(ARE)结合。在氧化应激条件下,含血红素的蛋白质氧化释放出游离血红素,从而刺激BACH1;在低氧化应激条件下,血红素水平较低,从而稳定BACH1。本文章研究表明长期补充抗氧化剂N-乙酰半胱氨酸和维生素E会促进KRAS驱动的肺癌转移。抗氧化剂通过降低游离血红素的水平并稳定转录因子BACH1来刺激转移。 BACH1激活Hexokinase 2和Gapdh的转录,并增加葡萄糖摄取,糖酵解速率和乳酸分泌,从而刺激小鼠和人类肺癌细胞的糖酵解依赖性转移。靶向BACH1可正常化糖酵解并防止抗氧化剂诱导的转移,同时在缺乏抗氧化剂的情况下,增加内源性BACH1的表达可刺激糖酵解并促进转移。我们得出结论,BACH1刺激糖酵解依赖性肺癌转移,并且BACH1在降低的氧化应激条件下被激活。
(与该篇文章背靠背同时在Cell发出的还有M. Celeste Simon et al. BACH1 Orchestrates Lung Cancer Metastasis. Cell, online 27 June 2019, DOI: 10.1016/j.cell.2019.06.020,共同揭示肺癌转移中的氧化应激新机制。)
△点击放大图片
本文重点:
1. 抗氧化剂刺激KRAS驱动的肺癌转移
2. 抗氧化剂降低血红素水平并稳定BACH1
3. BACH1激活Hk2和Gapdh转录触发糖酵解诱导的转移
4. 靶向BACH1或其糖酵解靶标可防止抗氧化剂诱导的转移
总结:抗氧化剂通过降低游离血红素水平和稳定转录因子BACH1来刺激肺癌转移
话不多说,咱们开始分析结图(图很多,信息很广,大概需要花30-60min阅读完,虽然篇幅比较长,但确实是花了小编很长时间和精力提炼出来的干货,请耐心看完哟!)
- 抗氧化剂N-乙酰半胱氨酸(NAC)和维他命E可独立于p53基因促进肺癌转移;慢性抗氧化作用增加肺癌细胞的侵袭力,减少活性氧,增加减少能量。

图1: 抗氧化剂NAC和维他命E可独立于p53基因促进肺癌转移
△点击放大图片
(A)给予Kras2LSL / +(K)和Kras2LSL / + Trp53fl / fl(KP)小鼠吸入低剂量的Cre-腺病毒。一周后,在饮用水中服用NAC(1 g / L),在食物中服用维生素E(VitE,0.5 g / kg)。
(B)具有淋巴结转移的K小鼠的百分比。
(C)前表面活性剂蛋白C(pro-SPC)的IHC图:对照K小鼠的正常淋巴结(上)、NAC处理的K小鼠的放大的转移淋巴结(下)。
(D)左图,尸检时,K小鼠具有远处转移的百分比。右图,肾脏(上)和肝脏(下)的远处转移照片。
(E)具有淋巴结转移的KP小鼠的百分比。
(F)左图为具有胸腔转移的KP小鼠的百分比。右图,胸肋骨转移的照片。
(G)在吸入Cre-腺病毒58周后,从对照(mTC)和NAC处理(mTN)K小鼠建立了肺肿瘤细胞系。除非另有说明,否则都在无抗氧化剂的条件下培养细胞。
(H)使用xCelligence系统分析实时细胞入侵。曲线显示3 mTC和4 mTN细胞系的平均侵袭指数。
(I)mTC和mTN细胞的Transwell入侵实验。
(J)左图,静脉内注射mTC和mTN细胞(0.5×105个细胞/小鼠;n = 10)3周后,同基因小鼠肺转移。红点表示小鼠转移至肺以外的器官。右图,有代表性的肺切片染色。
(K)左图,皮下注射移植mTC和mTN细胞3周后出现淋巴结转移的NSG小鼠百分比(2.5×105个细胞/小鼠;n = 6)。右图,移植后3周后的肿瘤重量。
2. 抗氧化剂通过降低活性氧和游离血红素来稳定BACH1水平。

图2: 抗氧化剂通过降低游离血红素水平来稳定BACH1水平
△点击放大图片
(A)RNA-seq数据的维恩图显示了在mTN(抗氧化剂组)与mTC(对照组)细胞(蓝色)中差异表达的基因数量。小圆圈显示在其近端启动子中具有NRF2和BACH1结合基序的基因。
(B)对mTC和mTN细胞(n = 3)中BACH1和NRF2靶基因进行实时qPCR分析。首先将数据标准化为Rplp0表达,然后再标准化为mTC,取两次实验的平均值。
(C)TCGA数据的Kaplan-Meier图显示了高和低BACH1表达(Z评分= 2)的肺腺癌(LUAD)患者的生存率。
(D)ROS和血红素诱导的BACH1降解的示意图。
(E)左图,western blot显示了mTC和mTN细胞系(n = 3)中BACH1的稳态含量。右图,两次实验的BACH1蛋白条带的灰度值定量。ACTIN是内参。
(F)左图,western blot显示了用NAC或Trolox孵育mTC细胞(> 7天)后BACH1的变化。右图,三次实验BACH1蛋白条带的灰度值定量。ACTIN是内参。
(G)上图,H2O2(200 mM)处理mTC和mTN细胞24 h后的BACH1的蛋白质印迹图。下图,两次实验BACH1蛋白条带的灰度值定量。ACTIN是内参。
(H)用1mM NAC处理A549细胞2周后游离血红素的稳态水平。红条,阳性对照:200 mM H2O2处理细胞过夜以刺激游离血红素的释放。
(I)将1 mM NAC或100 mM Trolox处理A549细胞2周后,用pCDNA-HS1传感器测得的游离血红素水平。将细胞与5 mM二酰胺孵育48小时作为阳性对照。
(J)左图,Western blot显示与10 mM血红素孵育24小时后细胞中BACH1和ACTIN的量。右图,BACH1的灰度值定量。
(K)Western blot显示与10 mM血红素孵育的细胞中BACH1和ACTIN的量。在添加血红素之前,将细胞与10 mM MG132、1 mM硼替佐米或2 mM MLN4924孵育30分钟。
(L)Western blot显示与20 mg / mL环己酰亚胺(CHX)孵育的细胞中BACH1和ACTIN的量。在CHX处理之前,将细胞与10 mM MG132、1 mM硼替佐米或2 mM MLN4924孵育30分钟。
3. BACH1是抗氧化剂诱导转移所必需的,并且能够在缺乏抗氧化剂的情况下诱导转移。

图3: BACH1是抗氧化剂诱导的转移所必需的,并且可以在缺乏抗氧化剂的情况下诱导转移
△点击放大图片
(A)左图,与10 mM血红素孵育24小时的mTC和mTN细胞的Transwell迁移分析。右图,是迁移细胞的代表性照片。
(B)Western blot显示用CAS9和sgRNA靶向转染敲除mTC和mTN细胞中的BACH1后,BACH1的表达量;sgRNA靶向敲除dTomato(Tom)被用作对照。HISTONE 3(H3)是内参。
(C)左图,mTN-sgBach1,mTN-sgTom和对照mTC细胞的Transwell迁移分析(n = 2)。右图,是迁移细胞的代表性照片。
(D)左图,在静脉注射对照和缺乏Bach1的mTC和mTN细胞3周后,NSG受体小鼠肺肿瘤负荷情况。右图,代表肺切片染色。
(E)动物造模:气管内注射编码Cre重组酶,CAS9和gRNA sgTom或sgBach1的pSECC慢病毒。
(F)在气管内注射pSECC-sgTom或-sgBach1慢病毒后8个月,在KP小鼠中的肿瘤转移发生率;慢病毒感染后1周,应在日常饮食中服用维生素E(VitE,0.5 mg / kg)。
(G)CRISPR / sgBach1-SAM策略的示意图。sgRNA将CAS9-VP64融合靶向Bach1启动子,刺激内胚层基因的转录。
(H)左图,Western blot显示了SAM-sgBach1转导的mTC细胞中BACH1的量;对照细胞接受非靶向构建体(SAM-sgTom)。H3和ACTIN是内参。右图,在两次实验中灰度值分析BACH1的量。
(I)mTC-SAM-sgBach1和mTC-SAM-sgTom细胞的Transwell迁移。右图,迁移细胞的代表性照片。
(J)mTC-SAM-sgBach1和mTC-SAM-sgTom细胞的Transwell入侵检测。
(K)静脉注射3周后NSG小鼠的肺肿瘤负荷。注射mTC-SAM-sgTom,mTC-SAM-sgBach1和mTN细胞(0.5×105个细胞/小鼠;n =5-10)。
4. 编码糖酵解酶HK2和GAPDH的基因是BACH1的靶点。
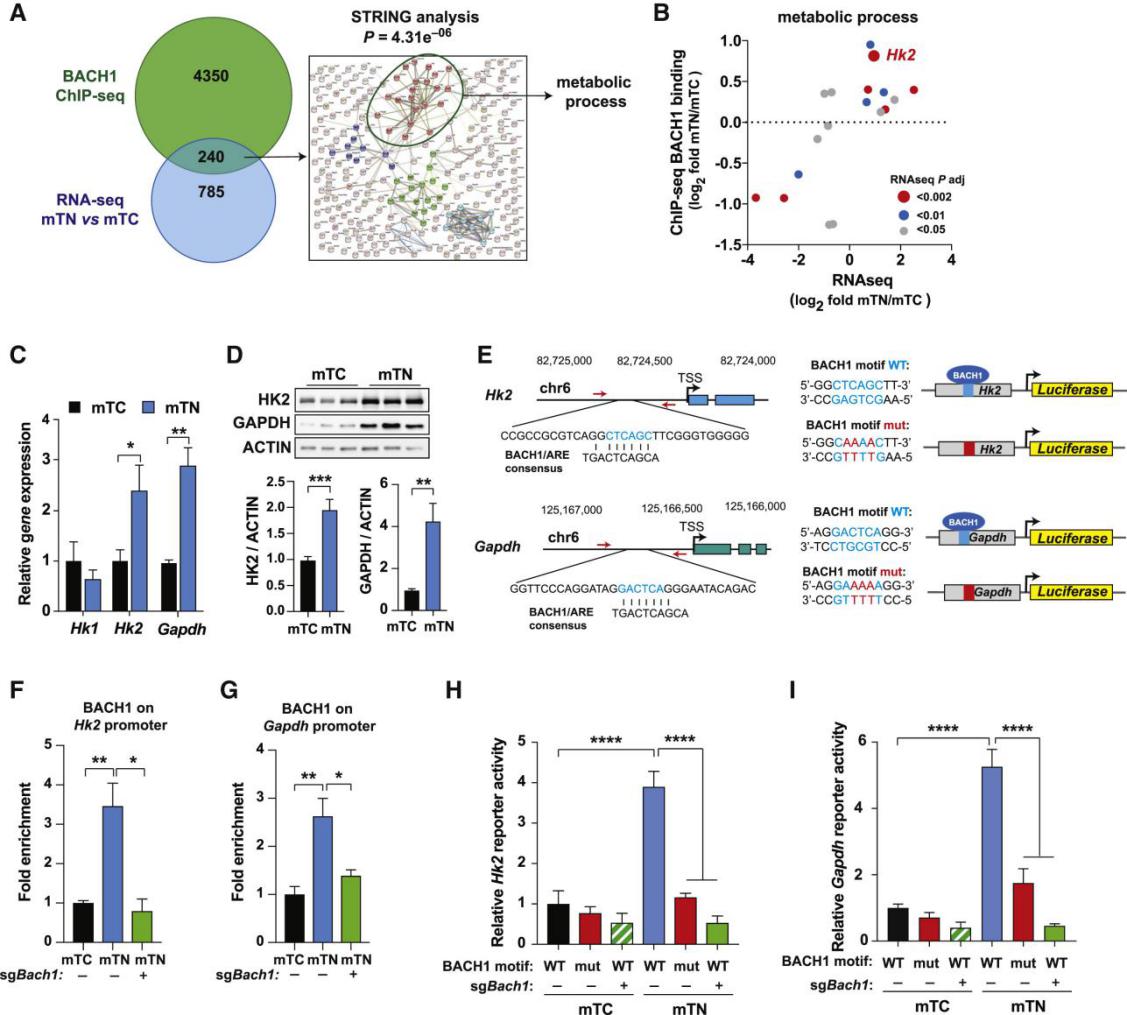
图4: 基因组占有率和转录组学分析相结合,将Hk2和Gadph鉴定为BACH1靶基因/span>
△点击放大图片
(A)左图,Venna图显示ChlP-seq分析(绿色)中BACH1结合的240个基因与RNA-seq分析中调控的基因(蓝色)重叠。右图,蛋白质-蛋白质相互作用(PPI)的STRING分析确定了240个基因中的三个簇.
(B)20个“代谢过程”基因图.
(C)mTC和mTN细胞(n=3)的RNA的qPCR分析。
(D)上图,WB显示了mTC和mTN细胞中HK2和GAPDH的量。下图,灰度值分析结果。
(E)图左侧,HK2和GAPDH转录起始位点(TSS)上游300bp的BACH1结合位点的鉴定。红色箭头显示用于Chlp-qPCR的引物。图右侧,将包含野生型BACH1基序(蓝色)或突变基序(红色)的400-500bp启动子序列克隆到pGL3荧光素酶报告载体中。
(F)HK2启动子区域中的BACH1富集(与对照lgG整合相比)。N=2。
(G)Gadph启动子区域中的BACH1富集(与lgG结合相比)。N=2值。
(H)报道的HK2启动子活性载体的荧光素酶活性(如E图所示),并转染到具有和不具有BACH1表达的mTC和mTN细胞中。
(I)报告GAPDH启动子活性载体的荧光素酶活性。
5. 抗氧化剂以依赖BACH1的方式刺激糖酵解。

图5: 抗氧化剂以依赖BACH1的方式刺激糖酵解
△点击放大图片
(A)由Seahorse分析判断,mTC和mTN细胞(n = 3)中的糖酵解速率,数据被标准化为mTC。
(B)基本OCR和ECAR的比率(n = 3)。
(C)葡萄糖摄取和乳酸分泌(n = 3)。
(D)热力图显示了RNA-seq分析中鉴定的糖酵解基因的转录水平。
(E)BACH1和HK2,PFKFB3和SLC16A1在人肺癌中的共表达(173个数据集)。数据来自SEEK共表达数据库。
(F)mTC-SAM-sgBach1和对照mTC-SAM-sgTom细胞的糖酵解速率。
(G)(F)中细胞的乳酸分泌。
(H)mTC细胞、对照(sgTom)和缺乏Bach1的mTN细胞的糖酵解速率(n = 2)。
(I)(H)中细胞对葡萄糖的摄取。
(J)(H)中细胞的丙酮酸水平。
(K)(H)中的细胞的乳酸分泌。
(L)5 μM NRF2激活肽KI-696(n = 2)孵育24小时的mTC和mTN细胞的糖酵解速率。
(M)由RNA中的qPCR确定的Hk2和Gapdh表达,分离自在TC-696中孵育24小时的mTC和mTC-sgBach1细胞。
(N)(M)中细胞对葡萄糖的摄取。
(O)(M)中细胞的乳酸分泌。
6. 糖酵解介导抗氧化剂和BACH1依赖以及非依赖的迁移和转移。
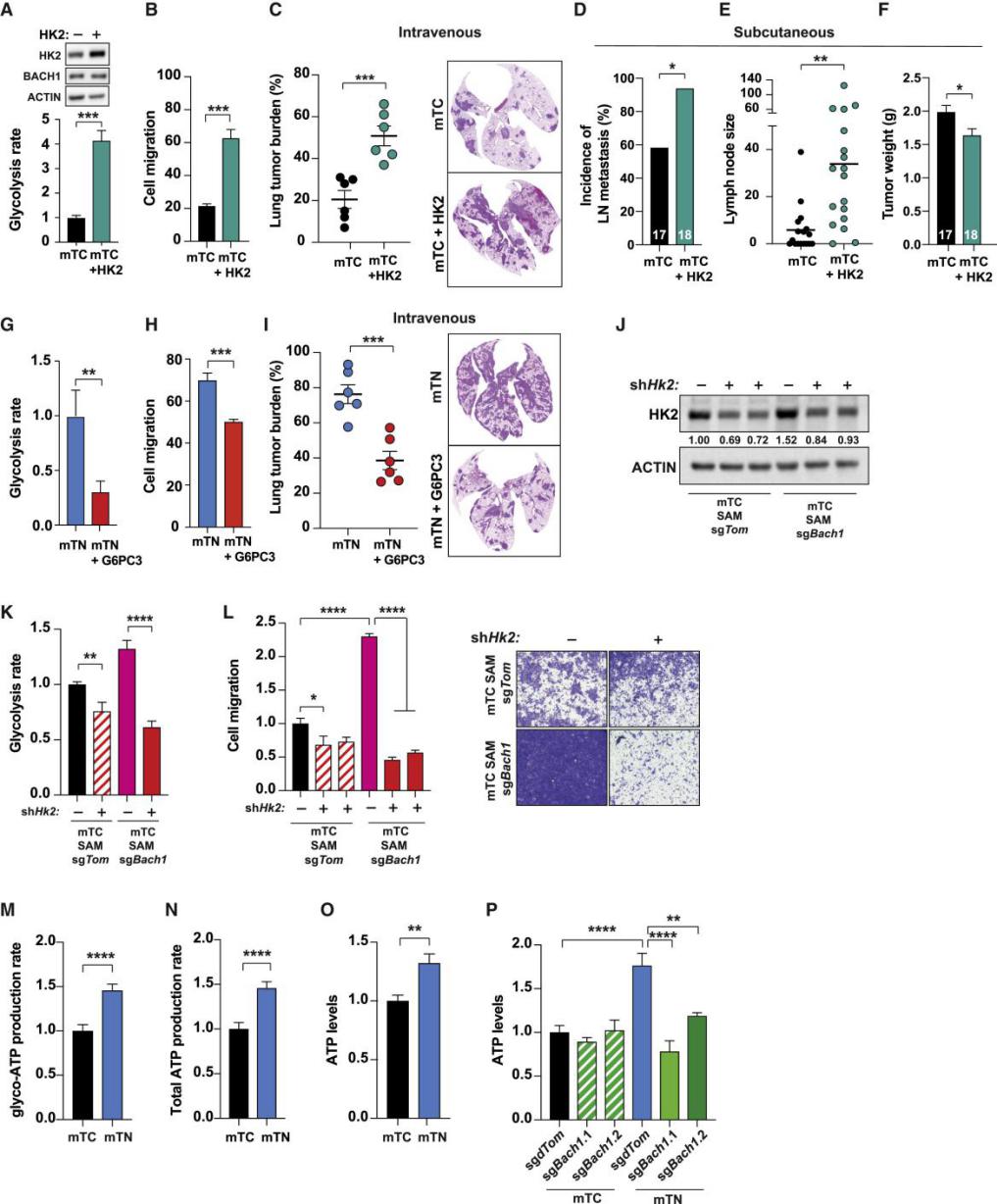
图6: HK2刺激的糖酵解介导抗氧化剂和BACH1诱导的转移和侵袭性表型。
△点击放大图片
(A)Western blot (顶部)显示了用对照质粒或编码人HK2的质粒转导的mTC细胞中HK2和BACH1的量及其糖酵解速率(底部)。
(B)(A)中所示的细胞迁移。
(C)静脉注射mTC和mTC-HK2细胞(0.5×105;n = 6只小鼠/细胞类型)3周后NSG小鼠的肺肿瘤负荷。
(D)皮下注射mTC和mTC-HK2细胞(0.5×105;n = 17和18只小鼠/细胞类型)5周后NSG受体小鼠淋巴结(LN)转移的发生率。。
(E)(D)中小鼠淋巴结转移的尺寸单位为mm3。
(F)(D)中小鼠皮下肿瘤的初级重量。
(G)对照质粒或G6PC3催化亚基编码的质粒转导的mTN细胞的糖酵解速率。
(H)(G)中的细胞迁移。
(I)静脉注射mTN和mTN-G6PC3细胞(0.5×105;n = 6只小鼠/细胞类型)3周后NSG小鼠的肺肿瘤负荷。
(J)Western blot显示逆转录病毒转导两种不同的Hk2 shRNA后,mTC-SAM-sgTom和mTC-SAM-sgBach1中HK2的水平。
(K)在(J)中细胞的糖酵解速率。
(L)左图,逆转录病毒转导Hk2 shRNA后,mTC-SAM-sgTom和mTC-SAM-sgBach1的Transwell迁移分析。右图,是迁移细胞的代表性照片。
(M)由Seahorse分析判断,mTC和mTN细胞中糖酵解衍生的ATP产生速率(n = 3)。
(N)由Seahorse分析判断,mTC和mTN细胞中的总ATP产生速率(n = 3)。
(O)mTC和mTN细胞中的稳态ATP水平(n = 3)。
(P)mTC和mTN细胞中有无BACH1表达的稳态ATP水平(n = 2)。
7. 靶向糖酵解可阻止抗氧化剂和BACH1诱导的转移。
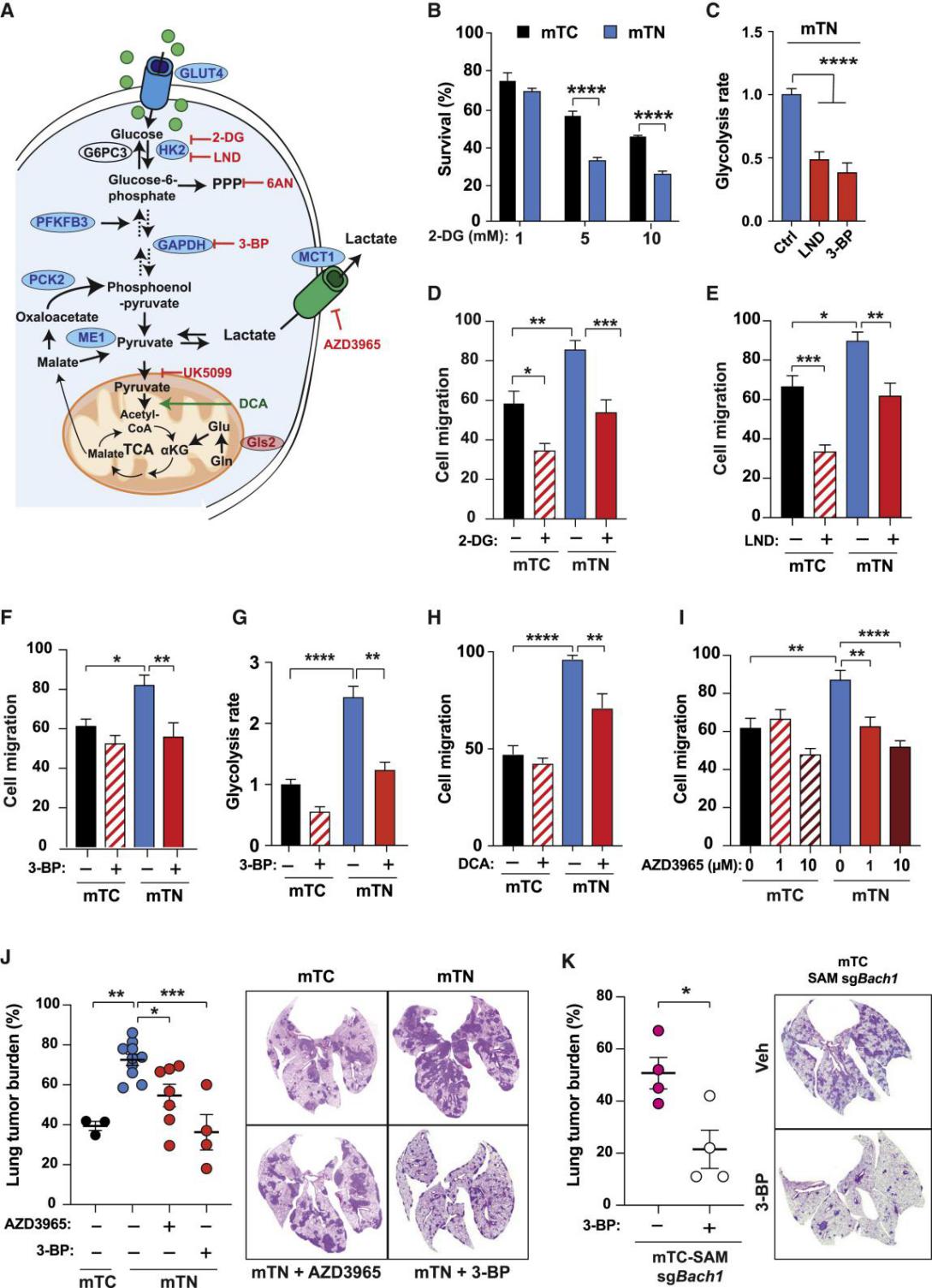
图7: 靶向糖酵解可抑制抗氧化剂和BACH1诱导的迁移和转移
△点击放大图片
(A)抑制剂(红色)和活化剂(绿色)的糖酵解示意图,用于定义酶促步骤在抗氧化剂增加细胞迁移能力中的作用。蓝色椭圆形,与mTC细胞相比,mTN细胞中蛋白质的基因增加。红色椭圆形,基因在mTN细胞中减少。
(B)经糖酵解抑制剂2-DG处理48小时后(n = 3)的mTC和mTN细胞存活率。数值代表未经处理的mTC细胞百分比。
(C)经50μM氯尼达明(LND,一种糖酵解抑制剂)和25μM 3-BP处理24小时后的mTN细胞(n = 3)糖酵解速率。
(D)经1 mM 2-DG处理mTC和mTN细胞(n = 3)的迁移分析。
(E)经50 mM LND处理的mTC和mTN细胞(n = 3)的迁移分析。
(F)经25μM糖酵解抑制剂3-溴丙酮酸盐(3-BP)处理的mTC和mTN细胞(n = 3)的迁移。
(G)经25 μM 3-BP处理24小时的mTC和mTN细胞(n = 3)的糖酵解速率。
(H)经10 mM丙酮酸脱氢酶激酶抑制剂二胆乙酸酯(DCA)处理的mTC和mTN细胞的迁移。
(I)经1mM和10 mM的乳酸分泌抑制剂AZD3965处理的细胞迁移。
(J)静脉注射mTC和mTN细胞(0.5×105;n = 3~9小鼠/条件)3周后NSG小鼠的肺肿瘤负荷。从细胞注射的第二天开始,给小鼠给药四次(1 次/天)AZD3965(100mg / kg,灌胃)或3-BP(10mg / kg,腹膜内)。
(K)静脉注射3周后NSG小鼠的肺肿瘤负荷。注射mTC-SAM-sgBach1细胞(0.5×105;n = 4只小鼠/条件)。从细胞注射后的第二天开始,给小鼠注射四次(1 /天)3-BP(10mg / kg,腹膜内)。
在(D)-(F),(H)和(I)中,y轴显示细胞迁移占细胞损伤修复的百分比。
在本研究中,高BACH1水平在低NRF2活性的情况下刺激转移,并且BACH1可以通过外源性和内源性抗氧化剂来稳定。重点是,作者发现BACH1在没有抗氧化剂的情况下是亲转移的。NRF2的激活,就像补充抗氧化剂一样,增加Hk2和Gapdh的转录,刺激糖酵解,并以BACH1依赖的方式增加幼稚肺癌细胞的迁移。 因此,含有NRF2/KEAP1突变的癌细胞的一个可能的优势是激活BACH1诱导的糖酵解。
本文用到的部分产品已为您总结好,拿走,不谢!
| 货号 | 品牌 | 产品名称 |
| 9005S | CST | CHIP Kit (Magnetic Beads) |
| 2867S | CST | Hexokinase II (C64G5) Rabbit mAb |
| 4578S | CST | BACH1/BRIP1 Antibody |
| 3700S | CST | β-Actin (8H10D10) Mouse mAb |
| 43966S | CST | HO-1 (E3F4S) Rabbit mAb |
| 4620S | CST | Histone H3 (D2B12) XP® Rabbit mAb |
| 13435S | CST | Lamin B1 (D9V6H) Rabbit mAb |
| 3187S | CST | NQO1 (A180) Mouse mAb |
| 12721S | CST | NRF2 (D1Z9C) XP® Rabbit mAb |
| 2947S | CST | p21 Waf1/Cip1 (12D1) Rabbit mAb |
| 2524S | CST | p53 (1C12) Mouse mAb |
| 8179S | CST | HMGA2 (D1A7) Rabbit mAb |
| 7074S | CST | Anti-rabbit IgG, HRP-linked Antibody |
| 7076S | CST | Anti-mouse IgG, HRP-linked Antibody |
| 2118S | CST | GAPDH (14C10) Rabbit mAb |
| 016-1R33 | Lonza | RAFT Transwell Absorbers for 24-Well |
| abs9217-100ml | absin | 苏木素-伊红(HE)染色试剂盒 |
| abs42016017 | absin | Cycloheximide |
| abs810671-5mg | absin | bortezomib |
| abs810671-100mg | absin | bortezomib |
| abs813391-50mg | absin | MLN4924 |
| abs813391-10mg | absin | MLN4924 |
| abs813391-5mg | absin | MLN4924 |
| M8699 | Cayman | (R)-MG132 |
| 74136 | QIAGEN | RNeasy Plus Mini kit |
| 208054 | QIAGEN | QuantiNova SYBR Green PCR Kit (500) |
| 334471-50ul | QIAGEN | Epitect Chip One day |
| 334471-100ul | QIAGEN | Epitect Chip One day |
| 1052127(-)01A | QIAGEN | EpiTect primers for Hk2 |
| 1052368(-)01A | QIAGEN | EpiTect primers for Gapdh |
| AF5777 | R&D | BACH1, Goat polyclonal (Chip-Seq) |
| AF5776 | R&D | BACH1, Goat polyclonal antibody (IF, 1/50) |
| RHS4080 | Dharmacon | pLKO-1 empty vector |
| TRCN0000012545 | Dharmacon | PLKO.1 Sh-Hk2#2 TRCN0000012545 |
| TRCN0000012548 | Dharmacon | PLKO.1 Sh-Hk2#5 TRCN0000012548 |
2. CELL: Nrf2激动剂通过抑制Bach1的降解促进肺癌的转移
纽约大学医学院Thales Papagiannakopoulos和 Michele Pagano团队团队

无独有偶,几乎在上篇文献发表的同时,来自纽约大学医学院的科学家团队也在Cell杂志发表文章,表明Nrf2能够通过抑制Bach1的降解导致肺癌的转移。有了上篇文章的基础,下面咱们简单介绍下该篇文章。
抗氧化基因的转录增加,一方面是通过获取更稳定的Nrf2突变体(Nrf2是细胞抗氧化程序的主要转录调控因子),另一方面是通过失活负调控因子。Keap1是一种依赖于Cul3的泛素连接酶(CRL3),在生理条件下,它起着降解Nrf2的功能。在氧化压力条件下,Keap1-Nrf2的结合受到抑制,Nrf2因此得以稳定。Keap1的突变和LUAD(肺腺癌)晚期转移和不良预后相关,表明Keap1的缺失可能在转移相关的级联反应中扮演重要角色。
研究人员在KP(KrasLSL-G12D/+; p53flox/flox)小鼠中敲低Keap1(KPK)发现实验结果与临床数据一致,Keap1敲低可导致细胞侵袭、转移增强,同时激活Bach1和血红素氧合酶-1(Ho1)的转录。Bach1是细胞内的血红素分子传感器,能够跟随着血红素水平的波动来调控基因转录。大多数的氧化应激都会引起血红素从血红蛋白中释放,导致更多的氧化应激,因为游离的血红素催化大量自由基产生,细胞通过多种机制避免游离血红素的促氧化作用,尤其是通过快速诱导Ho1分解游离血红素。
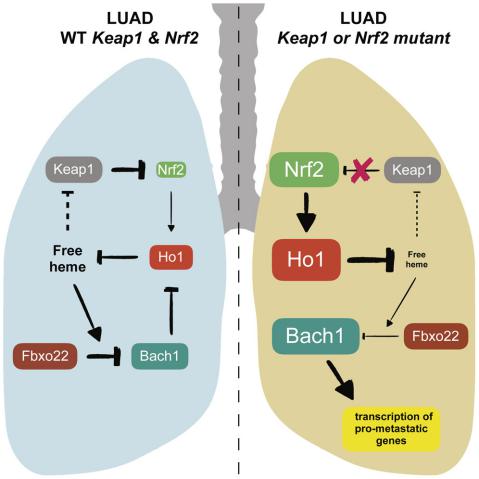
Bach1,Nrf2和Mafs转录因子,共同调控Ho1和其它抗氧化基因的表达。Bach1与Mafs形成异二聚体,诱导包括Ho1在内的抗氧化靶基因的转录激活,从而抑制Mafs的识别因子结合。在氧化压力下,Nrf2因为Keap1的失活而得以积累,而游离血红素的升高促进Bach1依赖于蛋白酶体降解。值得注意的是,除了在Maf-Nrf2通路中发挥作用外,Bach1还通过激活关键转移基因的转录促进肿瘤侵袭和转移。结果证实,Keap1缺失之后,是通过诱导Nrf2依赖的Ho1的表达来促进Bach1的积累(图1)。
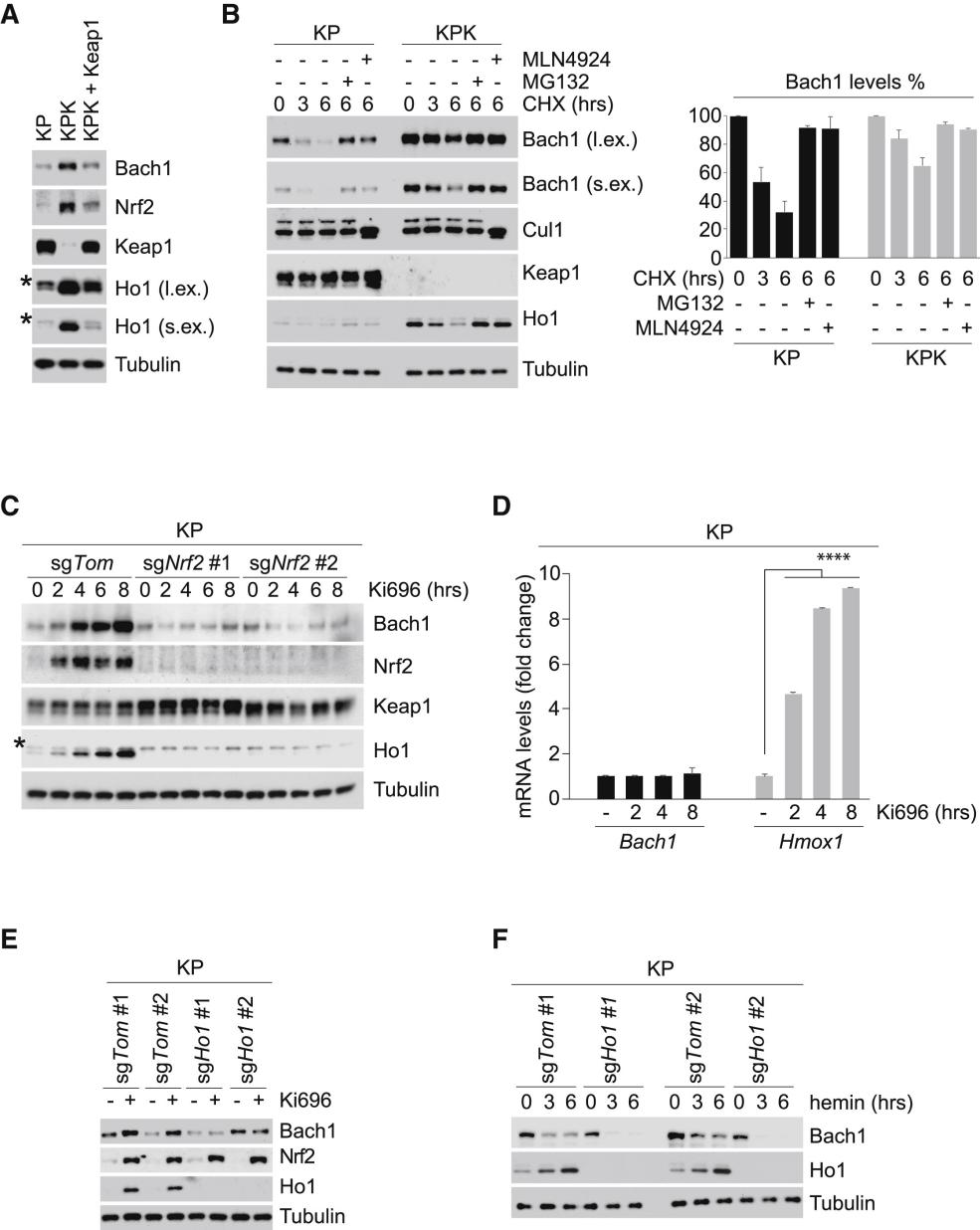
图1. Keap1的缺失通过诱导Nrf2依赖的Ho1表达来促进Bach1的积累
那么Bach1的降解具体是由哪一个分子介导的呢?作者通过Co-IP实验证实是Fbxo22和Bach1直接相互作用。Fbxo22是CRL1泛素连接酶复合物的一个底物受体。作者证实了它是参与血红素水平导致的Bach1清除的具体分子。作者进一步验证了Fbxo22缺失,会导致Bach1的转录程序并促进细胞迁移。而过表达Fbxo22或抑制Ho1则会阻止Bach1驱动的肺癌转移(图2)。
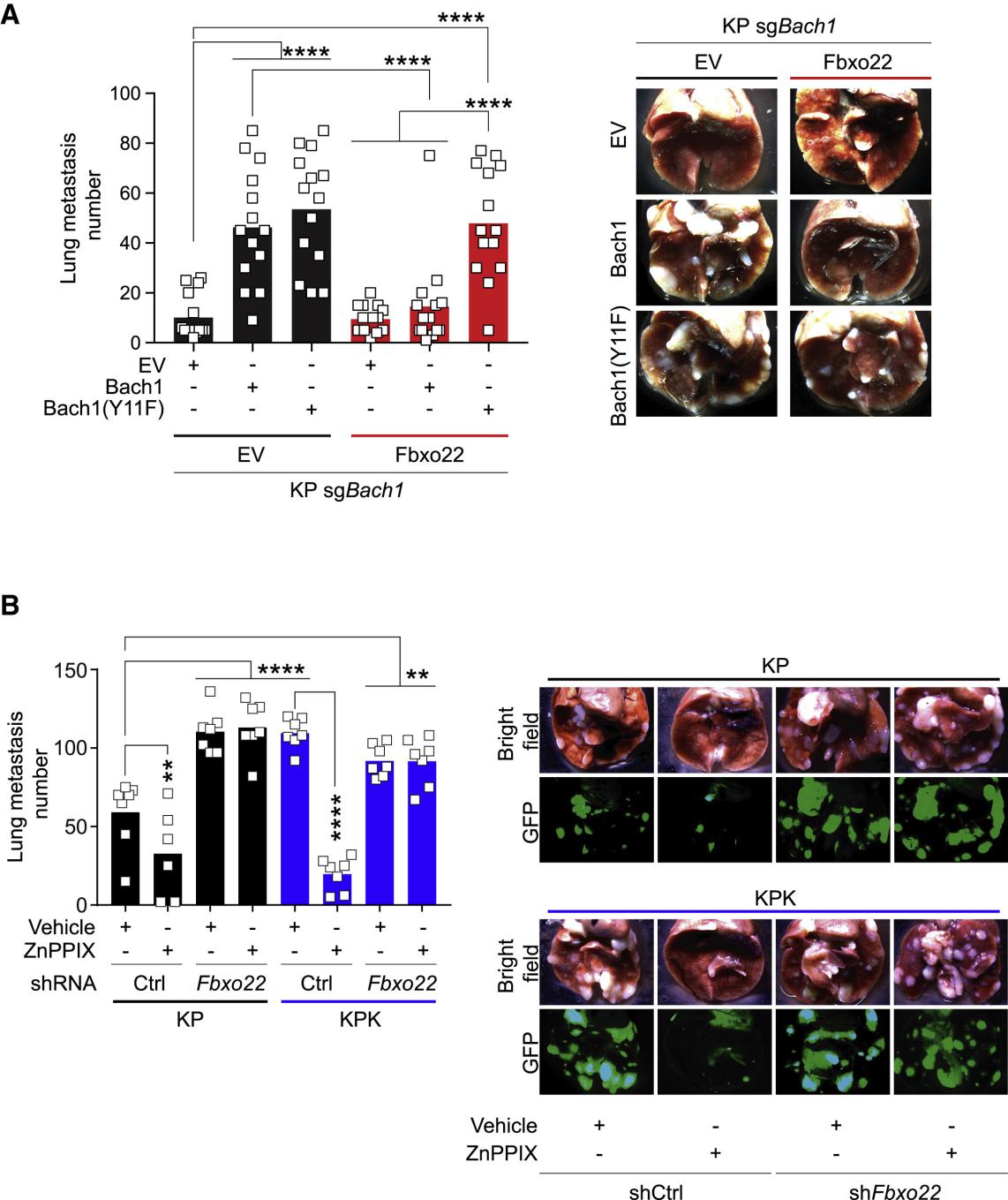
图2.过表达Fbxo22或抑制Ho1阻止Bach1驱动的肺癌转移
△点击放大图片
该篇文章表明,靶向血红素途径的药物,对Keap1-Nrf2途径发生改变的LUAD患者,尤其是对那些需要阻止肿瘤转移的患者来说,可能预示着一种新的治疗药物的出现。因此,Keap1突变型LUAD肿瘤中的这种机制的发现,可能为抑制肿瘤转移提供了新的治疗方案。
小编总结了本文用到的部分产品,请笑纳:
| 货号 | 品牌 | 产品名称 |
| 4578S | CST | BACH1/BRIP1 Antibody |
| 43966S | CST | HO-1 (E3F4S) Rabbit mAb |
| 12721S | CST | NRF2 (D1Z9C) XP® Rabbit mAb |
| 12248S | CST | Skp1 (D3J4N) Rabbit mAb |
| 8047S | CST | KEAP1 (D6B12) Rabbit mAb |
| 30253S | CST | PALB2 (E9R2W) Rabbit mAb |
| 2125S | CST | α-Tubulin (11H10) Rabbit mAb |
| 4995S | CST | CUL1 Antibody |
| 3724S | CST | HA-Tag (C29F4) Rabbit mAb |
| 3724T | CST | HA-Tag (C29F4) Rabbit mAb |
| 14793S | CST | DYKDDDDK Tag (D6W5B) Rabbit mAb (Anti-FLAG Antibody) |
| PA5-98782 | Thermo | FBXO22 Polyclonal Antibody |
| abs42016017 | absin | Cycloheximide |
| abs817331-100mg | absin | Doxycycline |
| abs817331-5mg | absin | Doxycycline |
| abs817331-50mg | absin | Doxycycline |
| abs817331-1g | absin | Doxycycline |
| abs813391-50mg | absin | MLN4924 |
| abs813391-10mg | absin | MLN4924 |
| abs813391-5mg | absin | MLN4924 |
| abs42025397-1ml | absin | Polybrene |
| abs42025969 | absin | Puromycin |
| L3000150 | Thermo | Lipofectamine 3000 |
| M8699 | Cayman | MG132 |
| 13778-500 | Thermo | RNAi |
| abs814596-500mg | absin | Hemin |
| abs814596-100mg | absin | Hemin |
| 747 | Tocris | Tin protoporphyrin IX vdichloride |
| 14483-10mg | Cayman | Zinc Protoporphyrin- |
| 14483-100mg | Cayman | Zinc Protoporphyrin- |
| 14483-25mg | Cayman | Zinc Protoporphyrin- |
| 14483-50mg | Cayman | Zinc Protoporphyrin- |
| abs821211-5mg | absin | Poly(ethylene |
| abs821211-1mg | absin | Poly(ethylene |
| abs44072598 | absin | Poly(ethylene |
| abs972-500ml | absin | 胎牛血清(优级) |
| abs972-125ml | absin | 胎牛血清(优级) |
| abs972-25ml | absin | 胎牛血清(优级) |
| 74136 | QIAGEN | RNeasy Plus Mini kit |
| 208054 | QIAGEN | QuantiNova SYBR Green PCR Kit (500) |
| 334471-50ul | QIAGEN | QuantiNova SYBR Green PCR Kit (500) |
| 334471-100ul | QIAGEN | QuantiNova SYBR Green PCR Kit (500) |
| D-001810-01-20 | Dharmacon | ON-TARGETplus Non-targeting Control siRNA #1 |
| abs955-50tests | absin | 免疫(共)沉淀(IP/CoIP)试剂盒 |
| abs9217-100ml | absin | 苏木素-伊红(HE)染色试剂盒 |
| 28104 | QIAGEN | QIAquick PCR Purification Kit |
| 28704 | QIAGEN | Gel extraction kit |
| 3422 | Corning | Transwell 6.5-mm, 8.0-mm-pore PC membrane |
| A-1-3 | GraphPad | GraphPad Prism 7 |