通过干扰人细胞中基因本身表达对于阐明基因功能至关重要,在发现新的可能的肿瘤治疗靶点方面具有很大的潜力。
今天我们一起来看下,如何利用CRISPR基因敲除的方法,寻找新的可能的肿瘤药物潜在治疗靶点。
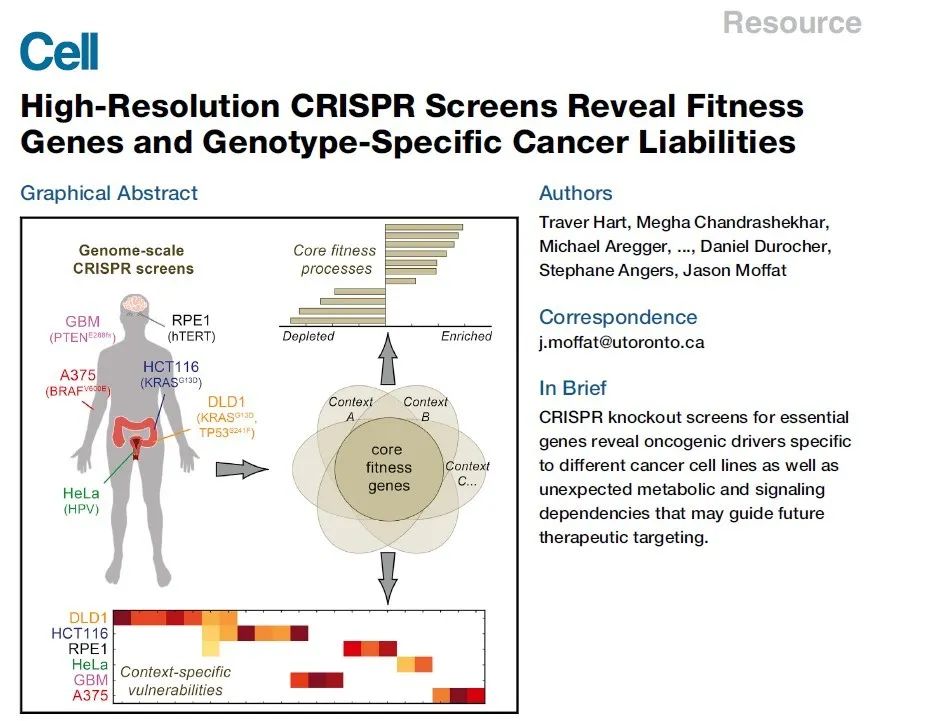
参考文献:Traver Hart, Megha Chandrashekhar.,et al. (2015). High-Resolution CRISPR Screens Reveal FitnessGenes and Genotype-Specific Cancer Liabilities. Cell. Volume 163, Issue 6, 3 December 2015, Pages 1515-1526
△点击放大图片
文章核心内容,利用CRISPR-Cas9技术,对全基因组范围基因同时敲除,筛选关键基因揭示在不同肿瘤细胞系重要的致癌驱动因子,依赖于新发现的代谢、信号传导途径,对未来治疗靶向性提供指导作用。
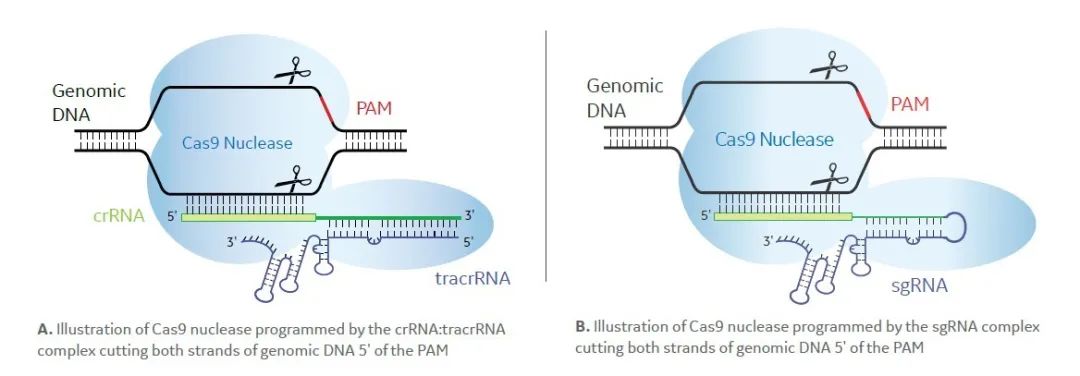
01 CRISPR Cas9基因敲除
CRISPR-Cas系统是细菌和古细菌在长期演化过程中形成的一种适应性免疫防御机制,可以识别并沉默入侵的病毒及外源DNA。Cas9核酸内切酶在crRNA的介导下对基因组DNA进行剪切;然后,DNA的DSB会被细胞内天然的DNA修复系统进行修复,基因失活,从而达到基因敲除的目的。
△点击放大图片
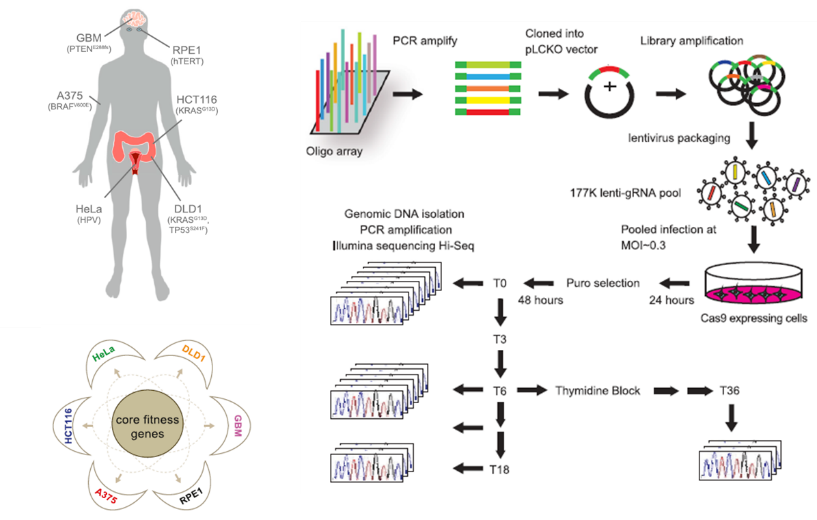
02 CRISPR Cas9筛选核心关键基因
实验设计两套CRISPR Cas9文库,一套相对严苛的序列设计及选取原则,另一套相对放宽的设计原则,均涵盖全基因组范围17232个基因,不同条数的引导RNA(guide RNA)。同时选取6种肿瘤细胞系作为筛选模型(GBM、RPE1、HCT116、DLD1、Hela、A375),利用两套文库对全基因组范围的基因敲除,筛选出分别对6种细胞系生长影响的关键基因(fitness gene),当这类基因被敲除失去活性,细胞则无法正常繁殖生长。
△点击放大图片
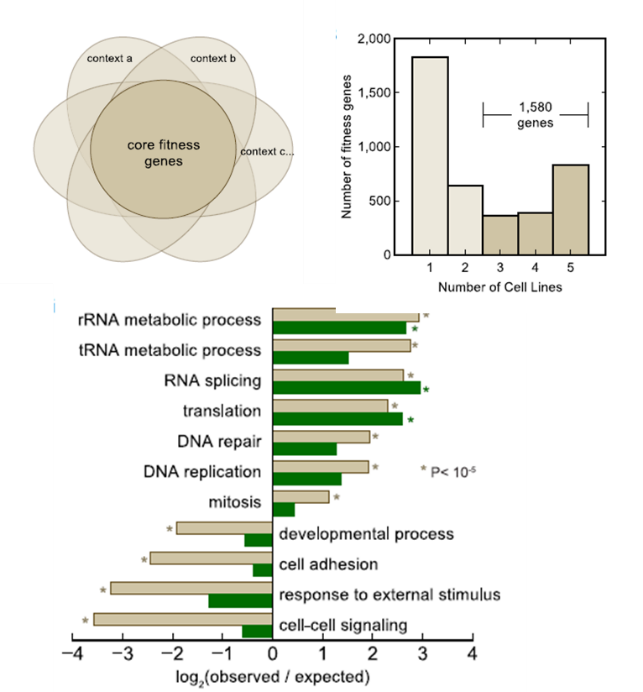
将实验中6种肿瘤细胞系的关键基因(fitness gene)组合起来形成雏菊结构,被三种或三种以上细胞同时有的关键基因即为核心关键基因(core fitness gene),通过CRISPR Cas9文库筛选得到共计1580个核心关键基因,并进行Gene Ontology分析,发现它们大量集中在DNA转录、翻译、复制、修复方面,并且集中度比其他功能高4倍以上,与细胞生长密切相关。而在细胞与细胞之间的信号交流、器官发育、细胞粘附等方面,Gene Ontology分析结果中表明,核心关键基因集中度比其他普通基因少4倍以上。
△点击放大图片
03 可能治疗肿瘤的潜在靶点
通过前阶段利用CRISPR Cas9全基因组敲除筛选出几种肿瘤细胞的核心关键基因,为鉴定合成致死靶点奠定重要基础,其帮助阐明信号通路和生物学过程的背景特异性及依赖性,帮助提供肿瘤治疗靶标的重要参考。
在本篇文章中,作者也提出几个实验数据参考及观点,以提供可能治疗肿瘤的潜在靶点发现。
KRAS G13D突变的肿瘤细胞DLD1,对EGFR抑制剂敏感
在此之前观点,KRAS G13D突变的发生会使KRAS基因达到一个持续活化的状态,上游EGFR无法影响突变的KRAS基因。但是该实验中发现,含有KRAS G13D突变的DLD1细胞对EGFR的敲除非常敏感。进一步分析发现,敲除EGFR传递信号到KRAS过程中所经过的其他基因(SHC1/GRB2/SOS1),DLD1细胞同样很敏感。并用EGFR抑制剂Erlotinib同时处理6种肿瘤细胞,发现Erlotinib抑制DLD1的生长,对其他细胞生长无影响。而这种有选择的抑制肿瘤细胞对其他细胞无影响,也正是选择肿瘤药物的重要标准之一。
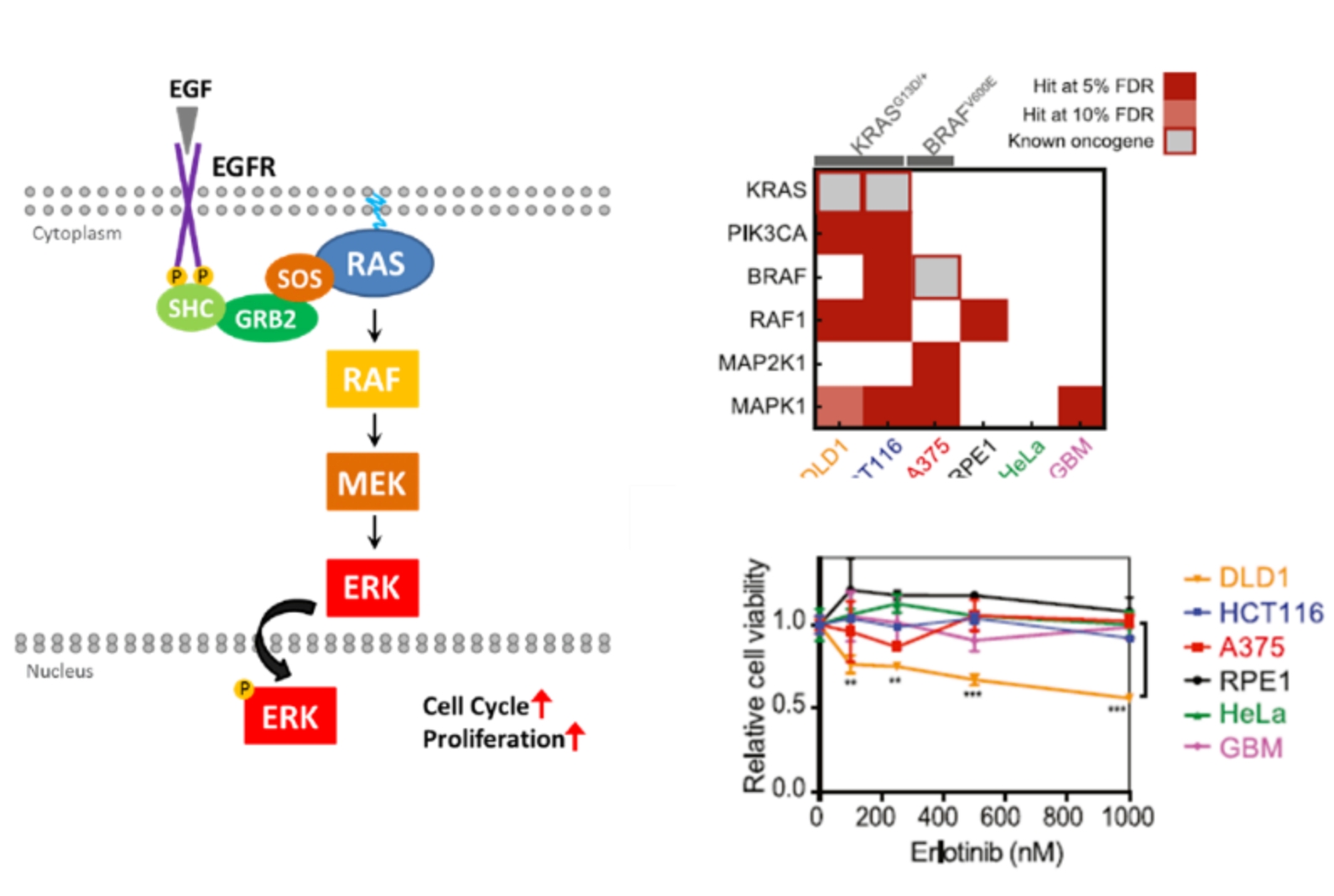
△点击放大图片
相比之下,同样是有KRAS G13D突变的另一个结肠癌细胞系HCT116,对EGFR的敲除和EGFR抑制剂Erlotinib的处理都不敏感。
通过基因敲除方法,阐明肿瘤细胞对EGFR活性的依赖性,那么EGFR抑制剂可适用于部分KRAS突变的肿瘤,这也是该篇文章提示的第一个可能的肿瘤药物新的适应症。
同样文章通过在细胞水平光谱的敲除基因,以此结果的理论基础,同时用相应抑制剂或合成抗体处理6种肿瘤细胞,根据不同处理条件及细胞对其敏感性,发现新的可能的肿瘤治疗途径和新的治疗药物,极大拓展了药物可选范围。
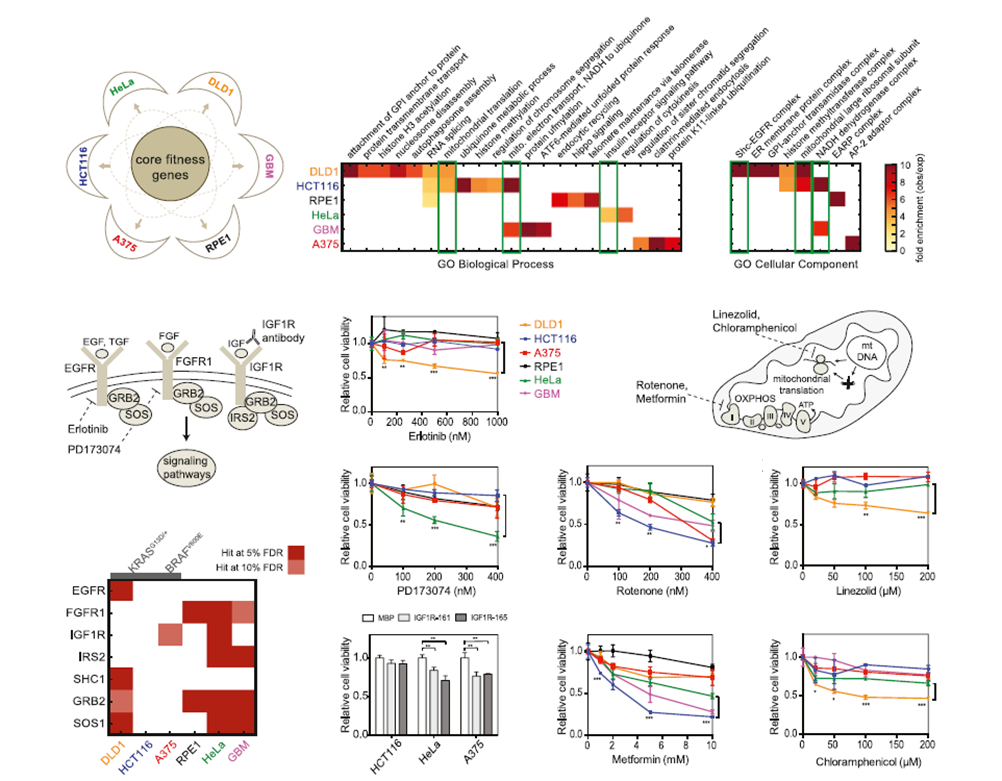
△点击放大图片
04 horizon discovery针对基因编辑在肿瘤治疗领域完整解决方案
CRISPR Cas9作为新兴高效基因编辑技术,包括在基因机制功能、建立肿瘤模型、筛选肿瘤表型相关基因及基因治疗等多方面应用研究。horizon discovery拥有10余年基因编辑技术经验,提供包括基因组编辑及筛选、基因编辑肿瘤细胞和分子诊断肿瘤参考标准品等完整解决方案。
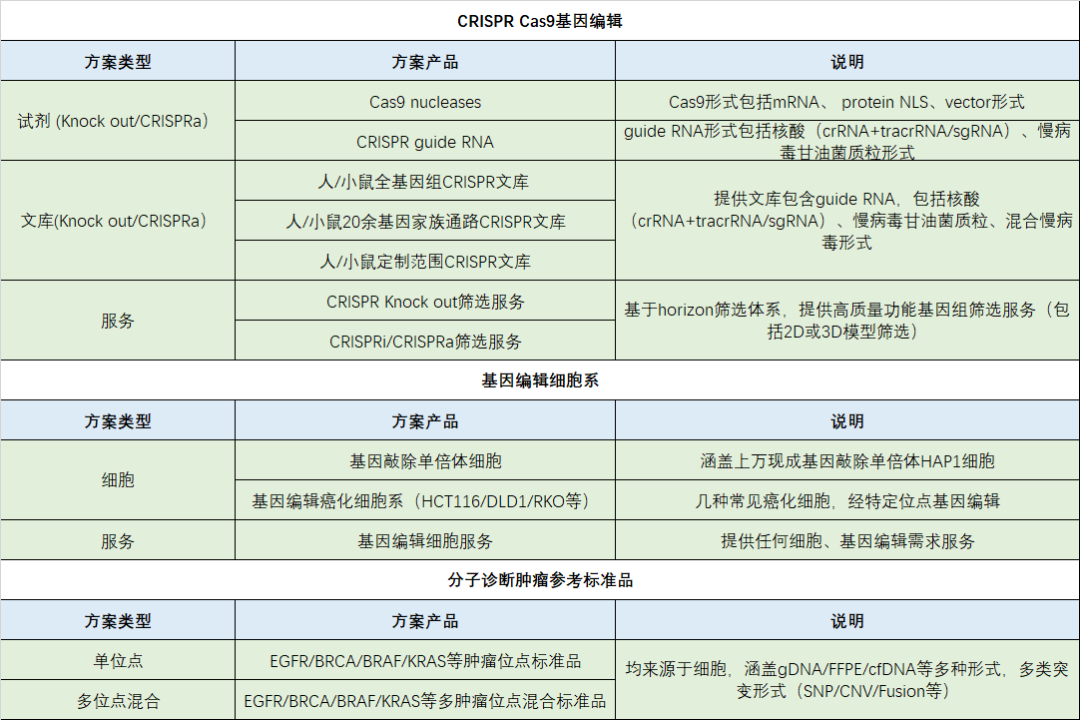
△点击放大图片




