蛋白纯化是生物研究中非常常用的技术。要研究蛋白质,首先要得到高纯度的,具有生物活性且相对稳定的目的蛋白。而蛋白质在组织或者细胞中一般都是以复杂的混合物形式存在,不同类型的细胞中含有不同结构和功能的蛋白质,因此,蛋白纯化就显得尤为重要。
都2020年啦,研究蛋白你还是仅仅停留在WB,IF和IHC么?近期的热点KRAS已经和蛋白纯化技术结合成功登上Nature期刊。纽约大学医学院 Mark R.Philips教授团队近期于2019年12月11日发表在Nature上的文章KRAS4A directly regulates hexokinase 1中,作者用亲和纯化的方法发现突变活化的KRAS4A与HK1具有特异的相互作用。
在蛋白研究的课题中加入蛋白纯化,进一步研究蛋白的结构,结构域间的相互作用,蛋白间的相互作用,酶活检测,小分子药物筛选,都会给文章增色不少,使其更具说服力。

△点击放大图片
蛋白纯化并没有想象的这么复杂,下面就跟着小优一起来了解一下实验中最常用的His标签蛋白纯化吧。
01 流程篇
His纯化主要分为以下步骤:构建重组质粒——重组蛋白的表达——重组蛋白的纯化。

△点击放大图片
构建重组质粒
在NCBI上查找目的基因的序列,从cDNA中用Pfu酶把目的序列进行PCR扩增。在设计引物时加上酶切位点。然后把扩增后的目的基因片段和载体用限制性内切酶酶切后进行连接。连接产物转移到大肠杆菌感受态细胞E. coli BL21中,涂板并过夜培养。挑出菌落进行菌落PCR验证和测序。
重组蛋白表达
将筛选出的阳性菌落进行培养,37℃在LB培养基中培养至菌液在波长A600nm时的吸光值为0.6-0.8(3-5h)。加入终浓度为0.5mM IPTG进行诱导表达,在16℃继续培养24h。
重组蛋白纯化
根据纯度的需要可以选择2步或者3步纯化方案。2步纯化为亲和+分子筛;3步纯化为亲和+离子+分子筛

△点击放大图片
02 技术篇
HisTrap HP预装柱使用说明
结合缓冲液:20mM磷酸钠,0.5M氯化钠,20-40mM咪唑,PH7.4
洗脱缓冲液:20mM磷酸钠,0.5M氯化钠,500mM咪唑,PH7.4
缓冲液需要预先过滤和超声去除气泡
1. 将注射器或者仪器管道装满蒸馏水。移除预装柱顶部的堵头,把柱子连接到注射器或者蠕动泵或者纯化仪的接头上(注意要液滴对液滴进行连接,防止引入气泡)
2. 去除柱子底部的堵头
3. 用3-5柱体积的蒸馏水水洗去乙醇
4. 用5柱体积的结合缓冲液平衡柱子,建议流速是1ml/min(1ml体积柱子)和5ml/min(5ml体积柱子)
5. 用注射器或者蠕动泵加入预处理的样品(样品在上柱前一定要进行离心和过滤),在上样时建议流速为0.2-1ml/min(1ml体积柱子)和0.5-5ml/min(5ml体积柱子)
6. 用结合缓冲液洗涤至少10到15个柱体积,直到吸收峰达到稳定基线或在流出物中没有物质流出。洗涤过程中建议保持流速为1-2ml/min(1ml柱子)和5-10ml/min(5ml柱子)
7. 用洗脱缓冲液采用一步洗脱或者线性梯度洗脱。一步洗脱通常5柱体积,线性洗脱通常10-20个柱体积。在洗脱过程中保持流速为1-2ml/min(1ml体积柱子)和5-10ml/min(5ml体积柱子)
8. 洗脱后,用3-5柱体积的结合缓冲液洗涤柱子,然后加入20%乙醇。拧上柱子上下的堵头
Note:如果需要去除咪唑,建议使用HiTrap Desalting脱盐柱(货号29048684,17140801)或者PD-10 Dealting脱盐柱(货号17085101)。
Ni Sepharose 6 FF装重力柱使用说明
结合缓冲液:20mM磷酸钠,0.5M氯化钠,20-40mM咪唑,PH7.4
洗脱缓冲液:20mM磷酸钠,0.5M氯化钠,500mM咪唑,PH7.4
缓冲液需要预先过滤和超声去除气泡
PD-10空柱准备
货号:17043501
1. 用20%的乙醇洗涤滤膜
2. 用蒸馏水润洗滤膜
3. 将滤膜放入PD-10空柱
填料准备
1. 轻柔震荡瓶子,直到填料悬浊液均一
2. 将需要量的填料悬浊液从瓶中转移到离心管中
3. 用500xg离心5min以沉淀填料
4. 除去上清,加入适量蒸馏水
5. 轻柔的振荡填料悬浊液3min,用500xg离心5min
6. 除去上清,加入适量结合缓冲液,重复步骤5
7. 把填料悬浊液转移到量筒中
8. 加入适量体积的结合缓冲液,使悬浊液中的填料浓度达到50%
重力柱纯化
1. 将样品加入含有50%填料的悬浊液中(样品在上柱前要进行离心和过滤)。Ni Sepharose 6 FF的载量平均是40mg/ml。则1ml的50%悬浊液的载量为大约20mg蛋白
2. 将样品和填料混合物在摇床上低速混合1h
3. 将样品和填料混合物加入到PD-10的空柱中,收集流出物
4. 用结合缓冲液洗涤2-5个柱体积,收集流出物
5. 用4倍柱体积的洗脱缓冲液洗脱,收集流出物
Ni柱的使用与保养
1. 对于一般的预装柱(Crude系列除外),上样前样品需要使用0.22μm/0.45μm滤膜进行过滤和离心处理,以避免样品中有细胞碎片等固体物质,堵塞柱子
2. 如果细胞裂解后非常粘稠,需考虑是否因为DNA、RNA这类核酸物质过多,需要加入核酸酶去除,以降低样品粘稠度,提高上样速度及洗脱效果
3. 柱子使用过程中,不能超过填料的压力,以免填料被压塌
4. 每次使用后,可使用5-10倍柱体积的纯水或者结合缓冲溶液对柱子进行清洗。(如果出现载量严重下降或者压力增加,需考虑彻底清洗)
CIP(彻底清洗)
GE的纯化柱是可以重复使用的,通常情况下不用每次使用都进行CIP。常规柱子(除了Ni excel)如出现反压严重升高或者柱子明显颜色改变,说明柱子需要进行彻底的清洗。
脱镍
1. 脱镍缓冲液:20mM 磷酸钠缓冲液,0.5M
2. 使用5-10个柱体积的脱镍缓冲液冲洗柱子
3. 使用5-10个柱体积的结合缓冲液冲洗柱子
4. 使用5-10个柱体积的蒸馏水冲洗柱子
去除蛋白
去除沉淀蛋白、疏水性蛋白及脂蛋白:将柱子置换到1M NaOH中,室温1-2小时(若需要去除内毒素可延长至12小时),再用5-10个体积去离子水冲洗
去除强离子吸附蛋白:使用1.5M NaCl洗柱子,约10-15分钟,然后用大约10个体积去离子水冲洗
挂镍
加入0.5ml(1ml柱子)或者2.5ml(5ml柱子)0.1M的NiSO4,使用5个柱体积的去离子水冲洗,再用缓冲液冲洗5个柱体积,最后置换到20%乙醇中保存
03 问题篇
Q1:裂解液的粘性较高
A1:
如果裂解液因为宿主核酸浓度高而粘性较高,可以连续超声直到粘性降低,或者加入5 μg/ml的DNase I,1mM的Mg离子,在冰上孵育10-15 min。
Q2:洗脱液中未检测到His标签目的蛋白
A2:
1. 洗脱的条件太温和:逐渐增加咪唑的浓度或进行咪唑浓度线性洗脱,或者降低PH去确定最佳洗脱条件。注:PH低于3.5容易导致镍离子脱落
2. 蛋白在柱子中沉淀:降低蛋白浓度,用咪唑线性洗脱。使用添加剂或者改变NaCl的浓度,或者在变性的条件下洗脱(加4-8M的尿素或者4-6M的盐酸胍)
3. 非特异性的疏水或者其他作用:在洗脱液中加非离子的添加剂(例如0.2%的Triton X-100)或者增加NaCl的浓度
4. 在样本或者binding buffer中咪唑的浓度太高:蛋白可能会在流穿液中被发现,降低咪唑的浓度
5. His标签没有充分暴露:蛋白可能会在流穿液中被发现,适当加入尿素或者盐酸胍
6. 缓冲液或者样品的成分不合适:确定缓冲液或者样品中的添加剂的成分和浓度,不能超过柱子的耐受性
Q3:洗脱的蛋白不纯
A3:
1. 目的蛋白被蛋白酶部分降解:增加蛋白酶抑制剂。
2. 污染物对镍离子有高度亲和性:用一个梯度的或者线性的咪唑浓度进行洗脱,确定一个适合的咪唑浓度。在样品中加入和binding buffer中同样的咪唑浓度。如果还是不能去除污染物,尝试使用离子交换层析或者分子筛进行进一步纯化。
3. 污染物和目的蛋白有相互作用:在洗脱液中增加添加剂的浓度(如增加到2% Triton X-100或者2% Tween 20),或者增加甘油(增加至50%)来破坏非特异性结合。
Q4:目的蛋白在洗脱之前出现
A4:
1. 缓冲液或者样品的成分不合适:检查缓冲液中的添加剂的浓度,不宜含有较高的金属离子螯合剂,强还原剂和咪唑的浓度。同时优化缓冲液的PH,盐离子浓度,添加剂(如5%甘油,1mM DTT等)
2. His标签被部分阻碍:在变性的条件下洗脱(使用4-8M的尿素或者4-6M的盐酸胍),或者改变His标签的位置或增加组氨酸数目。
3. 样品超过了柱子的载量:可以把几个HisTrap柱串联使用。
4. 超声功率不对:改变超声功率,同时可以在超声前加入溶菌酶。
04 产品篇
His纯化产品这么多,傻傻分不清。别着急,小优帮您整理啦。
His纯化柱类型

△点击放大图片
His纯化柱产品选择
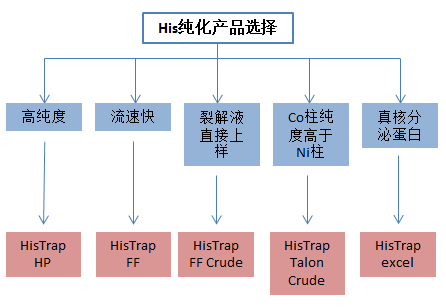
△点击放大图片
His纯化产品总览

△点击放大图片