癌症是严重威胁人类健康的疾病之一,而众所周知,T细胞在杀伤癌细胞中起着关键作用,而癌细胞通过PD-L1表现出免疫逃逸,在肿瘤免疫中,免疫检查点PD1及其配体PDL1作为协同物,帮助肿瘤抵抗免疫诱导的细胞凋亡,促进肿瘤进展。针对PD1/PDL1的免疫治疗可有效阻断其促肿瘤活性。Anti-PD1/PDL1治疗在过去的十年中取得了巨大的成功,是目前研究最多,临床发展最快的一种免疫疗法。
研究发现肿瘤患者T细胞耗竭的研究,主要集中在CD8 T细胞,认为T细胞衰竭是肿瘤特异性和对ICB反应的标志。但与CD8细胞毒性T淋巴细胞耗竭相反,CD4 T细胞耗竭仍然不被重视。那么,CD4 T细胞在PD1阻断及整个肿瘤免疫过程中又在发挥何种功能呢?接下来的两篇文章跟大家一起看看。
01 PD-1对肿瘤浸润淋巴细胞活性的影响


△点击放大图片
肿瘤抗原特异性CD4 T细胞在肿瘤部位聚集,提示其参与原位抗肿瘤效应功能。在这篇文章中,作者使用表型、转录组和功能方法,对头颈癌、宫颈癌和卵巢癌患者的CD4 T细胞衰竭进行了表征研究。研究发现一个CD4肿瘤浸润淋巴细胞(TIL)群体,由高表达的PD-1和CD39定义,其中包含高比例的细胞因子产生细胞,尽管这些细胞产生的细胞因子的数量很低,但是容易引起耗竭状态。与TIM-3的表达无关,CD4 TILs的末端衰竭被证实,提示CD8 T细胞衰竭引起分化。scRNA-Seq和进一步的表型分析揭示了其与CD8 T细胞耗竭程序的相似性。其中PD-1hiCD39+CD4 TILs表达耗竭转录因子TOX和趋化因子CXCL13,具有肿瘤抗原特异性。在体外实验中,PD-1阻断后CD4 TIL活化增强,CD154表达和细胞因子分泌增加,促进树突状细胞成熟,从而提高肿瘤特异性CD8 T细胞增殖。研究结果表明,耗竭的CD4 TILs是免疫检查点封锁反应的参与者。
接下来,跟着小优一起看看具体的研究思路吧。
首先,作者先将发现的CD4 TILs进行表型分析将其定义为PD-1hiCD39+ CD4 TILs。
(1)耗竭的CD4 TIL群体的定义

图2 CD4+ Tconv TILs 中CD39表达情况
△点击放大图片
将CD4+ and CD8+ TIL细胞体外染色并流式检测。平均37.9%的CD4 Tconv TILs表达CD39;所有CD39+细胞均高表达PD-1 (PD-1hi);CD39的表达与PD-1呈正相关(图2A)。由于PD-1高表达与耗竭相关,我们分析了PD-1neg、PD-1int和PD-1hi CD4 Tconv TIL中免疫检查点(ICs)(包括CD39)的表达(图2B)。PD-1hi群体中ICs的表达比例最高。大多数PD-1hi细胞表达TIGIT, CTLA-4, CD39,而TIM-3+细胞的比例较低(图2C和D)。我们将CD8和CD4 Tconv TIL比较,在PD-1hi细胞中,CD39 细胞和TIM-3均表达。在PD-1hi CD4 Tconv组分中,CD39可单独或与TIM-3联合表达,而仅表达TIM-3的细胞很少被检测到(图2E)。相比之下,在CD8 PD-1hi细胞中,CD39和TIM-3系统性共表达(图2E)。
结论1:这些数据表明CD39和TIM-3在CD4和CD8 TILs之间的表达存在差异,提示CD39的表达可以识别耗竭的CD4 TILs,而不是TIM-3的表达。将这一细胞群定义为PD-1hiCD39+ CD4 TILs。
明确表型之后,作者进行scRNA-Seq来研究CD39+ CD4 TIL中的耗竭、肿瘤驻留和晚期分化特征。
(2)scRNA-Seq揭示CD39+ CD4 til中的衰竭、肿瘤驻留和晚期分化特征

图3 PD-1hiCD39 +CD4 Tconv TILs功能衰竭
△点击放大图片
为了探讨CD39的表达在CD4 Tconv TILs中的功能影响,我们用PMA和离子霉素刺激CD4 TILs,并根据Tconv TIL亚群中IFN-γ和TNF-α的产生来评估PD-1和CD39表达,即PD-1–CD39–, PD-1loCD39–, PD-1hiCD39–和PD-1hiCD39+(图3A)。在PD-1hi细胞群中,CD39细胞含有高比例的多功能IFN-γ+TNF-α+细胞。它们在CD39+细胞中的比例较低,有利于IFN-γ单阳性细胞,表明末端衰竭(图3A)。对IFN-γ+和TNF+群体的分析表明,PD-1hiCD39+细胞中各自的MFI均低于其他所有群体(图3B),这表明这些细胞产生的细胞因子数量更少。根据PD-1hiCD39+细胞中TIM-3的表达情况,PD-1hiCD39+细胞及其MFI没有发生变化(图3,A和B)。与其他亚群相比,体外扩增的PD-1hiCD39+培养液在再刺激后产生的细胞因子量更低(图3C)。综上所述,这些结果表明CD39而不是TIM-3是CD4 Tconv TILs末端衰竭的标志。与这一假设一致,PD-1hiCD39+ CD4 Tconv TILs中CD8 T细胞衰竭转录因子TOX的表达最高(图3D)。
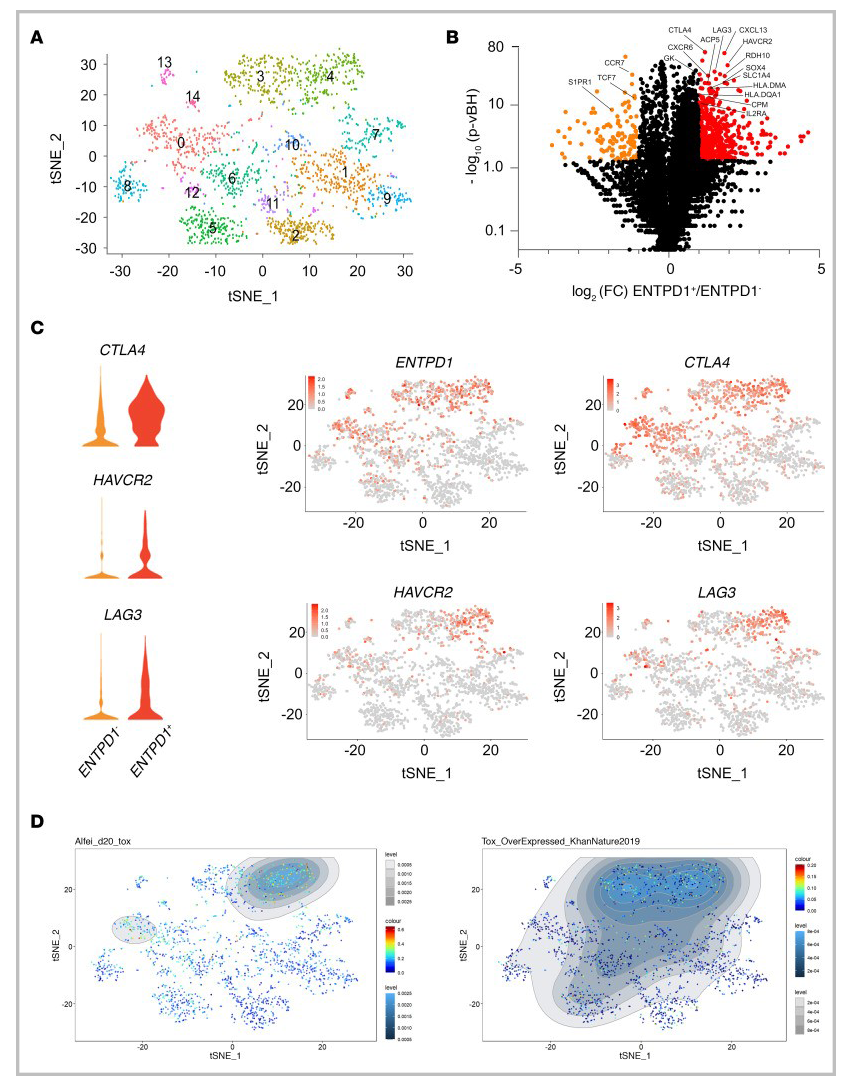
图4 CD4 TconvsTIL的scRNA-Seq
△点击放大图片
将从4个头颈部肿瘤标本中分离的CD45+细胞进行了scRNA-Seq检测。结果表明:CD4 T细胞聚类鉴定出15个聚类(图4A)。在CD4 Tconv中,ENTPD1+ (CD39)和ENTPD1-之间的差异mRNA表达分析鉴定出291个差异表达基因(图4B)。在ICs中,CTLA4、HAVCR2和LAG3在ENTPD1+细胞中上调(图4C)。CTLA4与ENTPD1在同一簇中表达,而HAVCR2 (TIM-3)仅在ENTPD1+细胞的亚群中表达(图4C),印证流式数据结果,在与HAVCR2相同的簇中检测到LAG3的表达(图4C)。最后,与PD-1hiCD39+ CD4 TILs中TOX的表达一致(图3D),由Alfei等人和Khan等人在T细胞与TOX编码的逆转录病毒转导后鉴定可知, ENTPD1+群过表达TOX转录组特征(图4D)。
结论:经高表达PD-1和CD39定义的耗竭的CD4 TIL具有相同的CD8 T细胞耗竭程序特征。值得注意的是,与之前的报道一致,CD39或ICs和CD73在人类CD4 T细胞中的表达没有重叠,我们在Tconv TILs中没有检测到NT5E (CD73)的表达。
(3)PD-1hiCD39+ CD4 Tconv TILs包含肿瘤特异性细胞(Ag),并在PD-1阻断时对CD8 T细胞提供帮助

图5 PD-1hiCD39+ CD4 Tconv TILs包含肿瘤特异性细胞,并通过增强DC介导的CD8 T细胞增殖来响应PD-1的阻断
△点击放大图片
作者将体外CD4 Tconv TILs分类为PD-1-CD39-、PD-1hiCD39-和PD-1hiCD39+亚群(图3A)并克隆。在体外扩增的PD-1hiCD39-和PD-1hiCD39+亚群的克隆群体中,绝大部分保守了它们的体外表型(图5,A和B)。一部分来自分类后的PD-1-CD39-细胞的克隆获得了一定水平的PD-1和/或CD39表达(图5,A和B)。作者用覆盖全长NY-ESO-1的重叠肽池来刺激所有克隆体。来自PD-1hiCD39+亚群的22个克隆中,有5个在Ag刺激下特异性分泌IFN-γ,而来自PD-1 CD39-和PD-1hiCD39-亚群的54个克隆和17个克隆分别没有表现出Ag识别(图5C)。
作者研究了阻断抗PD-1单克隆抗体是否可以直接影响耗竭的CD4 T细胞辅助活性。首先分析了PD-1阻断对CD4 Tconv TILs帮助DC成熟能力的影响。与未处理的CD4TIL共培养相比,经抗PD-1预处理的CD4/未成熟DC共培养中,CD4 T细胞和DC细胞的细胞因子分泌增加(图5D)。与这些结果一致的是,我们发现PD-1阻断CD4 TIL后CD154 (CD40L)的表达增强(图5E),这意味着通过CD40-CD40L相互作用诱导iDC成熟的能力增强。因此,CD4 TIL的抗PD-1预处理导致DC成熟增强,这可以从共刺激配体CD86的表达增加(图5F)以及IL-12分泌增加得到证明(图5D)。这些结果表明CD4 TIL可被抗PD-1单克隆抗体靶向作用,导致CD4 TIL活化介导DC成熟。
结论:结果表明,肿瘤部位耗竭的CD4 T细胞是PD-1封锁反应的参与者。作者发现与CD39表达相关的PD-1高表达,并作为CD4 T细胞原位耗竭的标志物。PD-1hiCD39 + CD4 T共享CD8 T耗竭特征,特别是,耗竭转录因子TOX的表达及其目标基因以及Ags。研究表明,尽管PD-1hiCD39 + CD4TIL中,细胞因子生成细胞比例高,但这些细胞产生的细胞因子的数量低于其他CD4 TIL亚群中细胞因子生成细胞产生的细胞因子数量,促进它们的耗竭状态。CD4 TILs中PD-1的阻断增加了细胞因子的产生以及刺激后CD154上调,导致DC的加速成熟。研究发现PD-1阻断特异性PD-1hiCD39+ CD4 TILs可以支持特异性自体CD8 T细胞的增殖,这意味着CD4 TILs在原位发挥辅助功能,而这可以通过PD-1阻断而增强。基于本文的结果和之前的研究工作,作者提出了一个模型,循环中的PD-1+肿瘤特异性CD8 T细胞到达肿瘤部位,在那里它们受到DC的刺激,增殖,获得Trm标记物并在局部保留,最终耗尽。在抗PD-1/PD-L1作用下,通过直接阻断PD-1对CD8 T细胞的作用,并通过重新激活肿瘤特异性CD4 T细胞的辅助活性,促进CD8 T细胞的增殖。
小优为您整理了部分相关产品哦:
| - | 货号 | 名称 |
| 样本制备 | 17144002 | FICOLL PAQUE PLUS 6X100 ML |
| 样本制备 | 130-100-008 | MACS Tissue Storage Solution |
| 样本制备 | SH30259.02 | IMDM without L-Glutamine |
| 样本制备 | 130-095-929 | Tumor Dissociation Kit, human, |
| 样本制备 | 130-095-937 | gentleMACS Octo Dissociator |
| 样本制备 | 130-093-237 | gentle MACS C Tubes |
| 样本制备 | 130-098-462 | MACS SmartStrainers (70 µm) |
| 样本制备 | 130-094-183 | Red Blood Cell Lysis Buffer |
| 磁珠分选 | 130-045-801 | CD45 MicroBeads, human |
| 磁珠分选 | 130-045-101 | CD4 MicroBeads, human |
| 磁珠分选 | 130-045-201 | CD8 MicroBeads, human |
| 磁珠分选 | 130-050-201 | CD14 MicroBeads, human |
| 磁珠分选 | 130-042-201 | MS Separation columns |
| 磁珠分选 | 130-042-401 | LS Separation columns |
| 磁珠分选 | 130-042-901 | LD separation columns |
| 磁珠分选 | 130-042-301 | MidiMACS Starting Kit (LS) |
| 磁珠分选 | 130-042-501 | Mini&MidiMACS Starting Kit (MS, LS) |
| 磁珠分选 | 130-091-051 | QuadroMACS Starting Kit (LS) |
| 磁珠分选 | 130-091-221 | autoMACS Running Buffer 6 X 1,5L |
| 磁珠分选 | 130-091-376 | MACS BSA Stock Solution 6 x 75 ml |
| 磁珠分选 | 130-091-222 | autoMACS Rinsing Solution 6 x 1,45 L |
| 流式检测 | 555333 | Hu CD3 PE UCHT1 100Tst |
| 流式检测 | 560768 | Hu CD4 Horizon V500 RPA-T4 100Tst |
| 流式检测 | 563681 | Hu CD39 BV650 TU66 100Tst |
| 流式检测 | 612846 | Hu CD45RA BUV737 HI100 100Tst |
| 流式检测 | 559596 | Hu CD49a PE SR84 100Tst |
| 流式检测 | 560737 | Hu/NHP CD69 APC-H7 FN50 50Tst |
| 流式检测 | 555658 | Hu CD86 PE 2331(FUN-1) 100Tst |
| 流式检测 | 550259 | Hu CD103 FITC Ber-ACT8 100Tst |
| 流式检测 | 563931 | Hu CD152 BV786 BNI3 50Tst |
| 流式检测 | 555700 | Hu CD154 PE TRAP1 100Tst |
| 流式检测 | 565299-50ug | Hu CD279 (PD-1) BUV737 EH12.1 50Tst |
| 流式检测 | 565299-100ug | Hu CD279 (PD-1) BUV737 EH12.1 50Tst |
| 流式检测 | 747840 | Hu TIGIT BV650 741182 50ug |
| 流式检测 | 565562 | Hu TIM-3 (CD366) BV421 7D3 100Tst |
| 流式检测 | 130-126-455 | TOX Antibody, anti-human/mouse, pure, REAfinity™ |
| 流式检测 | 557995 | Hu IFN-γ Alexa 700 B27 100ug |
| 流式检测 | 557647 | Hu TNF PE-Cy7 MAb11 100Tst |
| 流式检测 | abs04855-1mg | Biotinylated Human HLA-A*0201 NY-ESO-1 (SLLMWITQC) complex Protein |
| 流式检测 | 555809 | Hu HLA-DR NALE L243 (G46-6) 500ug |
| 流式检测 | 566825 | Hu HLA-DP PE B7/21 100Tst |
| 流式检测 | LS-C390296-20 | HLA-DQ Antibody (clone SPV-L3) LS-C390296 |
| 刺激剂 | sc-3576 | PMA |
| 细胞因子检测 | 561515 | Hu IFN-γ ES CBA Flex Set B8 100Tst |
| 细胞因子检测 | 562262 | Ms IL-2 ES CBA Flex Set A5 100Tst |
| 细胞因子检测 | 562336 | Ms TNF ES CBA Flex Set C8 100Tst |
| 细胞因子检测 | abs551818-96T | Human TNF-α High Sensitivity ELISA Kit |
| 细胞因子检测 | abs551817-96T | Human IFN-γ High Sensitivity ELISA Kit |
| 细胞培养 | 130-097-743 | Human IL-2 IS |
| 细胞培养 | 130-093-922 | Human IL-4, premium grade |
| 细胞培养 | 130-093-864 | Human GM-CSF, premium grade |
| 细胞培养 | 04-418Q | X-VIVO 15 with Gent L-Gln, Phen Red |
| 细胞培养 | 170-076-309 | TexMACS GMP Medium - 1000mL (Phen Red) |
手术治疗、放疗、化疗和免疫治疗是目前肿瘤治疗的4大手段。研究表明,CD4 T和CD8 T均参与肿瘤的免疫治疗。而单一的放疗活免疫疗法得到的效果有限,为此,研究者们也想观察2种疗法结合起来的效果和机制。接下来跟大家分享的文章则从这个角度向大家展示了CD4 T和CD8 T结合疗法对肿瘤的控制。
02 CD8+和CD4+在肿瘤治疗中的作用

△点击放大图片
体细胞非同义突变产生的新抗原是肿瘤特异性T细胞的关键靶点,但只有少数预计具有免疫原性的突变是由MHC分子在癌细胞上呈现的。在小鼠和患者身上进行的疫苗接种研究表明,大多数引起T细胞反应的新表位不能诱导显著的抗肿瘤活性,原因尚不完全清楚。
本篇文章结果表明,在免疫原性差的三阴性乳腺癌小鼠模型中,放疗可上调含有免疫原性突变的基因表达。由这些基因编码的新表位接种可诱导CD8+和CD4+ T细胞,虽然这些细胞对防止肿瘤生长无效,但却提高了放疗的疗效。机制上,新抗原特异性CD8+T细胞优先杀死辐照过的肿瘤细胞。新抗原特异性CD4+ T细胞是疫苗治疗效果所必需的,其作用机制是产生Th1细胞因子,杀死被照射的肿瘤细胞,促进表位扩散。这种细胞毒活性依赖于辐射上调肿瘤细胞表面II类MHC分子以及死亡受体FAS/CD95和DR5的能力。研究结果表明:放疗与新抗原接种协同工作,以改善肿瘤控制。
在这里,作者使用4T1细胞,一种具有293体细胞突变的免疫原性差的三阴性乳腺癌小鼠模型,来测试放射治疗是否可以增加其编码免疫源性突变的基因表达。
(1)4T1肿瘤细胞中CD8+新表位的鉴定

图6 4T1乳腺癌细胞中放射治疗上调MHC-I新表位的预测和体外验证
△点击放大图片
为了鉴定新抗原,首先在体外对4T1细胞进行了全外显子组和RNA测序。发现224个基因共包含293个体细胞突变,其中115个基因编码的154个突变在RNA水平上表达(图6A)。其中,97个突变通过了基于变异等位基因频率的附加筛选。通过对同基因BALB/c小鼠4T1肿瘤提取的DNA/RNA进行全外显子组/RNA测序,证实了11个突变基因(对应13个突变)在体内的表达。接下来,为了验证辐射增加了编码免疫源性突变的基因表达的假设,作者比较了这11个突变基因在经辐照处理和未处理的4T1细胞中的表达。细胞经连续3天以8 Gy的剂量照射处理,4个基因Adgrf5、Cand1、Dhx58和Raet1e(包含5个突变),辐射显著上调(图6B)。利用NetMHC算法和pVAC-Seq新抗原发现系统,预测这4个基因中的9个新表位与MHC-I蛋白的亲和力小于300 nM,根据亲和力最高的评分,每个突变选择1个新表位进行检测(表1)。使用表达小鼠MHC-I等位基因H2-Kd或H2-Ld的RMA-S细胞进行稳定试验,检测相应多肽与MHC-I分子的结合(图6C)。CAND1与H2-Kd具有很强的结合能力,与作为阳性对照的表位HA515的结合能力相当。ADGRF5也与H2-Kd结合,但结合程度较低。对于H2-Ld, RAET1E和DHX58表现出较强的活性。
结果表明,CAND1/H2-Kd和DHX58/H2-Ld配合物的半衰期最长(>6小时);ADGRF5/H2-Kd和RAET1E/H2-Ld配合物的半衰期最短(<6小时)(图6 D)。

表1 用于体外和体内试验的候选新表位的特征
△点击放大图片
(2)辐射可上调新表位的体内免疫原性

图7 4T1细胞中免疫原性新表位的鉴定
△点击放大图片
小鼠分别用佐剂或多肽联合免疫两次,间隔1周(图7A)。第二次免疫一周后,将免疫引流淋巴结和脾脏的细胞悬液与相应的新表位体外重新刺激,然后在CD8+和CD4+ T细胞内对参与T细胞效应功能的2种细胞因子IFN-γ和TNF-α进行细胞内染色。在CD8+新表位中,ADGRF5、RAET1E、LTA4H-a和LTA4H-b并没有在仅注射佐剂的小鼠中引起高于背景的反应(图7B)。相比之下,DHX58和CAND1刺激了多功能的 CD8+T细胞反应,大多数应答细胞同时产生IFN-γ和TNF-α(图7B和C)。在CD4+新表位中,只有ADGRF5衍生的肽(以下为ADGRF5-II)刺激CD4+T细胞产生IFN-γ和TNF-α。表明它能够在体内启动T细胞反应(图7D和E)。对比突变和未突变(WT)多肽与MHC-I等位基因的结合能力,CAND1有显著差异(EC50分别为1.5 μM和58.4 μM), DHX58差异不显著(EC50分别为27.0 μM和29.2 μM)(图7 F)。
(3)CAND1新表位是CD8+细胞毒性T细胞的靶点

图8 CAND1特异性的CD8+ T细胞具有细胞毒性,并能优先杀死辐照过的4T1细胞
△点击放大图片
接种了HA515多肽的小鼠作为实验的阳性对照,显示出对载HA515靶细胞的高体内细胞毒活性(图8A)。在接种Neo-vax的小鼠中,体内细胞毒性对装载所有3种多肽的细胞和仅装载CAND1的细胞在脾脏和淋巴结中都是显著的,表明这个新表位是细胞毒性T细胞的主要靶点(图8B和C)。对DHX58新表位没有检测到细胞毒性。同样,在体内或体外对装载ADGRF5-II的靶细胞也没有显著的细胞毒性(图8C和D)。相反,在体外,Neo-vax处理的小鼠淋巴结衍生的T细胞容易杀死带有cand1突变的靶细胞,但没有WT表位。细胞毒性在MHC-I阻断抗体的存在下消失,证实了CD8+ T细胞对MHC-I呈现突变肽的特异性(图8D)。接下来,从Neo-vax或仅佐剂接种的(对照)小鼠中分离出的T细胞分别与未经处理和用高剂量和低剂量CFSE标记的4T1靶细胞孵育(图8E),与Neo-vax小鼠的淋巴结细胞共培养后,可以观察到辐射4T1细胞与未辐射4T1细胞的选择性杀伤(图8F和G)。这些数据表明,Neo-vax疫苗可产生针对CAND1新抗原的CD8+细胞毒T细胞,可以选择性地杀死辐照过的4T1细胞。
(4)照射后癌细胞上CAND1和ADGRF5-II新抗原表位增加
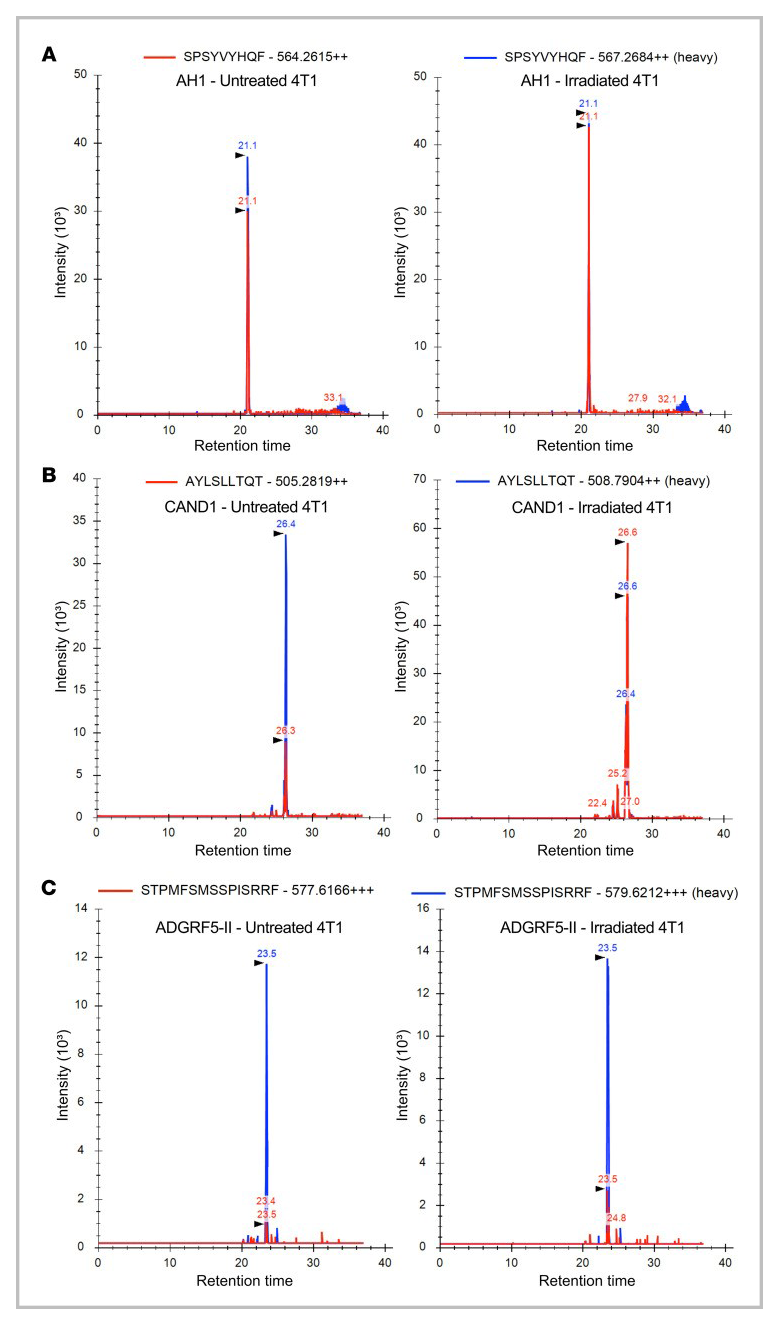
图9 靶向检测和定量照射后肿瘤细胞表面的新表位和控制表位AH1
△点击放大图片
从未经处理和辐照处理的4T1细胞中免疫纯化MHC-I和MHC-II复合物,洗脱MHC结合肽后,样本中掺入重同位素标记标准肽进一步定量目标SRM分析(图9)。控制AH1肽是识别和量化与拷贝数略有增加/单细胞辐照4T1细胞(103.9)比未经处理的细胞(80.4;图9A和表2)。相比之下,CAND1表达非常低拷贝数/单细胞在未经处理的细胞(23.3),但丰富辐照后显著增加(134.5)(图9B和表2)。尽管在未处理的4T1细胞上几乎检测不到MHC-II分子的表达,但通过靶向MS分析,MHC-II结合的ADGRF5-II肽被识别出来,在辐照的4T1细胞中,每个细胞的拷贝数至少增加了3倍(图9C和表2)。

表2 未处理和辐照4T1细胞中(neo)抗原表位的定量
△点击放大图片
(5)接种辐射上调的新抗原可改善放疗对肿瘤的控制
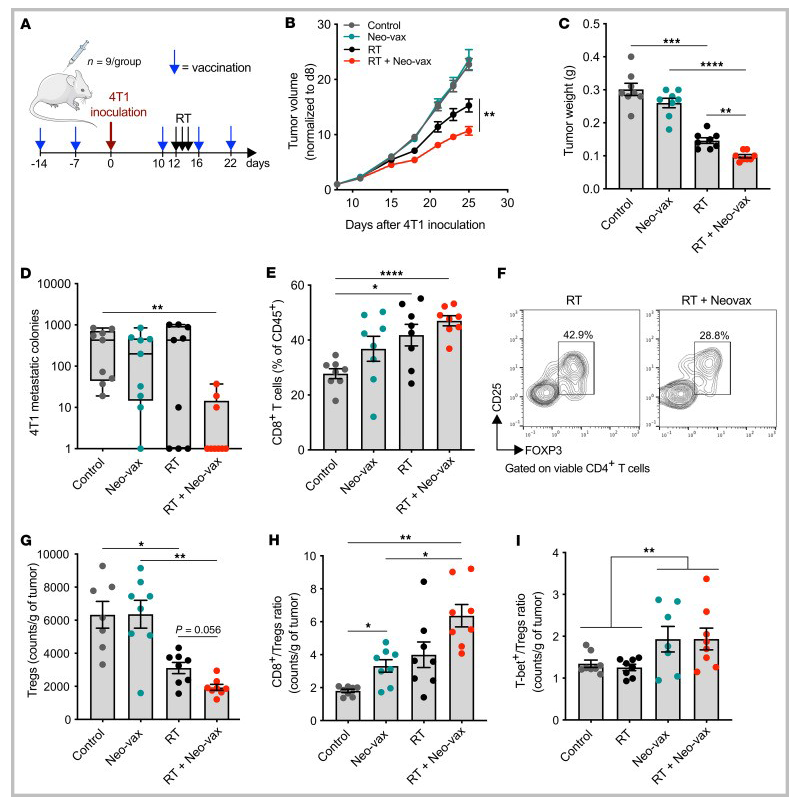
图10 接种辐射上调的新抗原可与放疗联合增强抗肿瘤免疫应答
△点击放大图片
为了研究确定的新抗原在抗肿瘤免疫应答中的作用,在4T1肿瘤细胞接种之前,小鼠单独接种Neo-vax或佐剂两次,然后每周接种(图10A)。每组半数小鼠接受肿瘤局部放射治疗,连续3天给予8 Gy的剂量。Neo-vax不能保护小鼠免于肿瘤发展,但它显著改善了局部放疗的肿瘤控制(图10B和C)。与对照组相比,仅在Neo-vax和放射治疗的小鼠中自发肺转移显著减少(图10D)。与未处理的肿瘤相比,CD8+ T细胞明显增多,CD4+ CD25+ FOXP3+调节性T细胞(Treg)明显减少(图10E-G)。Neo-vax组CD8+ /Treg比值显著升高,Neo-vax与放疗联合使用后进一步改善(图10H)。Neo-vax治疗小鼠肿瘤中T-bet+ /Treg 细胞比值在与放疗无关的情况下增加(图10I)。总的来说,这些结果表明,新抗原疫苗接种改善了放疗小鼠局部和全身的抗肿瘤免疫反应。
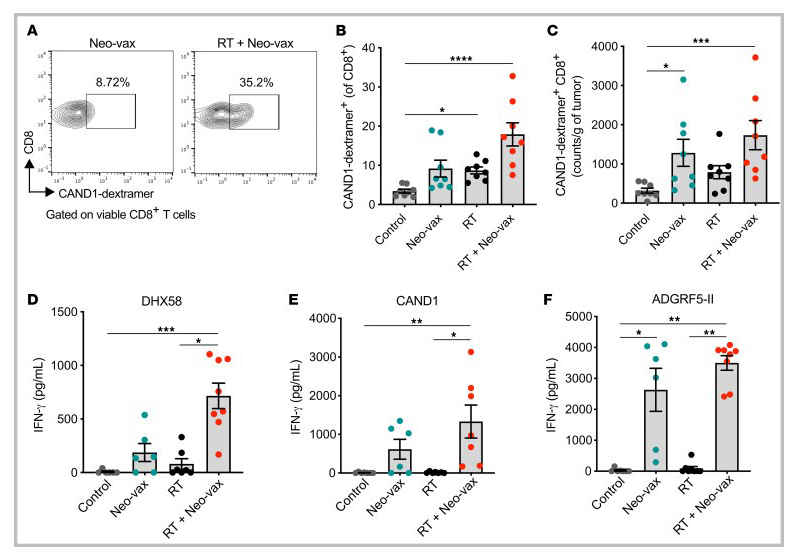
图11 放疗增强T细胞对辐射上调的新抗原的反应
△点击放大图片
为了进一步表征新抗原特异性T细胞的反应,我们用带有CAND1新表位的H2-Kd葡聚糖对肿瘤浸润T细胞进行染色。与对照组小鼠相比,放疗联合Neo-vax治疗的小鼠肿瘤中,CAND1特异性CD8+ T细胞显著增加(图11A-C)。在接受Neo-vax或放疗的小鼠肿瘤中,cand1特异性T细胞的频率和数量也有所增加,尽管比两种治疗联合时要低,这表明放疗有助于启动cand1特异性CD8+ T细胞。在肿瘤引流淋巴结中,只有当Neo-vax联合放疗时,才出现CD8+新表位(DHX58和CAND1)体外刺激后产生IFN-γ的情况(图11D和E),进一步支持作用辐射增强T细胞反应针对radiation-upregulated neoantigens。相比之下,CD4+新表位ADGRF5-II刺激后IFN-γ的产生是由Neo-vax驱动的,与放疗无关(图11F)。
(6)放射上调新抗原的治疗性疫苗接种可提高肿瘤控制和生存率

图12 新抗原疫苗联合放疗的治疗效果
△点击放大图片
以上实验表明,Neo-vax激活的抗肿瘤T细胞能够抑制照射后4T1肿瘤的生长和肺转移。为了检验治疗性疫苗接种是否有效,小鼠在接种肿瘤后免疫,几天后进行肿瘤局部放疗(图12A)。与单纯放疗相比,放疗加Neo-vax治疗的小鼠肿瘤进展显著延迟;与预防性接种相比,效果有所延迟(图12B和C)。与预防接种的效果进行比较,这表明新抗原特异性T细胞扩增可能发生缓慢,至少需要1次疫苗接种。尽管如此,接种疫苗在生存率方面的改善虽小但意义重大(图12D)。
(7)新抗原特异性CD8+和CD4+ T细胞是新抗原疫苗有效的必要条件
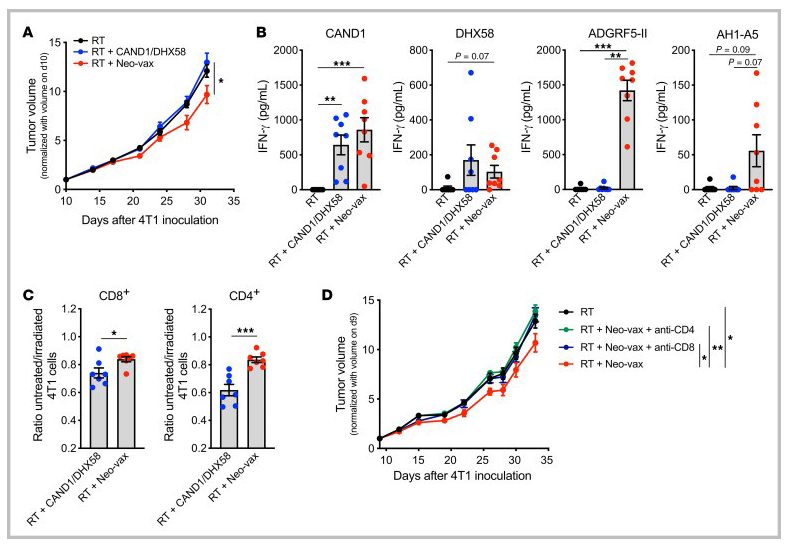
图13 CD4+和CD8+新抗原特异性T细胞是疫苗抗肿瘤活性所必需的
△点击放大图片
最近的研究表明,抗肿瘤免疫反应的成功取决于肿瘤新抗原的表达,这些新抗原同时激活CD4+和CD8+T细胞。为了检测MHC-II新表位ADGRF5-II对抗肿瘤免疫反应的贡献,小鼠接种了3种多肽,或仅接种了DHX58和CAND1。在缺乏ADGRF5-II的情况下,接种疫苗改善辐照4T1肿瘤控制的能力丧失(图13A)。为了了解这种活性丧失的机制,在第31天采集肿瘤引流淋巴结,并检测在体内新抗原刺激下IFN-γ的产生。在疫苗中包含MHC-II新抗原,不需要启动CAND1和dhx58特异性CD8+ T细胞(图13B)。ADGRF5- II特异性CD4+ T细胞在肽刺激后产生大量IFN-γ。此外,尽管与新抗原特异性T细胞相比,CD8+表位AH1-A5对IFN-γ的诱导程度较低,但表明疫苗需要激活CD4+ T细胞才能促进抗原扩散(图13B)。这一解释与CT26肿瘤模型中CD4+ T细胞新表位接种联合局部肿瘤放疗效果的数据一致。
为了评价新抗原特异性T细胞的细胞毒活性,我们从接种DHX58和CAND1或Neo-vax的4T1小鼠身上收集脾细胞。用CAND1或ADGRF5-II体外再刺激后,分离CD8+和CD4+ T细胞作为效应细胞,以4T1为靶细胞进行体外杀伤实验。当从接受Neo-vax的小鼠中获得CD8+CD8+ T细胞时,辐照4T1细胞的相对杀伤显著提高,这表明辅助性CD4+ T细胞的存在改善了肿瘤特异性细胞毒性CD8+ T细胞的系统扩增(图13C)。出乎意料的是,CD4+ T细胞对辐照后的4T1细胞也有显著的杀伤作用(图13C)。此外,CD8+ T细胞或CD4+ T细胞的缺失消除了Neo-vax的作用(图8D),表明这两种T细胞群体都是需要的。
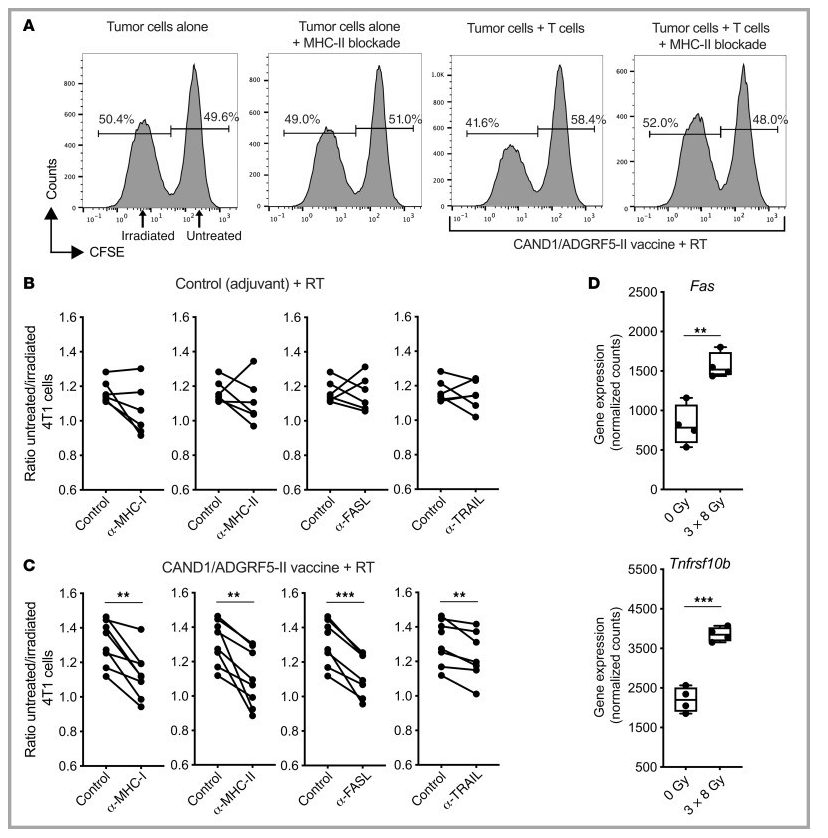
图14 CD4+和CD8+新抗原特异性T细胞以MHC受体和死亡受体依赖的方式杀伤肿瘤细胞
△点击放大图片
为了证实新抗原特异性CD4+ T细胞对4T1细胞的杀伤能力,我们从接种了佐剂对照或CAND1和ADGRF5-II新抗原的小鼠身上获得肿瘤引流淋巴结细胞,并按照上述方法进行体外杀伤试验。通过阻断MHC-I和MHC-II,辐照4T1细胞的杀伤降低(图14,A-C),表明CD4+和CD8+ T细胞的贡献。CD4+T细胞的细胞毒性已被证明依赖于靶细胞的Fas表达。一致地,4T1细胞的Fas表达被辐射显著增强(图14D),阻断Fas配体(FASL)减少了新抗原免疫小鼠淋巴结T细胞对辐照后的4T1细胞的杀伤(图14C)。辐射也上调了Tnfrsf10b(编码死亡受体DR5)在4T1细胞中的表达,并且在阻断DR5配体TRAIL后,可以看到辐射4T1细胞杀伤的微小但显著减少(图14,C和D)。
结论:这些研究结果表明,CD8+和CD4+新抗原是新表位疫苗最佳抗肿瘤活性所必需的。在放射治疗的背景下,新抗原特异性CD4+ T细胞可能有助于疫苗的治疗效果,不仅通过CD8+T细胞的效应功能,而且通过直接杀死癌细胞,反映了辐射能够上调癌细胞上MHC-II抗原和死亡受体的表达。因此,放射治疗作为一种理想的组合伙伴,可以提高目前临床正在进行的个体化新抗原接种方法的疗效。
部分相关产品(可直接联系优宁维哦~)
| - | 货号 | 名称 |
| 体内抗体 | BE0077-50MG | InVivoMab anti-mouse MHC Class I (H-2) |
| 体内抗体 | BE0077-5MG | InVivoMab anti-mouse MHC Class I (H-2) |
| 体内抗体 | BE0077-25MG | InVivoMab anti-mouse MHC Class I (H-2) |
| 体内抗体 | BE0077-1MG | InVivoMab anti-mouse MHC Class I (H-2) |
| 体内抗体 | BE0077-100MG | InVivoMab anti-mouse MHC Class I (H-2) |
| 体内抗体 | BE0108-50MG | InVivoMab anti-mouse MHC Class II (I-A/I-E) |
| 体内抗体 | BE0108-5MG | InVivoMab anti-mouse MHC Class II (I-A/I-E) |
| 体内抗体 | BE0108-25MG | InVivoMab anti-mouse MHC Class II (I-A/I-E) |
| 体内抗体 | BE0108-1MG | InVivoMab anti-mouse MHC Class II (I-A/I-E) |
| 体内抗体 | BE0108-100MG | InVivoMab anti-mouse MHC Class II (I-A/I-E) |
| 体内抗体 | BE0319-50MG | InVivoMAb anti-mouse FasL (CD178) |
| 体内抗体 | BE0319-5MG | InVivoMAb anti-mouse FasL (CD178) |
| 体内抗体 | BE0319-25MG | InVivoMAb anti-mouse FasL (CD178) |
| 体内抗体 | BE0319-1MG | InVivoMAb anti-mouse FasL (CD178) |
| 体内抗体 | BE0319-100MG | InVivoMAb anti-mouse FasL (CD178) |
| 核酸提取 | 74134 | RNeasy Plus Mini Kit (50) |
| 核酸提取 | 80204 | AllPrep DNA/RNA Mini Kit |
| 样本制备 | 130-095-926 | Spleen Dissociation Kit, mouse |
| 样本制备 | 130-094-183 | Red Blood Cell Lysis Buffer |
| 样本制备 | 130-098-462 | MACS SmartStrainers (70 µm) |
| 样本制备 | 130-096-730 | Tumor Dissociation Kit,Mouse |
| 样本制备 | 130-095-927 | Lung Dissociation Kit,Mouse |
| 样本制备 | 130-095-937 | gentleMACS Octo Dissociator |
| 样本制备 | 130-093-237 | gentle MACS C Tubes |
| 磁珠分选 | 130-095-130 | Pan T Cell Isolation Kit II, Mouse |
| 磁珠分选 | 130-104-454 | CD4+ T Cell Isolation Kit, mouse |
| 磁珠分选 | 130-104-075 | CD8a+ T Cell Isolation Kit, mouse |
| 磁珠分选 | 130-042-201 | MS Separation columns |
| 磁珠分选 | 130-042-401 | LS Separation columns |
| 磁珠分选 | 130-042-901 | LD separation columns |
| 磁珠分选 | 130-042-301 | MidiMACS Starting Kit (LS) |
| 磁珠分选 | 130-042-501 | Mini&MidiMACS Starting Kit (MS, LS) |
| 磁珠分选 | 130-091-051 | QuadroMACS Starting Kit (LS) |
| 磁珠分选 | 130-091-221 | autoMACS Running Buffer 6 X 1,5L |
| 磁珠分选 | 130-091-376 | MACS BSA Stock Solution 6 x 75 ml |
| 磁珠分选 | 130-091-222 | autoMACS Rinsing Solution 6 x 1,45 L |
| 流式检测 | 130-102-807 | CD8a Antibody, anti-mouse, PE |
| 流式检测 | 550954 | Ms CD4 PerCP-Cy5.5 RM4-5 100ug |
| 流式检测 | 130-102-793 | CD3ε Antibody, anti-mouse, APC |
| 流式检测 | 557995 | Hu IFN-γ Alexa 700 B27 100ug |
| 流式检测 | 557647 | Hu TNF PE-Cy7 MAb11 100Tst |
| 流式检测 | 564005 | Ms IL-4 BV711 11B11 50ug |
| 流式检测 | 562049 | Ms Hu IL-5 PE TRFK5 25ug |
| 流式检测 | 561059 | Ms IL-10 APC JES5-16E3 25ug |
| 流式检测 | MIF00 | Mouse IFN-gamma Quantikine ELISA Kit |
| 流式检测 | 565082 | CFSE 1mg |
| 流式检测 | 130-123-791 | CD19 Antibody, anti-mouse, APC |
| 流式检测 | 560501 | Ms CD45 HorizonV450 30-F11 50ug |
| 流式检测 | 557192 | Ms CD25 APC PC61 100ug |
| 流式检测 | 561690 | CD11b APC M1/70 25ug |
| 流式检测 | 130-092-574 | CD16/CD32 Antibody, anti-mouse, pure |
| 流式检测 | 130-111-600 | FoxP3 Antibody, anti-mouse, PE, REAfinity |
| 流式检测 | 561262 | T-BET Pure 4B10 100ug |
| 细胞冻存 | 170-076-303 | CryoMACS DMSO 10 (EP) |