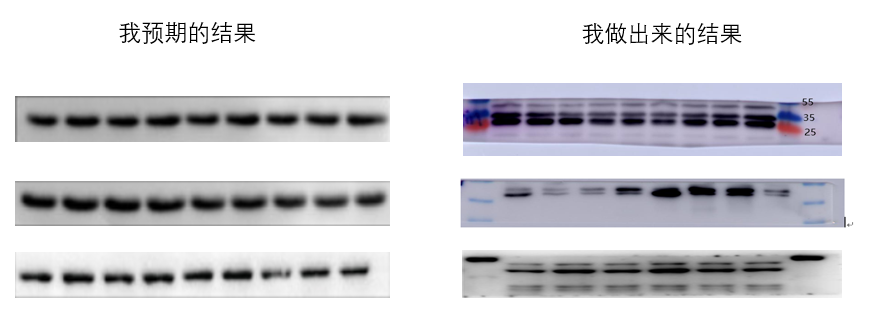
Actin相信大家再熟悉不过了,无论做哪个蛋白的Western,它总是不离不弃,需要你一直带着。它也是真核生物中含量最丰富的蛋白质之一,含量丰富意味着容易检测。大家回忆一下,第一次做Western是不是就是做的actin。可偏偏最简单的事情,却很难每次都做出完美的条带,总会出一些意想不到的结果。
△点击放大图片
如果内参actin跑不好,其他目的蛋白想跑出漂亮条带的难度也会大大增加,就好比地基没打好,很难建成高楼。今天小优细节君就来帮大家分析下为什么actin会有多条带?
【蛋白特性】
Western实验最重要的两个因素,一是蛋白,二是抗体。要探究原因,必须从源头出发,我们先看看蛋白特性。
研究发现,有很多蛋白酶可以降解actin,使原本42KDa的actin变成更短的片段, 40-41 KDa、37 KDa、30-32KDa、10-15 KDa等。
图1是凝血酶Thrombin作用不同时间后G-actin和F-actin的降解情况,主要生成37KDa(K),27KDa(L)和10KDa(M)条带。

图1
△点击放大图片
图2是组织蛋白酶Cathepsin L作用不同时间后actin的降解情况,先生成40KDa和30KDa的条带,随着时间增加,又出现了37KDa的条带。

图2
△点击放大图片
图3是弹性硬蛋白酶(PMN-Elastase)剪切actin的情况,生成了37KDa的条带,剪切位点在Val43 and Met44之间。

图3
△点击放大图片
图4是白介1β转化酶(ICE)作用不同时间后actin的降解情况,先生成了41KD的条带,随着时间增加,又出现了30KD和14KD的条带。

图4
△点击放大图片
图5是半胱氨酸蛋白酶3(caspase-3)剪切actin的情况,和ICE酶类似,凋亡情况下,actin会被剪切,产生多条带。而被 caspase-3 剪切的actin,会被泛素/蛋白酶体加速降解。
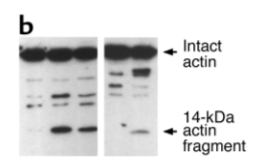
图5
△点击放大图片
还有许多尚未发现的酶都有可能对actin有剪切和降解作用,看到这里,有小伙伴会问,我做的课题又没加这些酶,为什么还是会有多条带呢?
其实不然,像上面提及的凝血酶、组织蛋白酶等是本身存在且广泛分布的,在提取蛋白的过程中就会将它们释放出来,成为降解actin的“凶手”。为什么我们一直强调制样要加入蛋白酶抑制剂,以及冰上操作,就是为了抑制这些酶的活性。
那是不是加了蛋白酶抑制剂就万事大吉了呢?
研究发现,即使添加了多种蛋白酶抑制剂,包括杆菌肽(bacitracin),亮肽素(leupeptin),抑肽素(pepstatin),抗蛋白酶(antipain),苯甲基磺酰氟(PMSF)等,还是无法抑制凋亡对内参的降解(图6)。所以,我们还要尽量保持细胞处于良好的状态和较低的传代次数,避免发生凋亡。而对于研究凋亡的小伙伴来说,需要根据具体情况选择合适的抗体或者考虑其他内参。

图6
△点击放大图片
【抗体特性】
这时又小伙伴又问了,我按照要求制样之后还有多条带,怎么办呢?
前面我们提到了Western的两大影响因素,除了蛋白本身,我们还可以从抗体入手,工欲善其事,必先利其器。Actin最常见的剪切片段是37 kDa,是因为许多酶都会在N端进行剪切,大概在Val43,或者更靠近N端的位点。这时我们可以在选择抗体的时候花一点“小心思”,尽量选择免疫原在N端,并且比剪切位点更靠近N端的抗体,就可以尽量“避免”识别剪切下来的片段,从而获得单一条带。这里需要注意,此时我们获得的Western结果虽然是单一条带,但不能反映样本本身是否降解或剪切。如果剪切位点在靠近C端的位置,抗体也会识别大片段。
还有一点需要注意,actin的N端序列在物种间的保守程度不如C端,因此这类抗体识别的种属范围不如其他C端抗体或者多克隆抗体广,但特异性较高。
总结一下,如果你在实验中发现actin的条带总是出现其他固定位置的条带,比如37 kDa、30 kDa等,很有可能就是酶的作用使actin发生了剪切。建议使用新鲜的组织或者健康的细胞进行重新制样,制样过程中充分抑制蛋白酶活性。选择抗体尽量选择N端单克隆抗体,可以事半功倍。希望大家都能做出完美的actin单一条带~
部分推荐产品:
| 货号 | 免疫原序列 |
| 4970S | N端,不与γ actin反应 |
| 3700S | N端,可与γ actin反应 |
| abs830031-50ul | Beta actin antibody |
| abs132001-50ug | Beta actin antibody |
| abs137975-50ug | beta-Actin Mouse Monoclonal Antibody |
| abs100006-50ul | Beta actin antibody |
| abs100532-50ul | Beta-actin Antibody, HRP Conjugate |
| MAB8929 | N端 |
| sc-69879 | N端 |
参考文献:
1. S Yamashita, et al. Characterization of a Protease Responsible for Truncated Actin Increase in Neutrophils of Patients with Behçet’s Disease. Biol Pharm Bull. 2001 Feb;24(2):119-22.
2. L Muszbek, et al. Cleavage of Actin by Thrombin. Proc Natl Acad Sci USA. 1974 Jun;71(6):2208-11.
3. U Matsukura, et al. Mode of degradation of myofibrillar proteins by an endogenous protease, cathepsin L. Biochim Biophys Acta. 1981 Nov 13;662(1):41-7.
4. C Kayalar, et al. Cleavage of actin by interleukin 1 beta-converting enzyme to reverse DNase I inhibition. Proc Natl Acad Sci USA. 1996 Mar 5;93(5):2234-8.
5. Jie Du, et al. Activation of caspase-3 is an initial step triggering accelerated muscle proteolysis in catabolic conditions. J Clin Invest. 2004 Jan;113(1):115-23.