泛素是由76个氨基酸组成的一个保守的多肽单位,在泛素-蛋白酶体通路中发挥重要作用。泛素可通过泛素化过程共价连接许多细胞蛋白,在这个过程中,26S蛋白酶体降解靶标蛋白。
三种组分与靶标蛋白-泛素接合过程有关。首先,泛素通过与激活组分E1 形成硫酯复合体而被激活;激活的泛素继而被转运到泛素载体蛋白E2,然后从E2被转运到泛素连接酶E3,最后从E3被转运到靶标蛋白赖氨酸残基的ε-NH2。
蛋白质泛素化参与许多细胞过程,例如蛋白酶体降解、胞吞、DNA修复、细胞周期调控及基因表达等。在癌症、代谢综合征、神经退行性疾病等疾病中,则会出现异常泛素化。
泛素化蛋白质组学利用对泛素化赖氨酸残基(K-GG)具有高亲和力的基序抗体(图1),特异性富集复杂样本中的泛素化肽段,结合LC-MS/MS蛋白质定量方法,实现大规模泛素化蛋白质定性定量分析(图2)。

图1.泛素化残基基序(K-ε-GG):泛素化残基基序(K-ε-GG)抗体可用于富集复杂混合物中含K-ε-GG的肽段。
△点击放大图片
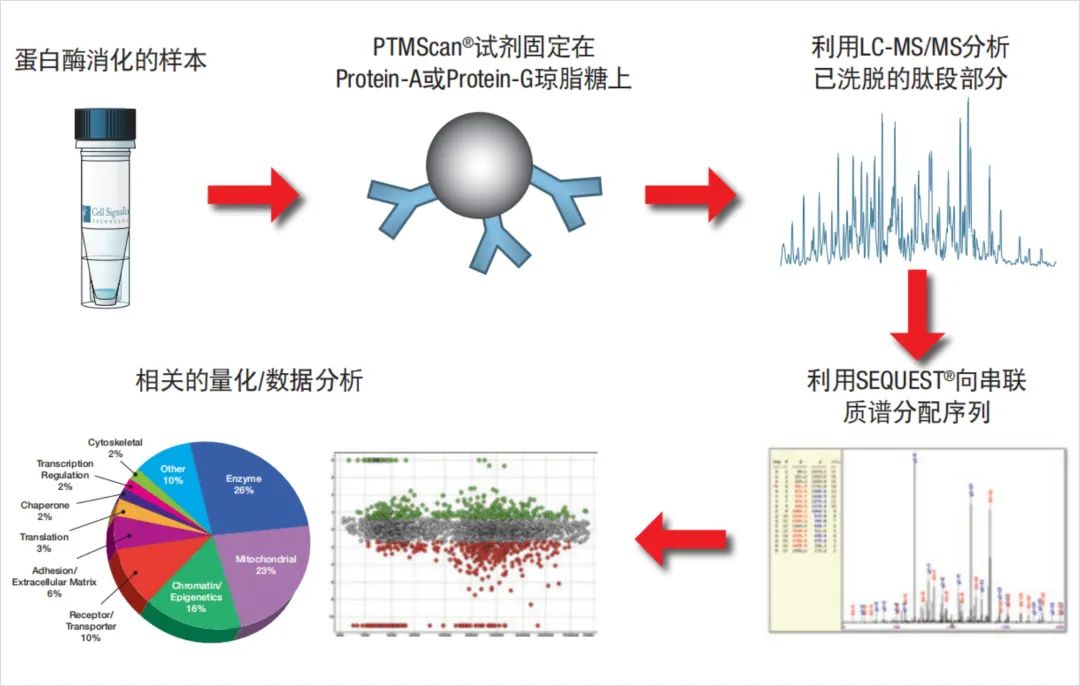
图2.泛素化蛋白质组工作流程
△点击放大图片
早在2019年末,小编就通过两篇高分文献带领大家分析了泛素化研究的思路,也简单提到了泛素化蛋白质组学研究相关PTMScan®试剂盒的技术原理。今天小编再次带领大家,通过PTMScan®试剂盒(PTMScan® Ubiquitin Remnant Motif (K-ε-GG) Kit #5562)引用文献来详细了解泛素化蛋白质组学技术在研究中的应用。


△点击放大图片
研究背景
巨噬细胞在体内平衡和炎症反应中起着关键作用。巨噬细胞极化到促炎或抗炎状态都是通过激活炎症信号通路来控制的。泛素化是一种调节这些炎性信号通路的翻译后修饰。然而,蛋白质泛素化对巨噬细胞极化的影响尚未得到很好的研究。
研究思路
1.检测促炎和抗炎巨噬细胞中总泛素化蛋白的表达水平。
结论:总泛素化蛋白的表达水平在所有三种巨噬细胞中相似(图1.1),表明特定蛋白泛素化的变化,而不是泛素化蛋白总量的变化,与巨噬细胞极化有关。

图1.1.促炎和抗炎巨噬细胞中总泛素化蛋白的表达水平(LPS:诱导促炎巨噬细胞;IL-4:诱导抗炎巨噬细胞)
△点击放大图片
2.泛素蛋白质组学评估LPS、IL-4、和PBS刺激后巨噬细胞泛素化的概况。
结论:三个巨噬细胞亚群之间的泛素化概况不同;30、32和14个蛋白分别在PBS、LPS和IL-4处理的巨噬细胞中存在差异泛素化,并且在促炎LPS处理的巨噬细胞存在差异化的32种泛素化蛋白中,iNOS和IL-1α的泛素化蛋白含量分别排在第五和第八位。(图1.2)

图1.2.促炎和抗炎巨噬细胞中的差异泛素化蛋白
△点击放大图片
3.在Itch缺陷型巨噬细胞(Itch-/-)中探索Itch是否影响巨噬细胞促炎极化及相关基因(iNOS和IL-1α)的泛素化。
结论:Itch-/-巨噬细胞更易发生促炎极化(如图1.3),且IL-1α的泛素化状态(而非iNOS)可能与Itch有关(图1.4)。

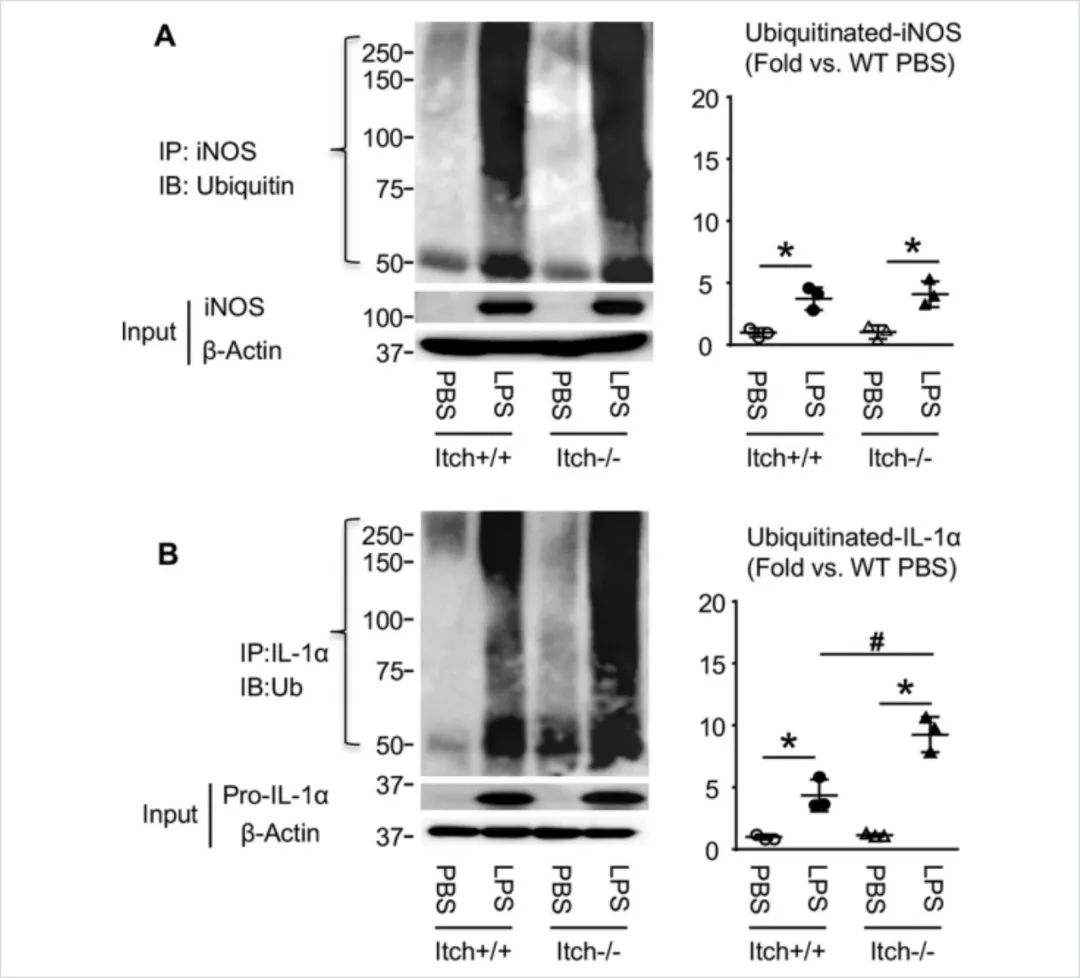
图1.3.Itch-/-巨噬细胞更容易受到促炎极化的影响
图1.4.Itch-/-促炎巨噬细胞中泛素化IL-1a水平升高
△点击放大图片
4.LPS刺激8h后去除,或用DUB抑制剂WP1130处理,观察WT和 Itch-/-巨噬细胞IL-1α泛素化水平。
结论:Itch通过促进IL-1α的去泛素化过程来调节IL-1α的泛素化状态,去泛素化过程可以被Itch蛋白耗竭或被DUB功能抑制所阻断(图1.5)。

图1.5.Itch-/-巨噬细胞IL-1α去泛素化作用降低
△点击放大图片
5.探索Itch缺陷型巨噬细胞(Itch-/-)中,降低IL-1α的去泛素化如何导致巨噬细胞促炎表型增强。
结论:Itch通过减缓泛素化IL-1α的成熟过程来抑制IL-1α的成熟,这一过程不受颗粒酶B的调控。(图1.6)
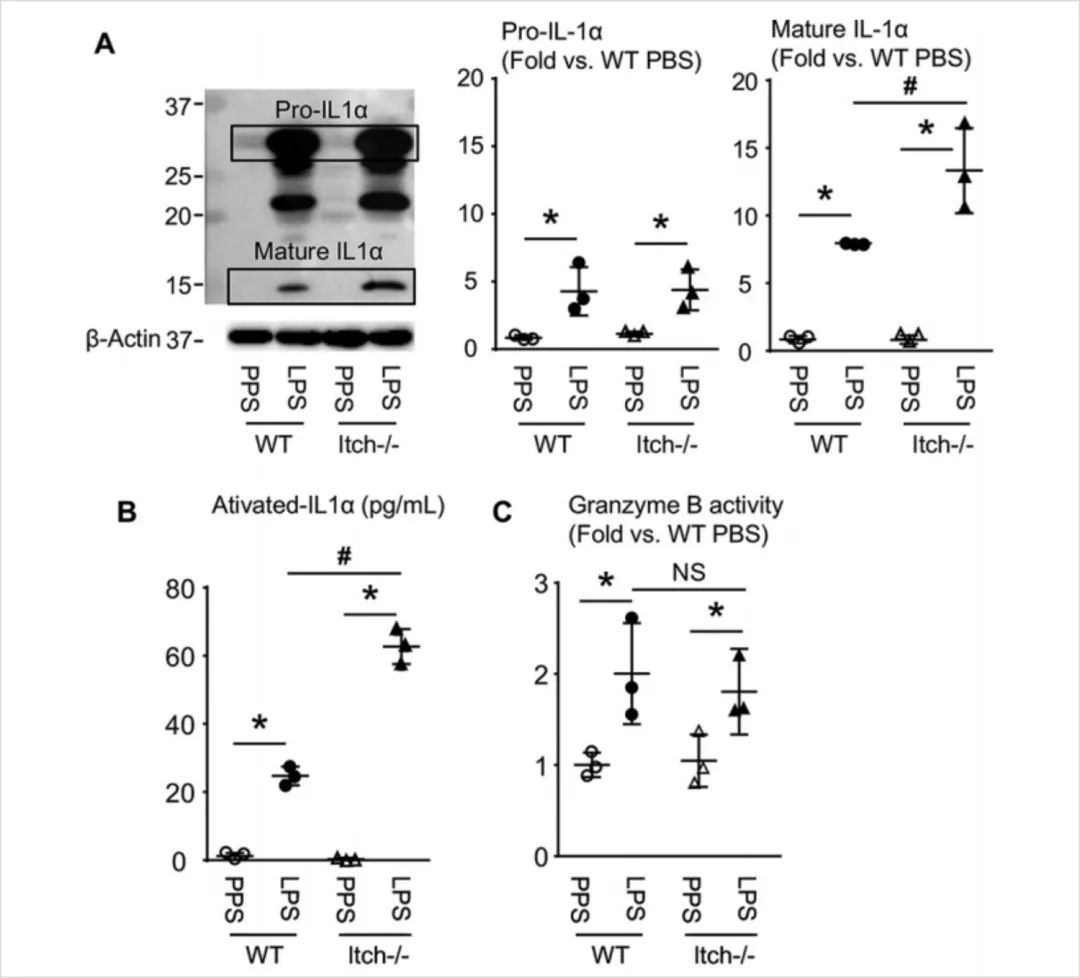
图1.6.Itch-/-促炎巨噬细胞中成熟形式的IL-1α增加
△点击放大图片
6.进一步论证IL-1α成熟有助于Itch-/-巨噬细胞对促炎极化的敏感性。
结论:IL-1α中和抗体可部分抑制LPS诱导的Itch-/-巨噬细胞的炎症反应(图1.7)。
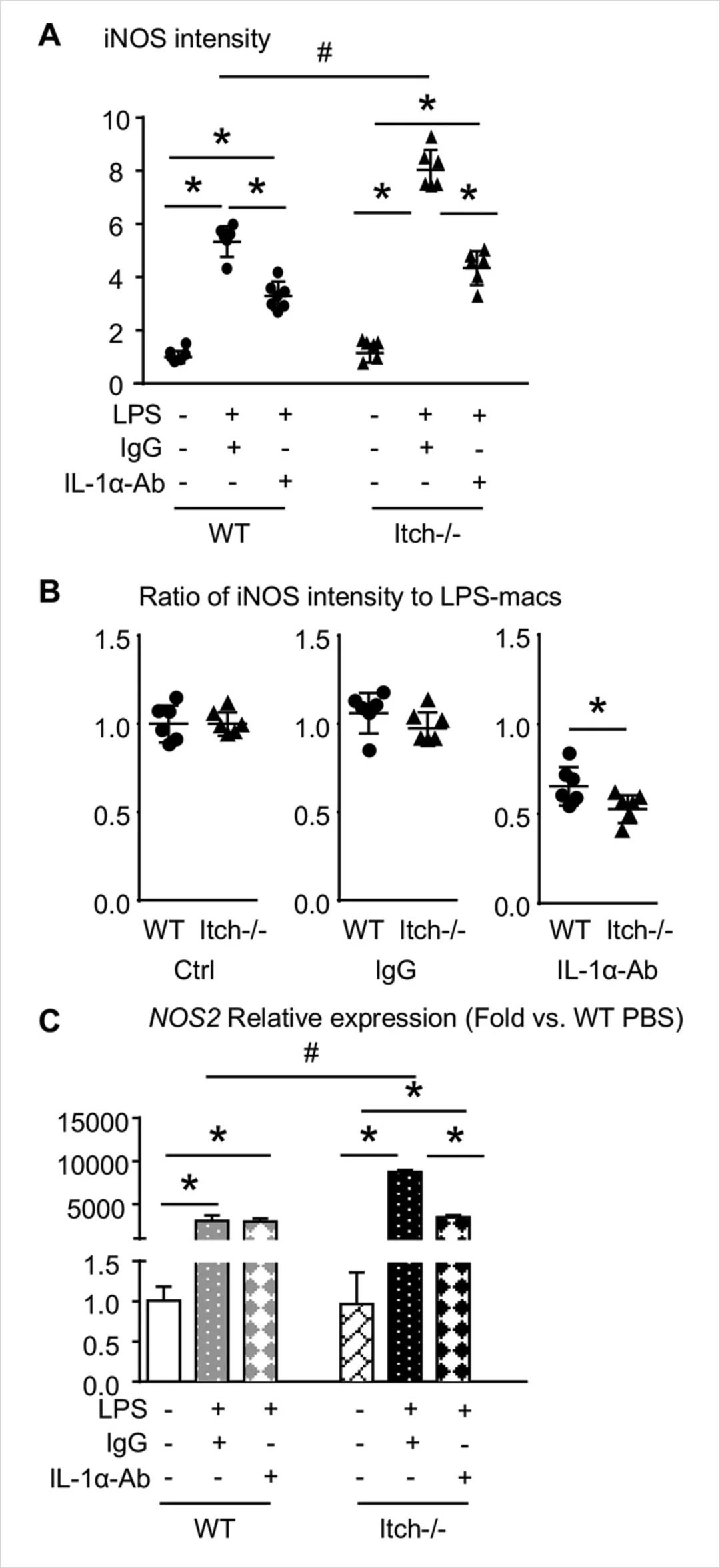
图1.7.IL-1α中和抗体可部分抑制LPS诱导的Itch-/-巨噬细胞的炎症反应
△点击放大图片
总结:LPS刺激诱导pro-IL-1α的转录,然后IL-1α被泛素化,催化加工成成熟的IL-1α,从而提高了生物活性和溶解度。Itch作为一个适配器蛋白,调控IL-1a的去泛素化。(如图1.8)

图1.8.Itch通过减少泛素化IL-1a和IL-1a的成熟来负调控炎症。
△点击放大图片


△点击放大图片
研究背景
肿瘤转移是肝细胞癌(HCC)预后不良的主要因素,但泛素化与转移的关系有待更系统的研究。作者在该研究中分析了HCC的泛素组,以更全面地了解人类HCC的转移。
研究方法
1. 泛素组法检测15例有血管浸润的HCC标本和15例无血管浸润的HCC标本的蛋白泛素化水平,发现在至少10个HCC中鉴定出7532个diGly修饰位点和3465个diGly修饰蛋白(如图2.1)。

图2.1.外圈代表至少1份HCC样本中鉴定的diGly修饰位点和蛋白质的数量;内圈表示至少10个HCC样本中鉴定的diGly修饰位点和蛋白质的数量。
△点击放大图片
2. HCC形成伴随着泛素化位点的增加和泛素链的延长,并且发现血管侵袭和HCC转移后,泛素化位点增加,泛素链缩短(图2.2)

图2.2.在HCC,随着血管的侵袭,泛素化位点增加,而泛素链缩短。
△点击放大图片
3. 接着作者根据HCC有无血管侵袭的差异泛素化蛋白,预测SYVN1是增加HCC血管侵袭的最重要的E3泛素连接酶。全细胞蛋白质组学数据和免疫组化实验显示,在有血管侵袭的HCC,与瘤周组织相比,SYVN1在肿瘤组织中的表达增加,但在无血管侵袭的HCC未发现差异(图2.3D、E),并且来自TCGA数据库的HCC患者总生存期曲线表明,在HCC,SYVN1高表达与预后不良相关(图2.3F)。总之,HCC组织中SYVN1的高表达可能通过促进肿瘤转移而影响预后。

图2.3. E3泛素连接酶SYVN1在HCC病血管侵袭中起重要作用。
△点击放大图片
4. 血清和营养缺乏条件下癌细胞在肿瘤微环境中的迁移和侵袭是肿瘤转移的关键。为了阐明SYVN1在HCC转移中的作用,作者首先测定了其对癌细胞增殖的影响。发在无血清条件下,SYVN1低表达抑制了LM3和HUH7细胞系的增殖,表明SYVN1促进癌细胞增殖(图2.4)。
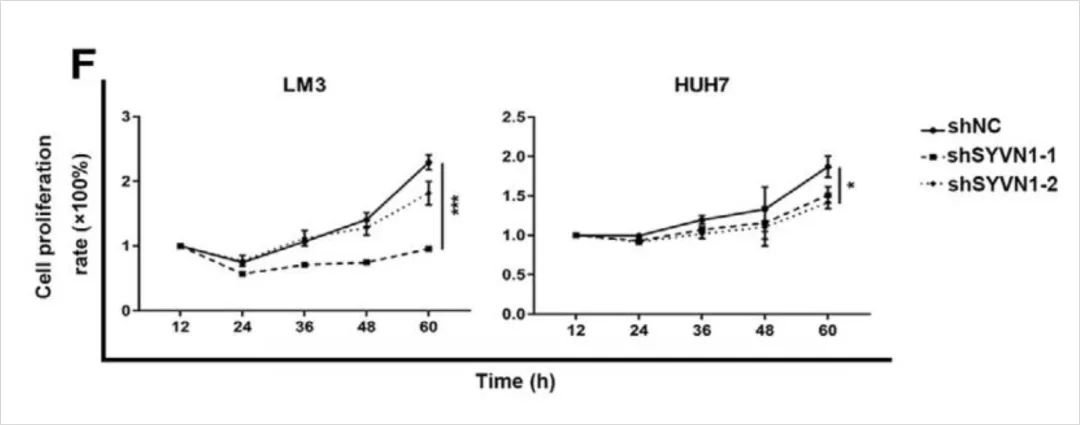
图2.4. SYVN1在血清缺乏条件下影响细胞增殖。
△点击放大图片
5. 接着,作者检测SYVN1对细胞迁移和血管生成的影响。用血清刺激血清缺乏环境中的LM3和HUH7细胞,发现shSYVN1转染细胞的迁移和侵袭能力下降(图2.5A-D),并且检测了LM3和HUH7细胞中与血管生成相关分子的mRNA表达水平,发现SYVN1低表达的细胞中相关因子表达水平下降(图2.5E)。

图2.5. SYVN1增强细胞迁移和血管生成
△点击放大图片
6. 为了确定SYVN1影响HCC转移的机制,作者使用MS在LM3和HUH7细胞系中初步筛选了与SYVN1相互作用的各种分子。结果表明,HSP90家族成员和SYVN1之间的相互作(图2.6A-D)。在全细胞蛋白质组学数据中,在有血管侵袭的HCC,HSP90家族蛋白及其共伴侣在肿瘤组织中的表达显著高于相应的瘤周组织,但在无血管侵袭的HCC,这种差异不显著(图2.6E)。EEF2K在血管生成和肿瘤转移中起重要作用,Western blotting实验发现EEF2K、CD31(血管内皮细胞的标志物)、SYVN1在肿瘤组织中高表达(图2.6F).来自GEPIA数据库的转录组数据表明,与正常组织相比,EEF2K在肿瘤组织中的表达增加(图2.6G).IP和Western blotting实验显示SYVN1增加了EEF2K泛素化(图2.6H).因此,SYVN1与HSP90相互作用,增加EEF2K泛素化。

图2.6 SYVN1与HSP90相互作用并影响EEF2K泛素化
△点击放大图片
结论:研究表明,在有和没有血管浸润的HCC的泛素化谱有显著差异。其中SYVN1是导致这一现象的最重要的E3泛素-蛋白连接酶,它与肿瘤的转移和生长有关。因此,SYVN1可能是HCC的潜在治疗靶点。
是不是还没有看够?
其实以上两篇文献均来自CiteAb网站对PTMScan® Ubiquitin Remnant Motif (K-ε-GG) Kit #5562的引用文献。如需要了解更多本产品的应用,可前往CiteAb网站查看。
△点击放大图片
当然,除了泛素化蛋白质组学,CST提供一系列针对各种翻译后修饰检测的产品:
| 泛素化蛋白质组一UbiScan®靶标 | 泛素化蛋白质组一UbiScan®基序 | 货号 | 适用研究 |
| 泛素化肽段 | K-ε-GG | 14482 | 蛋白质稳定,DNA修复;细胞周期调控及基因表达等。癌症,代谢综合征, 神经退行性疾病等。 |
| 泛素化肽段 | K-ε-GG | 5562 | 蛋白质稳定,DNA修复;细胞周期调控及基因表达等。癌症,代谢综合征, 神经退行性疾病等。 |
| 甲基化蛋白质组MethylScan®靶标 | 甲基化蛋白质组MethylScan®基序 | 货号 | 适用研究 |
| 单甲基精氨酸 | R-Me | 12235 | 可调控RNA加工、基因转录、DNA损伤修复、蛋白质转位及信号传导等过程。调控组蛋白功能,以及基因转录的表观遗传调 控癌症发生,发展。 |
| 非对称二甲基精氨酸 | R-2Me(a) | 13474 | 可调控RNA加工、基因转录、DNA损伤修复、蛋白质转位及信号传导等过程。调控组蛋白功能,以及基因转录的表观遗传调 控癌症发生,发展。 |
| 对称二甲基精氨酸 | R-2Me(s) | 13563 | 可调控RNA加工、基因转录、DNA损伤修复、蛋白质转位及信号传导等过程。调控组蛋白功能,以及基因转录的表观遗传调 控癌症发生,发展。 |
| 泛甲基赖氨酸 | K-Me/K-2Me/K-3Me | 14809 | 可调控RNA加工、基因转录、DNA损伤修复、蛋白质转位及信号传导等过程。调控组蛋白功能,以及基因转录的表观遗传调 控癌症发生,发展。 |
| 磷酸化蛋白组-PhosphoScan®靶标 | 磷酸化蛋白组-PhosphoScan®基序 | 货号 | 适用研究 |
| Akt底物 | RXRXX(S/T) | 5563 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| (Ser/Thr) AMPK底物 | (L/M)XRXX(S/T) | 5564 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| (Ser/Thr) ATM/ATR底物 | (S/T)QG (S/T)Q | 12267 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| CK2底物 | (S/T)DX(D/E) | 12170 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| MAPK/CDK底物 | PXSR、SPX(K/R) | 4652 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| PKA底物 | (K/R)(K/R)X(S/T) | 5565 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| (Thr) PLK结合基序 | STP | 5566 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| Thr-Pro 基序 | TP、TPP | 5567 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| Thr-X-Arg 基序 | TXR、TPR | 91336 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| Ser/Thr-Pro | (S/T)P | 28303 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| MAPK底物 | PXTP | 14990 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| Tyrosine (P-Tyr1000) | Y | 14478 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| Tyrosine (P-Tyr1000) | Y | 8803 | 癌症发生、发展;细胞周期、DNA损伤、细胞增殖、生长、蛋白质合成。 |
| 酰化蛋白组靶标 | 酰化蛋白组基序 | 货号 | 适用研究 |
| 乙酰化赖氨酸 | Ac-K | 14499 | 代谢调控,基因表达的调 控;表观遗传;癌症发生 发展,代谢类疾病。 |
| 乙酰化赖氨酸 | Ac-K | 13416 | 代谢调控,基因表达的调 控;表观遗传;癌症发生 发展,代谢类疾病。 |
| 戊二酰化赖氨酸 | Glut-K | 26101 | 代谢调控,基因表达的调 控;表观遗传;癌症发生 发展,代谢类疾病。 |
| 丙二酰化赖氨 | Mal-K | 93872 | 代谢调控,基因表达的调 控;表观遗传;癌症发生 发展,代谢类疾病。 |
| 丙酰化赖氨酸 | Prop-K | 17848 | 代谢调控,基因表达的调 控;表观遗传;癌症发生 发展,代谢类疾病。 |
| 琥珀酰化赖氨酸 | Succ-K | 13764 | 代谢调控,基因表达的调 控;表观遗传;癌症发生 发展,代谢类疾病。 |
| Caspase剪切底物蛋白质组靶标 | Caspase剪切底物蛋白质组基序 | PTMscan®试剂盒 | 适用研究 |
| Caspase剪切底物 | [DE(T/S/A)D] | 12810 | 细胞凋亡;癌症 |