膜蛋白通常存在于细胞或者某些特定的细胞器膜上。膜蛋白大约占整个生物体基因open-reading frames的30%,并且在基本细胞功能例如信号转导,能量产生,营养摄取或者细胞间沟通等起到了重要的作用。由于膜蛋白的一些特性,使它和普通蛋白相比纯化更具有难度。今天小编就带大家来看一看膜蛋白的纯化策略吧。
膜蛋白分离
1、膜蛋白的内源表达通常来说是比较低的,如果要提高产量可以通过重组膜蛋白的过表达,可以选择大肠杆菌,酵母,哺乳动物或者无细胞表达体系。然而,外源表达的翻译后修饰例如糖基化,磷酸化和乙酰化和天然蛋白的不同可能会导致重组蛋白的某些活性下降(原核表达没有翻译后修饰系统),可以考虑通过对组成修饰的氨基酸进行位点突变来改善。
2、跨膜蛋白具有较高的疏水性,经常需要高浓度的去垢剂来帮助溶解。此外,膜蛋白也溶液形成聚集体,甚至是在去垢剂存在的情况下,会影响下游纯化效率。去垢剂的选择也会影响下游纯化步骤的效率。例如,在带有电荷的去垢剂存在的情况下不适合使用离子交换层析;而在有去垢剂的情况下也不适合使用疏水层析。
3、一旦溶解之后,膜蛋白经常会变得更易于被蛋白酶降解。因此添加蛋白酶抑制剂例如EDTA和PMSF是很重要的(如果下游使用普通Ni柱纯化,不能使用EDTA)。
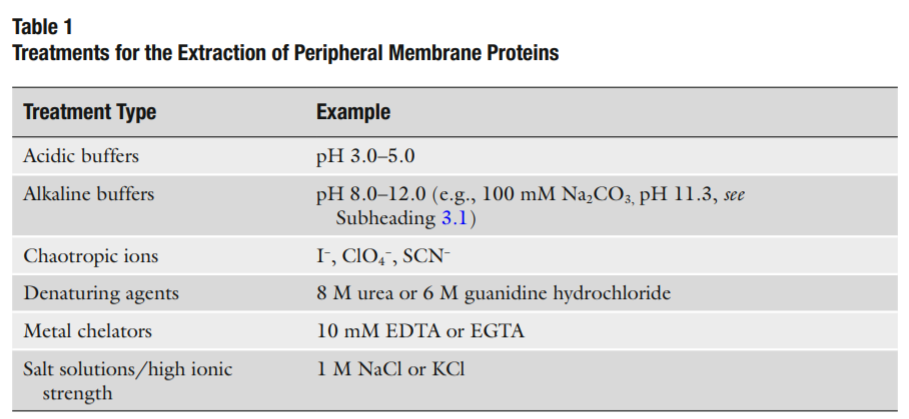
外周膜蛋白提取
外周膜蛋白可以使用相对温和的技术来分离,破坏外周膜蛋白和细胞膜之间的静电作用或者氢键,而不破坏整个细胞膜。通常使用的试剂参见表一。使用含有高盐离子浓度的缓冲液进行提取很有用因为他们会降低膜蛋白和带有电荷的脂质之间的静电相互作用。
△点击放大图片
在提取缓冲液提取10-30min后,剩下的膜双层结构和相关的膜内蛋白可以被离心分离(30-60min,100,000xg),释放的外周膜蛋白存在于上清液中。
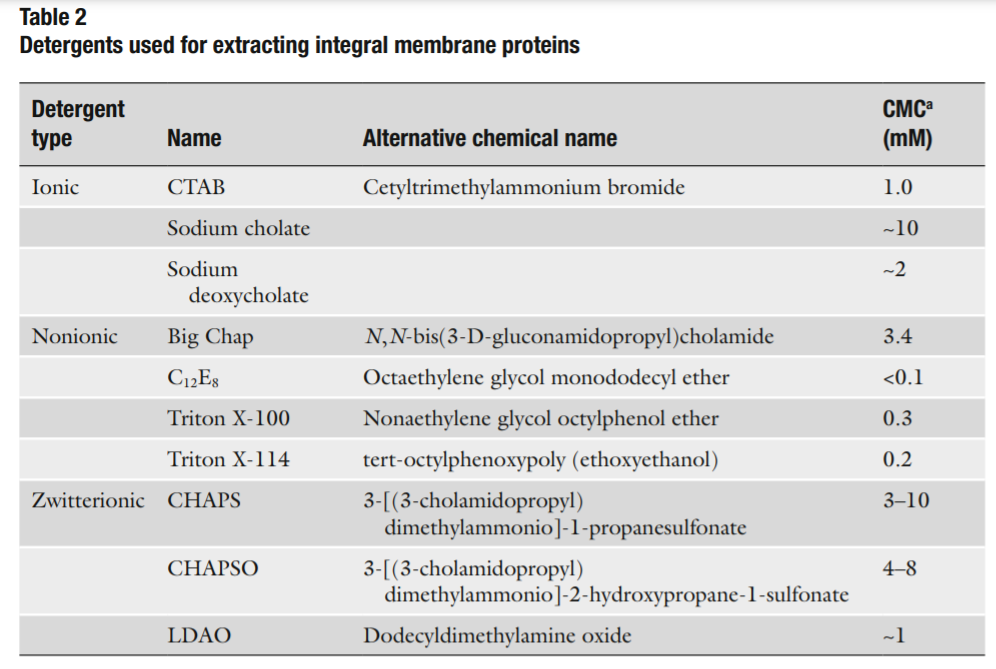
跨膜蛋白的提取
为了溶解得到跨膜蛋白,破坏膜双层结构是必要的。通常使用去垢剂的方法。去垢剂是一种两性分子,同时包含疏水和亲水的部分,并且在水中会形成胶束。胶束是去垢剂亲水头向外,疏水头向内排列的聚集体形式。去垢剂溶解蛋白通过一端结合蛋白的疏水部分,另一端结合亲水部分。去垢剂的选择应该足够溶解膜蛋白而不会造成不可逆的变性。常见的去垢剂见表二。
当筛选去垢剂时,要注意每个去垢剂的临界胶束浓度(CMC)。CMC是指自由的去垢剂分子形成胶束结构需要的浓度。因为溶液相当于膜蛋白从细胞膜上去除进入去垢剂胶束,所以CMC是蛋白提取所需的最低浓度。CMC值可参考表二。
△点击放大图片
去垢剂的筛选
FSEC用于表达条件和去垢剂的快速筛选。FSEC(Fluorescence-Detection Size-Exclusion Chromatography),又叫荧光检测尺寸排阻色谱法。具体方法是将目的基因构建在带有GFP标签的融合表达载体上,进行小量表达。通过不同的去垢剂溶解后,然后上样微量色谱柱,使用AKTA系统的紫外,荧光检测器进行检测(荧光检测器需搭配)。由于目的蛋白带有GFP标签,使用荧光检测会显示出荧光信号。通过峰型和峰面积我们可以检测到蛋白表达和溶解情况。

△点击放大图片
蛋白纯化
膜蛋白的纯化通常使用两步纯化的方法。第一步使用亲和层析,第二步使用分子筛。
| 货号 | 名称 | 规格 |
| 17524802 | HisTrap HP | 5*5ml |
| 17525501 | HisTrap FF | 5*5ml |
| 17531802 | Ni Sepharose 6FF | 100ml |
| 17528202 | GSTrap HP | 5*5ml |
| 17513202 | GST Sepharose FF | 100ml |
| 28918780 | MBPTrap HP | 5*5ml |
| 28907548 | StrepTrap HP | 5*5ml |
| 29148721 | Superdex 75 Increase | 10/300 |
| 28990944 | Superdex 200 Increase | 10/300 |
| 29091596 | Superose 6 Increase | 10/300 |
参考文献:
Walls, Dermot; Loughran, Sinéad T. (2017). [Methods in Molecular Biology] Protein Chromatography Volume 1485 || Strategies for the Purification of Membrane Proteins. , 10.1007/978-1-4939-6412-3(Chapter 21), 389–400.