如今,新冠肺炎已成为全球人类健康重大威胁,全球科学家对其治疗、诊断、及药物的研究也正如火如荼地进行着。
我们先通过视频了解下病毒感染人类细胞的大致原理:
原视频来自于哔哩哔哩
早期研究已发现,新冠病毒与SARS病毒感染人类细胞都基于其表面的刺突蛋白(spike protein)与宿主细胞表面蛋白——血管紧张素转化酶-2(ACE2)结合而进入宿主细胞进行繁殖。ACE2作为如此重要的宿主受体,也一度成为科学家研究阻断病毒入侵通道的主要研究靶点。
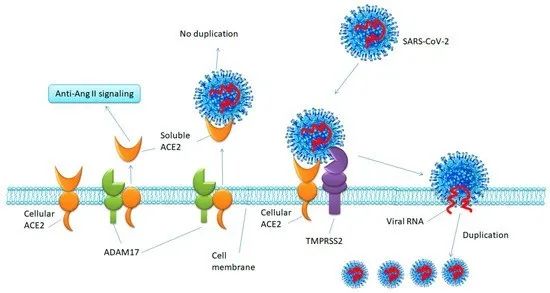
SARS-CoV-2病毒结合宿主ACE2受体
入侵宿主细胞进行繁殖
△点击放大图片
最近研究发现,新冠病毒感染的“入口”可能并不仅仅只有ACE2。来自芬兰赫尔辛基大学和德国慕尼黑工业大学的研究团队相继发现,新冠病毒的入侵还与一种细胞表面蛋白——神经纤毛蛋白-1(Neuropilin-1,NRP1)有密切联系。该发现为研究治疗COVID-19提供了新靶点,同时阻断ACE2和NRP1与病毒刺突蛋白的结合或将成为极具价值的治疗方案。
话不多说,下面先为大家解读一篇关于NRP1感染通路的高分文章。
01 神经纤毛蛋白-1(NRP1):新冠病毒SARS-CoV-2感染宿主细胞的受体之一

△点击放大图片

△点击放大图片
SARS-CoV-2病毒对宿主细胞的识别、粘附、渗透主要依靠病毒表面的刺突蛋白(S protein)。S protein会在受感染细胞上进行剪切过程,形成S1与S2亚基从而得到激活。在S1亚基上,剪切形成的C端序列Arg-Arg-Ala-Arg(RRAR)能与宿主细胞表面受体Neuropilin-1(NRP1)相互作用从而引导病毒进入。该文章运用免疫沉淀、定点突变、结构建模、抗体阻断等研究方法验证了这一说法。
实验方法:
1. 构建表达系统与HEK293T细胞系,稳固表达SARS-CoV-2 S protein。
2. 在NRP1全长序列C端标记GFP,免疫共沉淀(IP)验证NRP1-GFP与SARS-CoV-2 S protein的相互作用。
3. 基因工程敲除SARS-CoV-2 S protein S1亚基RRAR序列,IP验证NRP1-GFP与其连接明显下降。
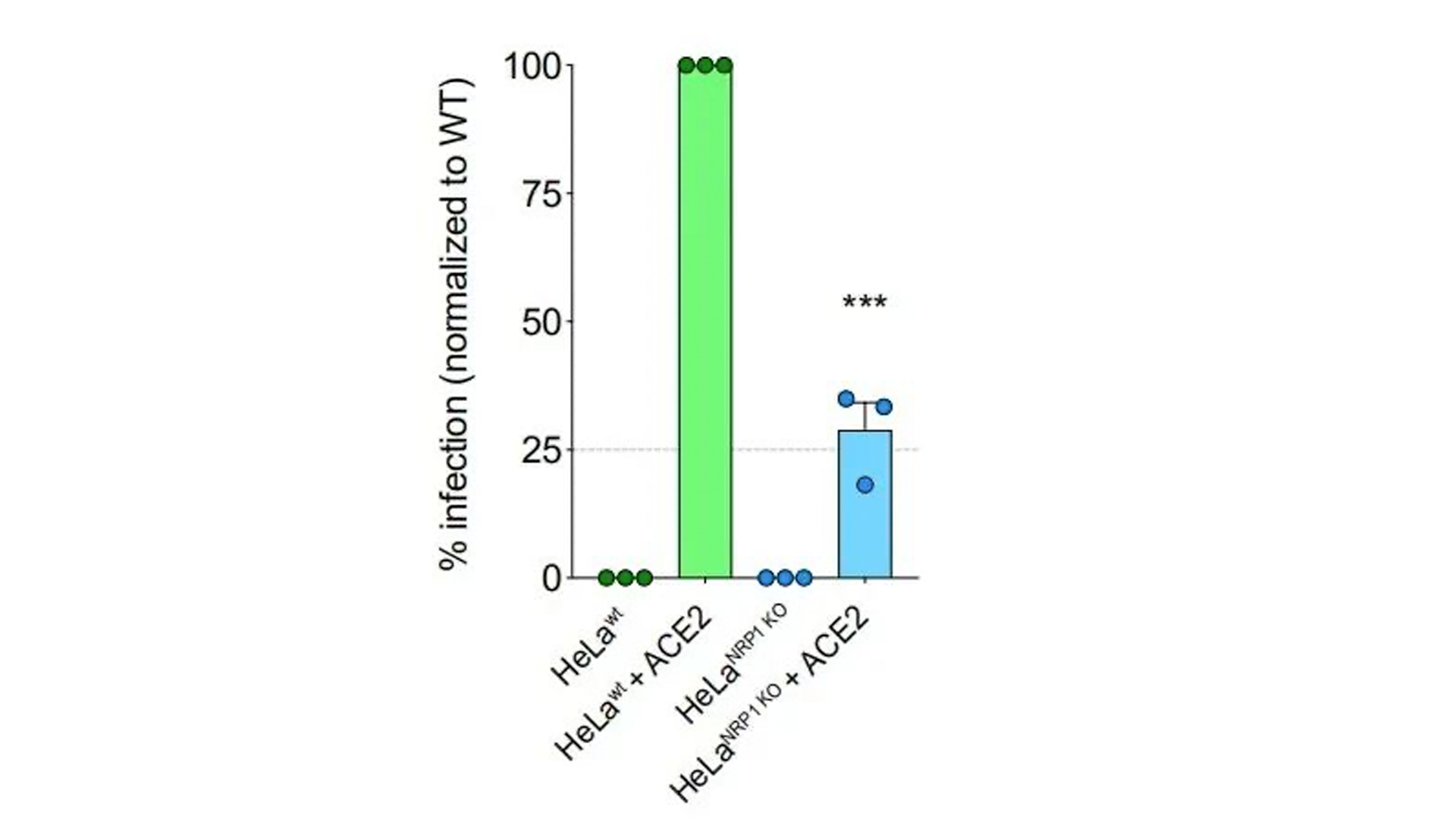
4. 构建能表达AEC2的野生型HeLa细胞系(HeLaWT+ACE2)与基因敲除ACE2的突变型HeLa细胞系(HeLaNRP1KO+ACE2)。Western Blot半定量比较ACE2与NRP1表达量。
5. SARS-CoV-2感染两种细胞系,共聚焦成像(confocal image)观察到HeLaWT+ACE2的感染率明显大于HeLaNRP1KO+ACE2。
6. Anti-NRP1抗体阻断NRP1与S1结合,细胞感染率明显下降。
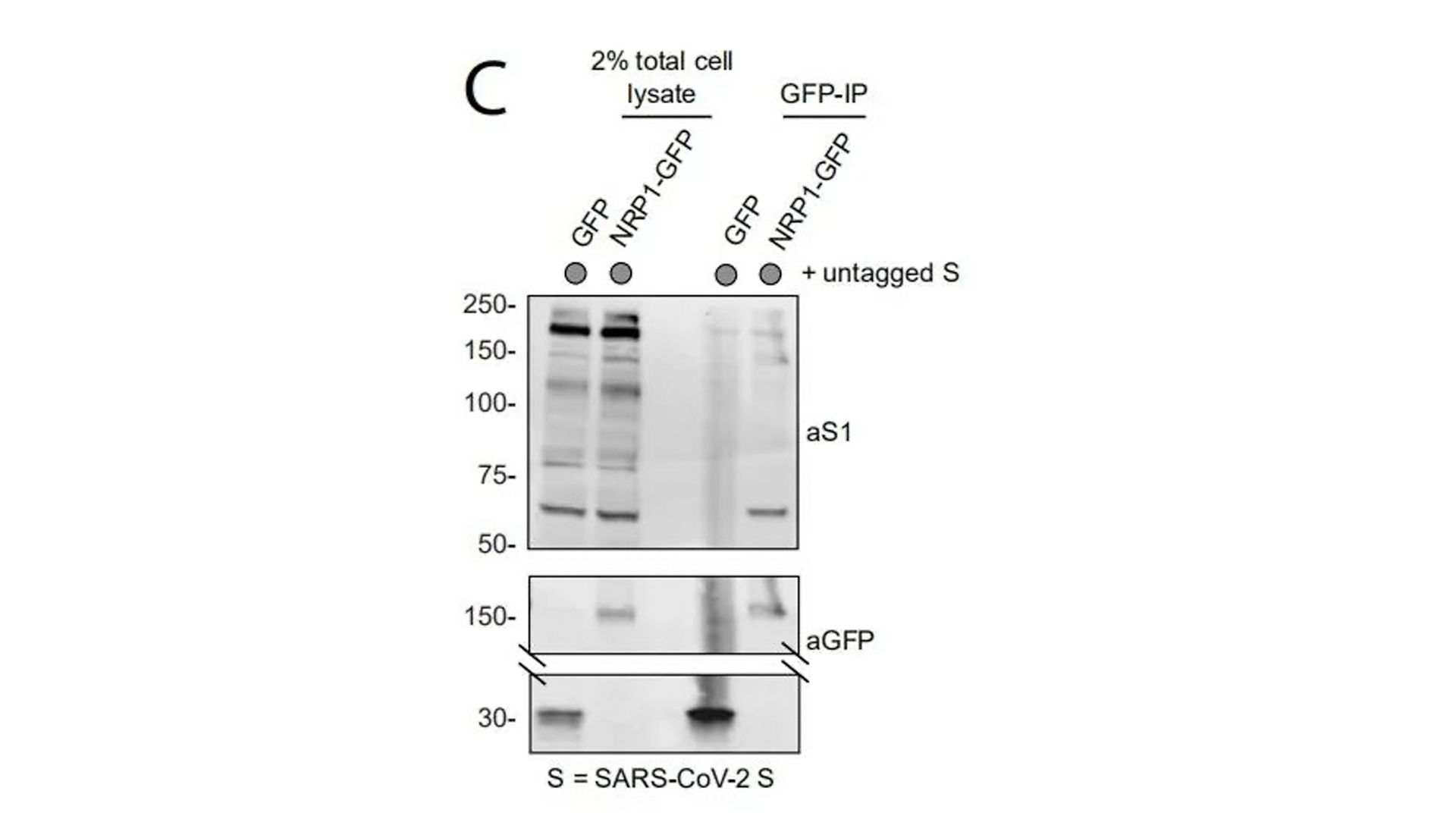
免疫共沉淀验证了NRP1-GFP与S protein的相互作用。
△点击放大图片
SARS-CoV-2 S1 C端RRAR结构域与NRP1 b1连接的分子模型
△点击放大图片
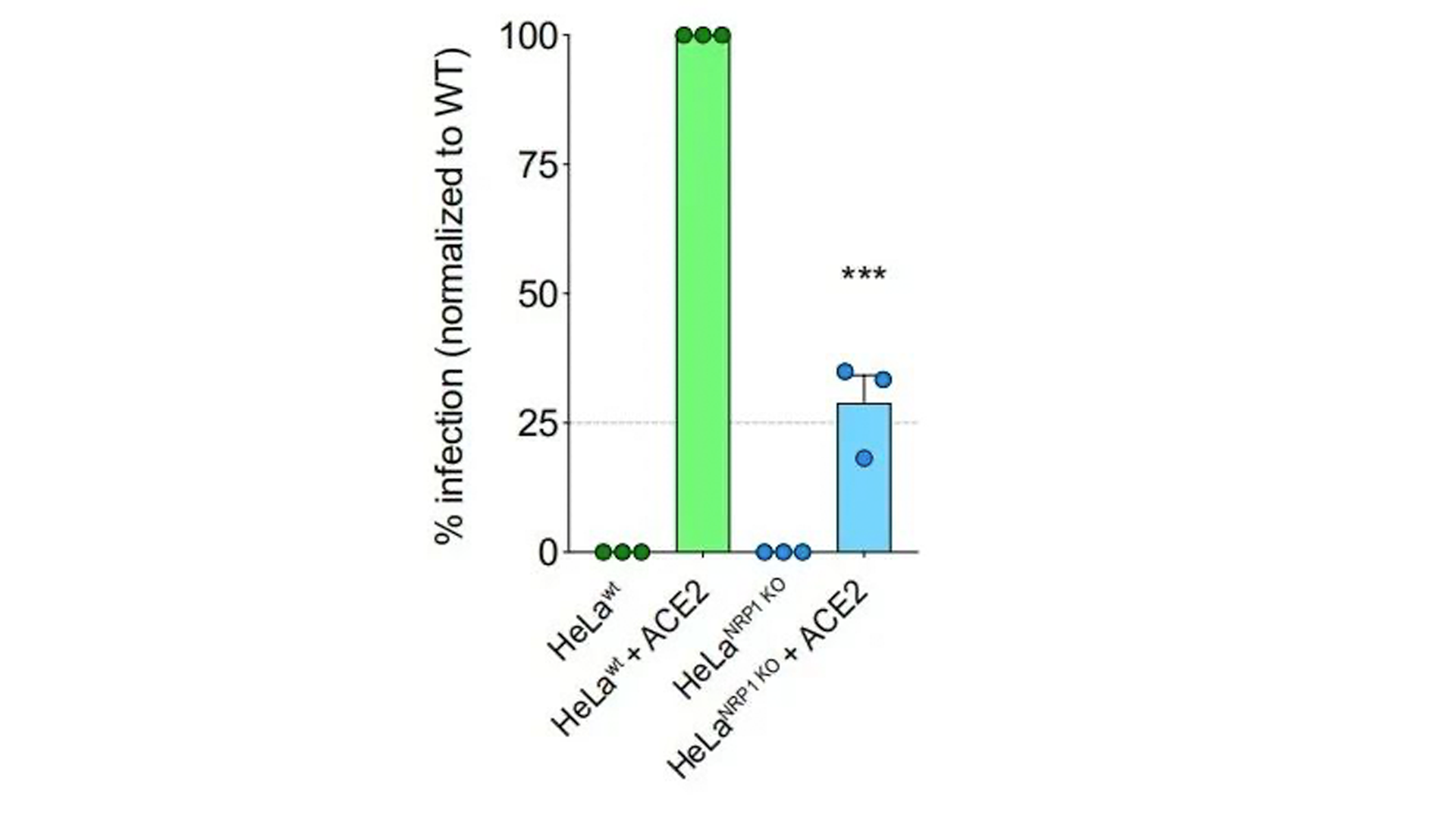
基因敲除NRP1细胞系的病毒感染率明显低于未处理的野生型。
△点击放大图片
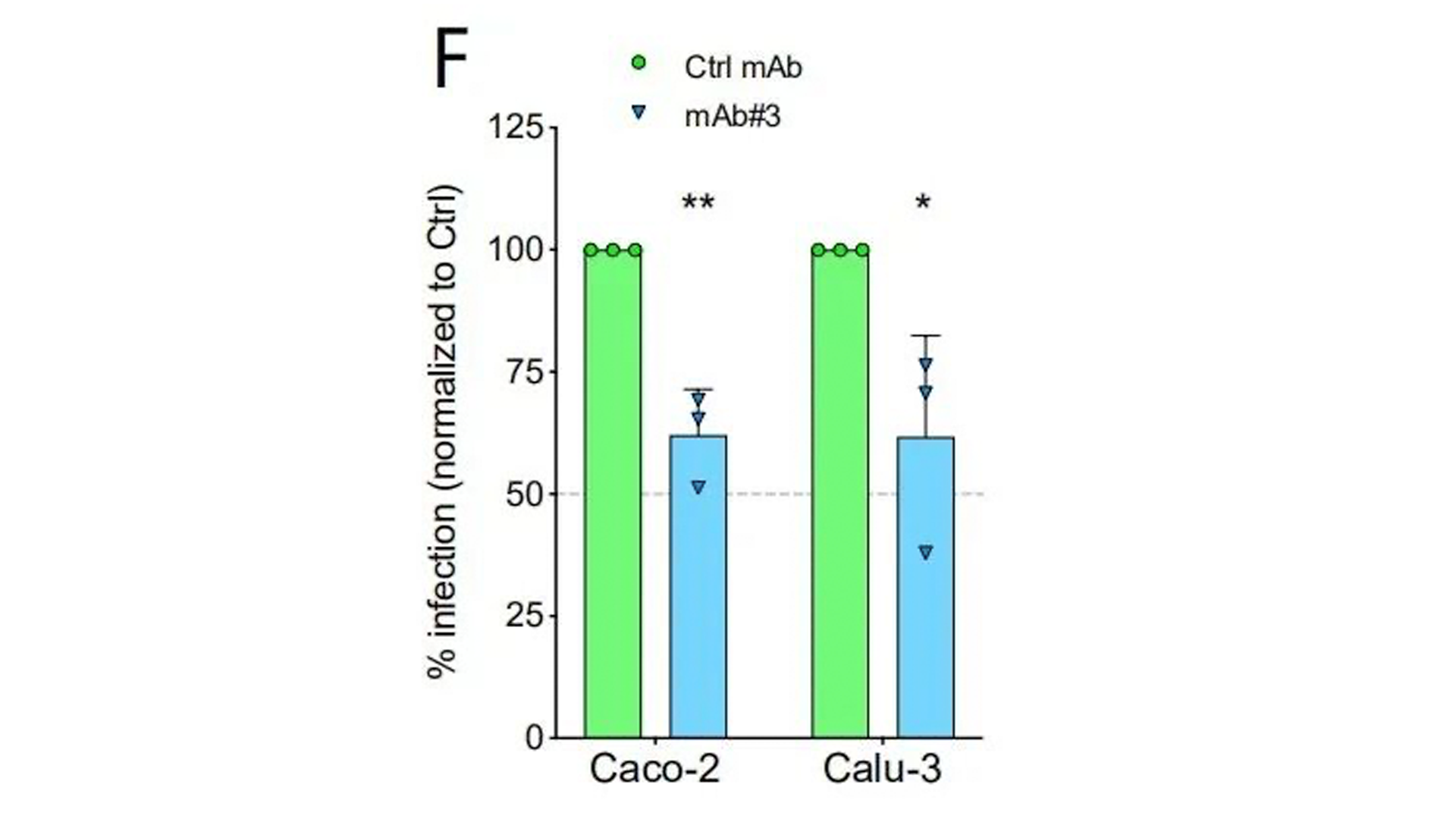
Anti-NRP1抗体阻断NRP1与S1的结果,病毒感染率下降。
△点击放大图片
该文章发现了新冠病毒入侵细胞的新途径,用各种实验方法与ACE2通道一起联合佐证了NRP1能与刺突蛋白S1亚基的C端固定序列结合。该发现为研究治疗新冠肺炎提供了新目标。
该文运用到的抗体、标记蛋白、细胞系、血清等产品小优也为您总结了出来。
该类研究相关产品推荐:
| 产品 | 品牌 | 货号 |
| Mouse anti-βactin | sigma-Aldrich | A1978 |
| Human ACE2(18-652) Recombinant Protein (hFc-Tag) |
CST | 99339s |
| ACE2(OTI1D6)Mouse mAb | CST | 15983s |
| mCherry (ESD8F)Rabbit mAb | CST | 43590 |
| GFP-trap,coupled to agarose | ChromoTek | gta-200 |
| Rabbit anti-NRP1 polyclonal antibody |
Absin | Abs137354 |
| SARS-CoV-2 s1 mAb | R&D System | MAB105403 |
| SARS-CoV-2 s2 mAb | R&D System | MAB10557 |
| SARS-CoV-2 RBD mAb | R&D System | LMAB10541 |
| Rabbit anti-SARS nucleocapsid (N) polyclonal antibody |
Rockland | 200-401-A50 |
| Fetal bovine serum | Sigma-Aldrich | F8318 |
| HAP1 knockout cell lines(ACE2) | Horizon | HZGHC59272 |
科学家对ACE2的研究也不断持续着,最近一篇发表于Cell杂志高达38.6分的文章对TMPRSS2蛋白酶对新冠病毒入侵机制的影响进行了研究。下面小优为大家进行解读。
02 SARS-CoV-2病毒入侵宿主细胞依靠ACE2和TMPRSS2,并可被蛋白酶抑制剂阻断

△点击放大图片
该文章研究发现,SARS-CoV-2病毒运用宿主受体蛋白ACE2进入宿主细胞,并且其丝氨酸蛋白酶TMPRSS2参与病毒刺突蛋白的剪切与激活。该研究已发现临床级TMPRSS2抑制剂能有效阻断病毒的侵入。此外,SARS痊愈患者血清也被发现能中和SARS-2-S刺突蛋白介导的病毒侵入。
实验方法:
1. 构建293T细胞系使SARS--S与SARS-2-S刺突蛋白能在其中稳固表达。
2. Western Blot验证SARS--S与SARS-2-S的表达,验证刺突蛋白亚基S1/S2的表达。
3. 生物信息学方法分析SARS--S与SARS-2-S序列。
4. 验证丝氨酸蛋白酶TMPRSS2对其剪切的位点,证明刺突蛋白在人类细胞内经蛋白酶作用发生有效蛋白水解过程,证明TMPRSS2对病毒进入细胞的激活作用。
5. 加入丝氨酸蛋白酶TMPRSS2抑制剂阻断其水解活性,进而阻断SARS-CoV-2对肺细胞的感染,验证蛋白酶抑制剂对病毒进入细胞的阻断作用。
6. 验证康复患者抗体对SARS-CoV-2的中和作用。
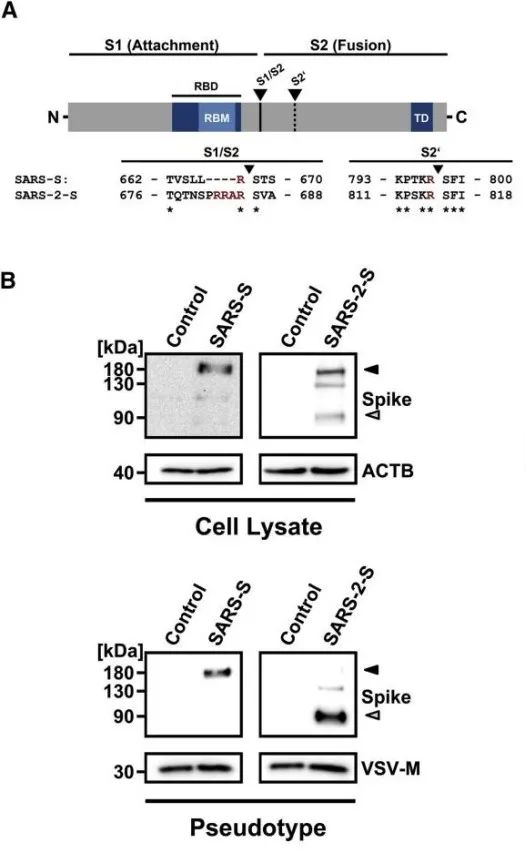
(A)序列分析SARS-S与SARS-2-S作用位点。箭头所指为蛋白酶剪切位点,星号为保守序列(RBD,receptor binding domain;RBM,receptor binding motif;TD,transmembrane domain)。
(B)免疫印迹验证SARS-2-S表达。WB抗体识别C端hemaggluinin(HA)标记。黑箭头所指为未剪切的S protein,灰箭头为S2亚基。
△点击放大图片
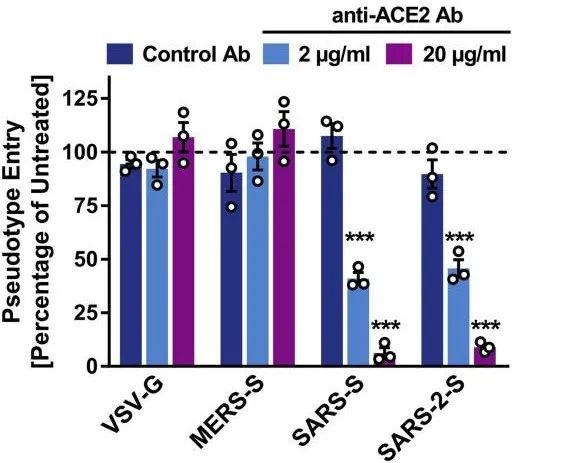
人血清anti-ACE2抗体阻断SARS-S和SARS-2-S进入细胞,而对对照组VSV-G与MERS-S无明显阻断效果。
作者对ACE2受体的研究进一步验证了新冠病毒刺突蛋白进入细胞的机制,发现了TMPRSS2对刺突蛋白的重要激活作用,其抑制剂能有效阻断病毒的入侵,为治疗或预防新冠肺炎提供了新视野。