前列腺癌仍然是世界上最普遍的男性恶性肿瘤。前列腺癌是全世界最常见的男性癌症之一,据估计,每年有1,600,000例前列腺癌新发病例。前列腺癌的临床病程具有高度异质性。惰性疾病的患者可以存活数年而无进展,而侵袭性疾病可以迅速转移并变得无法治愈。

图片来源于网络侵删
△点击放大图片
前列腺癌具有显著的临床异质性,表现为空间和克隆基因组多样性。相比之下,人们对前列腺肿瘤的转录组异质性知之甚少。
实验方法
组织处理
通过手术切除新鲜的组织样本,并保存在MACS组织存储液中,直到处理。简单地说,样品首先用磷酸盐缓冲盐水(PBS)洗涤,切碎成~1mm立方块,用以下方法酶消化:DNaseI,胶原酶IV,胶原酶I和30%胎牛血清在37°C下1小时,搅拌达到单细胞。
消化后,样品通过70µm的细胞过滤器进行筛选,并在300-500g下离心8min。取出上清液后,将颗粒细胞悬浮于红细胞裂解缓冲液中,孵育2min以裂解红细胞。用RPMI-1640培养基洗涤后,细胞微球在RPMI-1640培养基中重悬,并通过35-μm的细胞过滤器重新过滤。
对于BD Rhapsody平台,使用Calcein-AM和Draq7评估分离的单细胞的活力。用死细胞去除试剂盒进一步富集单细胞悬液。
单细胞RNA测序
第1批中的13个样本用10X基因组学进行测序;其余样本,包括第2批和第3批,用BD Rhapsody系统进行测序。单细胞捕获是通过有限稀释方法将单细胞悬液在>20万微孔中随机分布来实现单细胞捕获。将带有寡核苷酸条形码的珠子添加到饱和状态,使珠子与微孔中的细胞配对。加入细胞裂解缓冲液,使多聚腺苷化的RNA分子与珠子杂交。将珠子收集到一个单管中进行逆转录。在cDNA合成后,每个cDNA分子在5‘端(即mRNA转录本的3’端)标记有一个独特的分子标识符(UMI)和细胞标记和细胞标签,表明其细胞来源。采用BD Rhapsdy单细胞全转录组扩增流程制备全转录组文库。简而言之,合成第二链cDNA,然后连接WTA适配器进行通用扩增。用18个周期的PCR扩增接头连接的cDNA产物。利用全转录组扩增产物的随机引物PCR制备测序文库,富集与细胞标记和UMI相连的转录本的3’端。在生物分析仪2200系统上使用高灵敏度DNA芯片和Qubit高灵敏度DNA分析对测序文库进行定量。每个样本的文库用HiSeqXTen进行150bp的配对端测序。
流式细胞术和分选
对前列腺癌组织进行切碎,用胶原酶和DNase消化。细胞悬液通过100-μm的细胞过滤器过滤,并在1200r.p.m.下离心对于5min。沉淀在流式细胞术和分选(荧光激活细胞分选;FACS缓冲液(1%胎牛血清/1640培养基)中重悬,通过70μm细胞过滤器过滤,用FACS缓冲液洗涤一次。然后对重悬的细胞进行PSMA-AlexaFluor488和CD8-PerCP/Cy5.5的染色。用FACS缓冲液洗涤三次后,制备的细胞悬液通过40μm细胞过滤器过滤,并由索尼细胞分选器SH800S处理。分别将PSMA+CD8+细胞和PSMA-CD8+细胞置于15ml离心管中。
为了检测CD31和CD90的表达,将106个细胞与5μl的FITC抗人CD31在室温下孵育30min。和PE/cy7抗人CD90的5μl。同时以非特异性同型匹配的对照免疫球蛋白-g孵育细胞的5μl作为对照。在PBS缓冲液中洗涤细胞两次,去除未结合的抗体。
CD8+T细胞的分离
使用抗CD8磁珠(MACS,Miltenyi)从健康供体的人外周血中收集CD8+T细胞,并用TransActT细胞试剂(Miltenyi,130-111-160)激活24小时。活化的T细胞在X-VIVO15培养基中培养,其中添加10%胎牛血清、1%青霉素-链霉素和抗人白细胞介素-2。
前列腺癌中的单细胞转录组

△点击放大图片
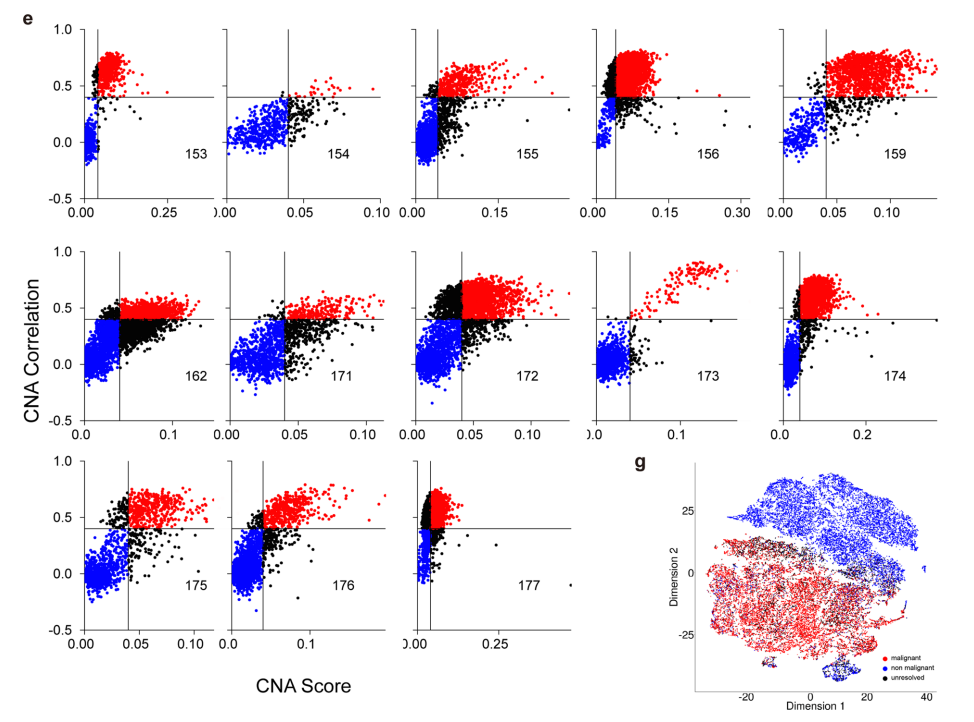
为了了解单细胞前列腺癌分辨率的异质性,收集12例患者的13例(12例原发性和1例淋巴结转移)组织样本,并进行了单细胞RNA测序(scRNA-seq)。经过标准的数据处理和质量控制程序,获得了36,424个细胞的转录组谱,T-SNE视图颜色由样本(a)、簇(b)和宽谱系(c)。
d,肿瘤中细胞的推断CNA156。
e,指示样本中每个细胞的CNA评分和相关性。
f,相对于黑色素瘤,强CNA改变的基因组比例明显更小,使信号较弱,更容易被稀释和阈下CNA评分的影响。
g,36424个单细胞的tSNE视图,颜色编码推断细胞恶性肿瘤身份。
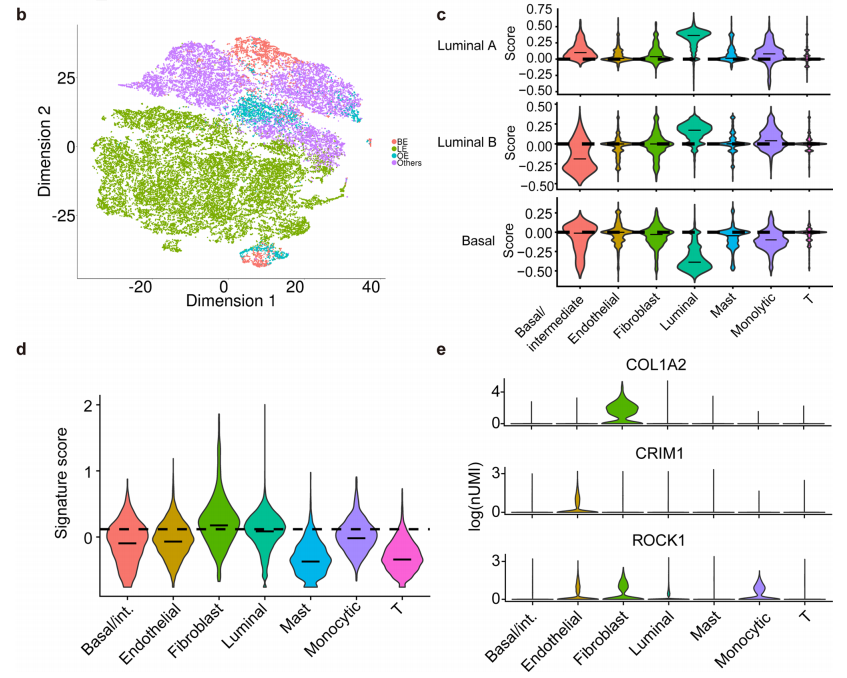
不同细胞类型的基因表达和特征分析

△点击放大图片
a,热图显示了每个细胞中“T细胞共刺激”过程中27个基因的相对丰度。顶部的颜色条表示细胞类型,左边的颜色条表示基因的平均UMI。
b,36,424个单细胞的tSNE视图,正如预期的那样,腔内肿瘤是大多数肿瘤的主要上皮细胞类型。
c,观察到非上皮成分的PAM50基础特征的高信号。
d,类似地,由先前的显微解剖分析得出的高Gleason评分(GS)相关的基因特征在基质中最高。
e,19个基因中有3个在TME细胞中优先表达。
表征不同的上皮细胞来源的程序
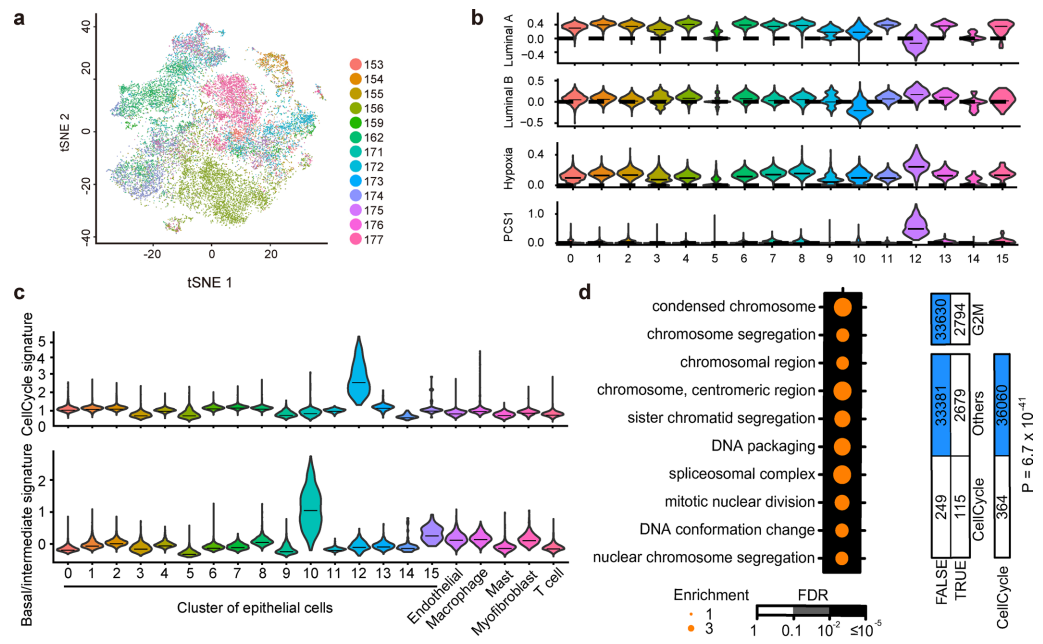
△点击放大图片
a,23,674个上皮细胞的t-SNE视图,大多数集群由来自多个患者的细胞组成,这表明了一个无偏倚的细胞亚群代表。
b,图中定义的4个前列腺癌相关特征的平滑分布。为了确定与差异临床结果相关的细胞亚群,比较了不同集群中多种前列腺癌亚型相关特征的表达。
c,所示 signatures、TME和上皮细胞分别按其指定的细胞类型和簇分组。
表征基础/中间特征
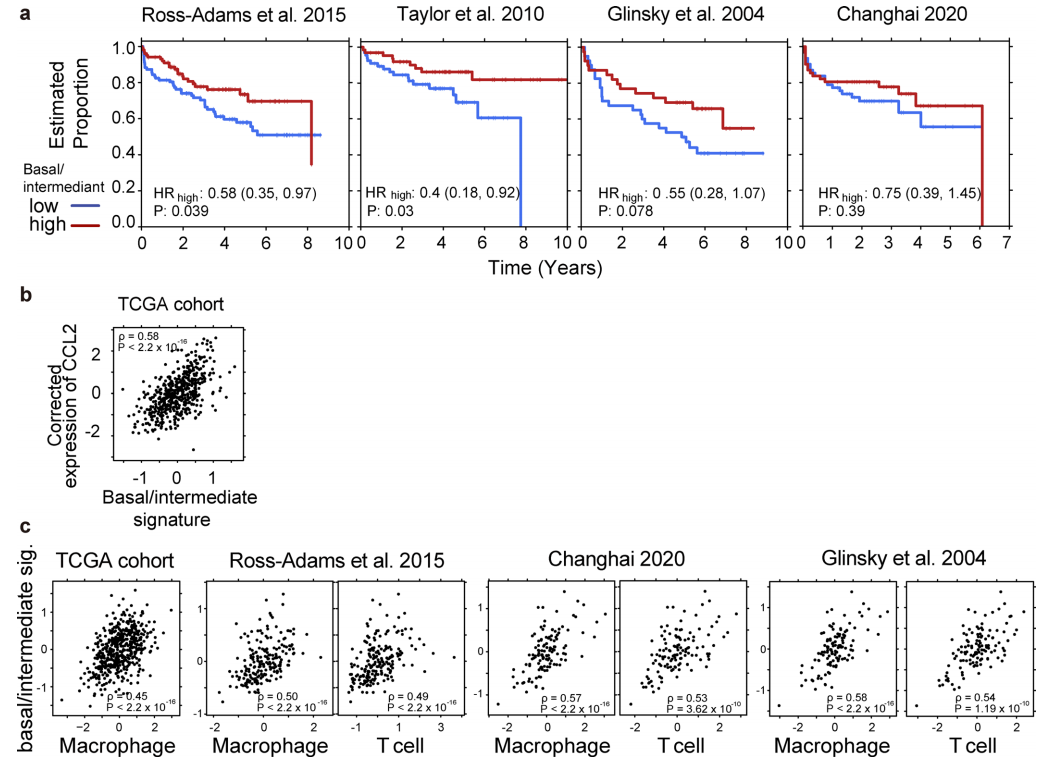
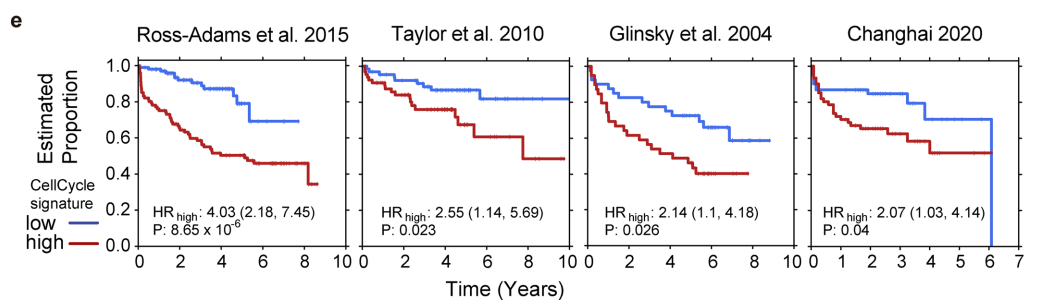
△点击放大图片
a,分析了另外四种癌症类型的公共scRNA-seq数据:头颈部鳞状细胞癌(HNSCC)、非小细胞肺癌(NSCLC)、结肠直肠癌(CRC)和肝细胞癌(HCC)。在所有四种癌症类型中,T细胞中肿瘤标记基因的表达,这表明这可能是浸润性T细胞转录组的一个一般特征。
b,肿瘤纯度校正的CCL2表达与TCGA中基础/中间特征之间的相关性。在去除浸润的基质细胞对CCL2的影响后,这种较高的相关性仍然存在。
c,跨多个数据集的巨噬细胞、T细胞和基础/中间签名之间的相关性。
scRNA-seq揭示了免疫成分的异质性
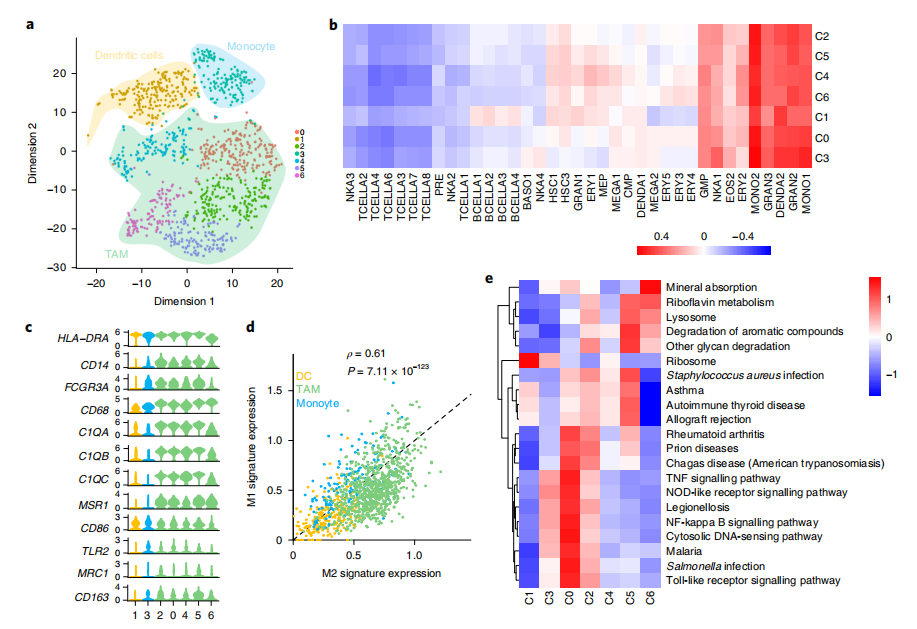

△点击放大图片
a,单核细胞的tSNE视图,按亚型的颜色编码。
b,单核细胞簇与不同分类的免疫细胞上的大量rna序列的相关性。
c,单核细胞相关标记基因丰度的平滑分布。
d,M1和M2之间的相关性,其中每个点代表一个单元格。
e,所有TAM簇之间的差异激活通路。只显示了激活得分高于0.1的通路。
f,标记基因的表达水平。
g,3116个T细胞的tSNE视图,通过重新评估的簇,进行颜色编码。
h,不同t细胞群的表征,其簇按亚型排序和分组。
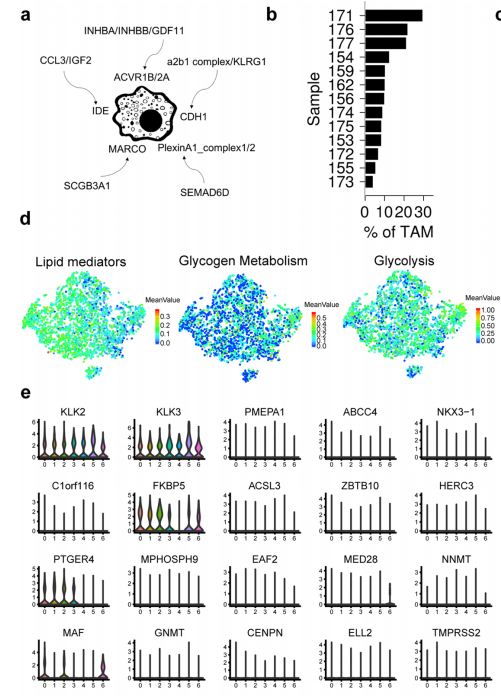
△点击放大图片
a,所有C6特定输入信号的示意图。单核/巨噬细胞谱系分化为OCs与活跃的配体-受体相互作用有关。
b,每个样本中C6TAM细胞的百分比。诱导巨噬细胞进入OCs的主要途径OC抑制已被证明。可以延缓前列腺癌的骨转移。事实上,C6TAM在所有样本中都可以检测到,表明早期发生的TME重构有助于肿瘤的扩散。
c,差异激活的代谢相关通路。
d,3116个T细胞的tSNE视图,颜色由脂质介质、糖原代谢和糖酵解基因的平均表达量编码。
e,AR特征基因丰度的平滑分布,细胞按簇分组。
f,模块61中的基因。线长和圆圈大小对应KLK3与指示基因的表达相关性。
对T细胞中KLK3的表达进行分析
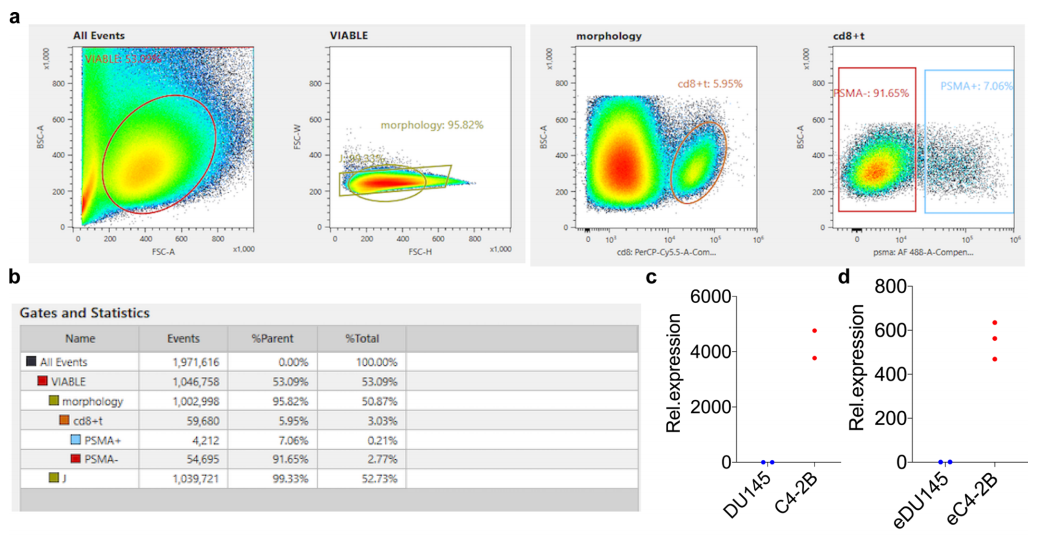
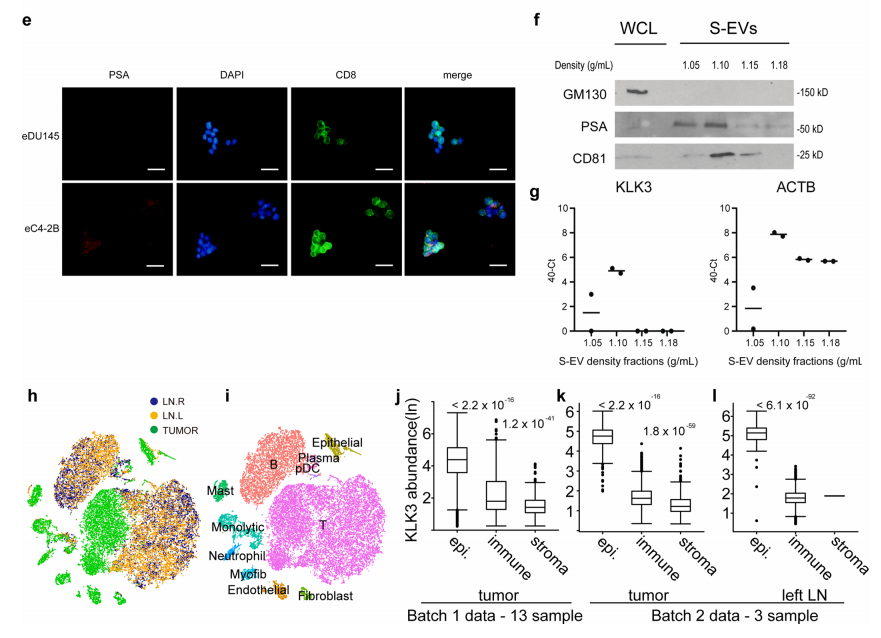
△点击放大图片
(a) 和PSMA+CD8T细胞的统计
(b) KLK3在前列腺癌细胞系
(c) 和由此衍生的ev
(d) 相对表达
(e) 用荧光显微镜检测与上述前列腺癌细胞系的ev共培养后的T细胞(CD8+,绿色)中的KLK3蛋白。
(f) C4-2Bev中小ev富集蛋白(CD81)和耗尽蛋白(GM130)EM的免疫印迹。通过差分离心和密度梯度纯化收集的ev。装载1µg蛋白用于全细胞裂解液(WCL)。tSNE视图显示来自高危前列腺癌患者(SC001H)的细胞。
(i) 肿瘤细胞与淋巴结样本有明显的分离。
(j) 与ev介导的表达相一致,KLK3在T细胞和其他TME中的丰度远低于上皮细胞
癌症分型为癌症生物学提供了有价值的见解,并告知治疗计划。基因组学和转录组学研究揭示了以突变和异常转录为特征的前列腺癌亚型。最近,PAM50分类器被用于将前列腺癌亚型为预后组,具有对治疗敏感性的预测能力。此外,大量数据代表了来自肿瘤和微环境(TME)的信号的集体反映,后者可能是肿瘤侵袭性的一个强大的驱动因素。
本文分析了来自13个前列腺肿瘤的36,424个单细胞的转录组,并确定了疾病侵袭性的上皮细胞。肿瘤微环境(TME)显示了多个与进展相关的转录组程序的激活。值得注意的是,我们观察到了KLK3的混杂表达,并验证了癌细胞改变t细胞转录组的能力。
细胞间存在着密切的细胞间通信。发现一个内皮亚群与肿瘤细胞具有活跃的通信(激活的内皮细胞,aECs)。结合对另外11个样本的测序,发现aECs在去势抗药前列腺癌中富集,并促进癌细胞侵袭。
Reference:Single-cell analysis reveals transcriptomic remodellings in distinct cell types that contribute to human prostate cancer progression.