背景:传统上,CD4+T细胞在单细胞水平上的转录组学和蛋白质组学特征主要由两种独特的技术完成:单细胞RNA测序(scRNA-seq)和基于抗体的细胞术。在这里,我们提出了一种多组学的方法,允许同时靶向定量单细胞中的mRNA和蛋白的表达,并研究其性能,以解剖人类免疫细胞群的异质性。
图片来源于网络侵删
△点击放大图片
样本:
1例系统性红斑狼疮(SLE)患者,1例T1D患者和1例自身抗体阴性的健康供体(14岁男性),对来自JDRF糖尿病基因、自身免疫和预防(D-GAP)进行研究。
流式细胞术评估CD4+T细胞中4名成年健康供体;Treg体外扩增试验在三名成年健康志愿者中进行。
方法:
使用AbSeq检测从血液中分离的43,656个原代CD4+T细胞和31,907个CD45+细胞中定量基因的单细胞表达。我们探索了这种靶向scRNA-seq方法的敏感性,以剖析人类免疫细胞群的异质性,并确定功能性T细胞分化的轨迹。
单细胞RNA测序(scRNA-seq)的出现为在单细胞水平上研究全球转录谱提供了一个前所未有的机会。与基于细胞术的技术仅限于同时检测多达几十个蛋白质标记相比,scRNA-seq技术允许在最近的一次分析整个转录组。
scRNA-seq的出现已被证明对塑造我们对人类免疫系统的复杂性和功能的理解具有革命性的意义。然而,目前,执行这些实验的成本升高和仅依赖转录数据,都对这些技术的广泛实际适用性提出了重大挑战。在这项研究中,本文提出了一种综合的、经济有效的方法,使用AbSeq技术,在单细胞水平上敏感地评估数百个关键免疫靶点的mRNA和蛋白的同时表达。
细胞制备和流式细胞仪分选
1. 对低温保存的外周血单个核细胞(PBMCs)进行细胞制备和FACS分选T细胞检测。
2. 冷冻保存的PBMCs在37°C下解冻,用1%热灭活、过滤过的人AB血清在X-VIVO15(Lonza)中重悬。
3. 用磁珠通过阴性选择分离总CD4+T细胞,并与固定活性染料eFluor780在室温下孵育15min。
4. 在含有0.02%BSA的PBS中洗涤后,细胞在5mLFACS管(Falcon)中染色,用用于细胞分选的荧光色素偶联抗体和BDAbSeq寡聚偶联抗体。
5. 使用BDFACSAria融合分选器在4°C进入1.5mLDNA低结合埃彭多夫管,该管包含500μLX-VIVO和1%热灭活,过滤的人AB血清。
6. 细胞分选后,将三个评估的T细胞亚群与样本标签抗体孵育,在冷BD样品缓冲液中洗涤3次并计数。
7. 将样本汇集。
8. 细胞亚群在96孔圆底组织培养板(20000个细胞/孔)中,37°C,在X-VIVO中培养90min,X-VIVO中5%热灭活,过滤人AB血清,PMA和离子霉素细胞刺激鸡尾酒,在没有蛋白质转运抑制剂。
9. 将细胞收集到FACS试管中,用冷BD样品缓冲液洗涤,并根据制造商的说明进一步与BD AbSeq寡聚偶联抗体孵育。
cDNA文库的制备与测序
10. 使用BD rhapsody表达单细胞分析系统进行单细胞捕获和cDNA文库制备。
11. 简单地说,使用人类免疫反应引物面板扩增10个周期,玻璃体刺激细胞9个周期,包含399个引物,针对397个不同的基因。
12. PCR1产物用AMPureXP磁珠纯化,根据不同的珠比(分别为0.7×分离各自的mRNA和AbSeq/样品×)。
13. 对纯化的mRNA和样本TagPCR1产物进行进一步扩增(10个循环),通过大小选择纯化的PCR2产物(mRNA和样本标签文库分别为1×和1.2×)。
14. 使用Qubit和安捷伦4200标签站系统评估PCR产物的浓度、大小和完整性。
15. 最终产物归一化为2.5ng/μL(mRNA)、0.5ng/μL(样品标签)和0.275ng/μL(AbSeq),并进行最后一轮扩增(mRNA6个周期,AbSeq测序制备最终文库。
16. 最终的文库使用Qubit和安捷伦标签位库进行定量,并汇集,以达到最终浓度为5nM。
17. 最终的文库加入10%的PhiX对照DNA以增加序列复杂度,并在HiSeq4000测序仪上进行测序。
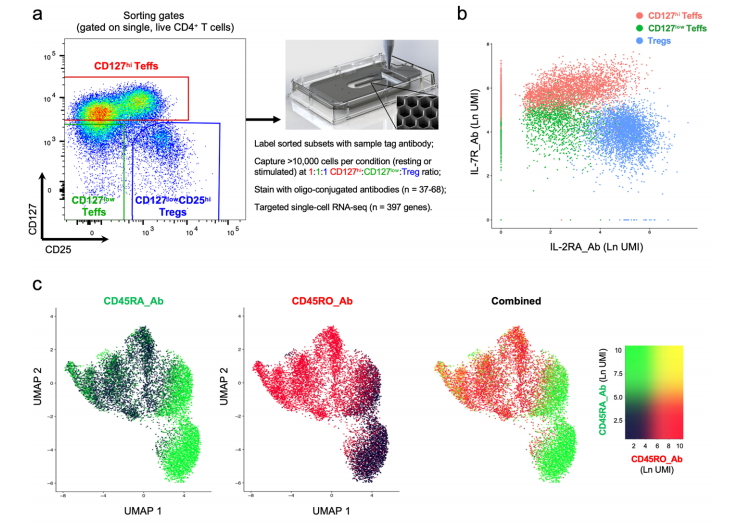
结合单细胞转录和蛋白质组学免疫表型,提供了血液中人类原代CD4+T细胞的高分辨率图谱
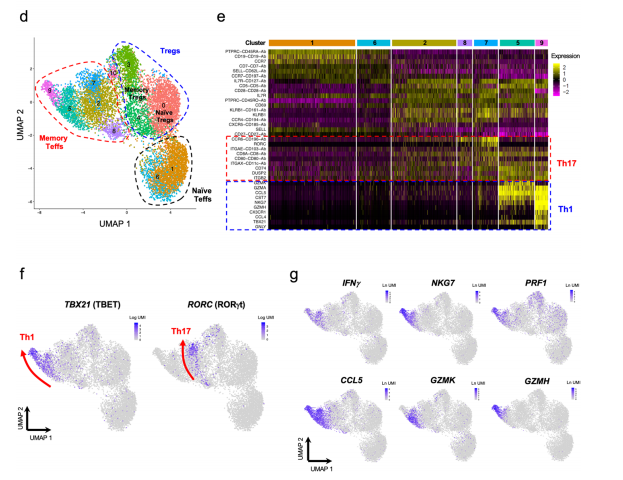
△点击放大图片
a.FACS图描述了分离三个已评估的CD4+T细胞群的分选策略。
b.使用寡聚偶联抗体(AbSeq)在蛋白水平上描述IL-7R和IL-2RA表达的二维图。细胞根据各自的分类门着色,使用寡偶联样本标记抗体进行评估。
c.UMAP图,使用蛋白质组学和转录组学数据描述所有捕获的CD4+单细胞的聚类。图中描述了使用AbSeq技术获得的CD45RA(黑色到绿色)和CD45RO(黑色到红色)亚型的表达水平。
d.从(SLE)患者血液中分离的静息初级CD4+T细胞聚集的UMAP图。虚线描绘了幼稚的Teff(黑色)、记忆的Teff(红色)和Treg(蓝色)簇,并根据它们各自的蛋白质和mRNA表达谱进行了手动注释。
e.显示每个静息CD4+Teff簇中前10个差异表达基因的热图。
f.UMAP图描述了CD4+T细胞谱系定义转录因子TBET(Th1)和RORγt(Th17)在静止的CD4+T细胞中的表达。箭头概括了Th1和Th17分化的轴,并支持各自谱系限制性转录因子(TBET和RORγt)的表达梯度和图3所示的假时间分析确定的发育轨迹。
g.效应型细胞因子转录本IFNG、NKG7、CCL1、GZMH和GZMK在静息CD4+T细胞中的表达。
集成的单细胞靶向多组学方法确定了人类CD4+调节性T细胞(Treg)激活的轨迹
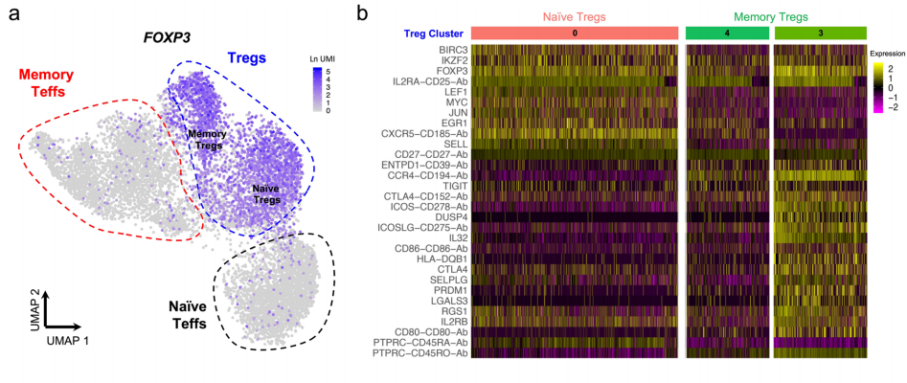
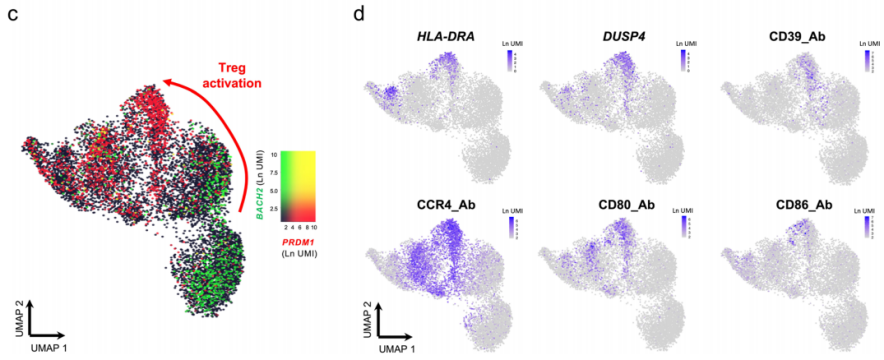
△点击放大图片
a. UMAP图,描述了典型的Treg转录因子FOXP3在已鉴定的静息CD4+T细胞簇中的表达。朴素和记忆Treg簇的注释如图1c所示。
b. 热图显示三个确定的静止Treg簇中前10个差异表达基因的基因,如图1d所示。
c. UMAP图显示CD4+T细胞转录因子BACH2和PRDM1的覆盖表达。
d. 活化treg簇中高差异表达基因表达的说明性例子,包括mRNA水平上的HLA-DRA和DUSP4,蛋白水平上的CD39、CCR4、CD80和CD86.
分析显示体内CD4+T细胞分化的不同轨迹
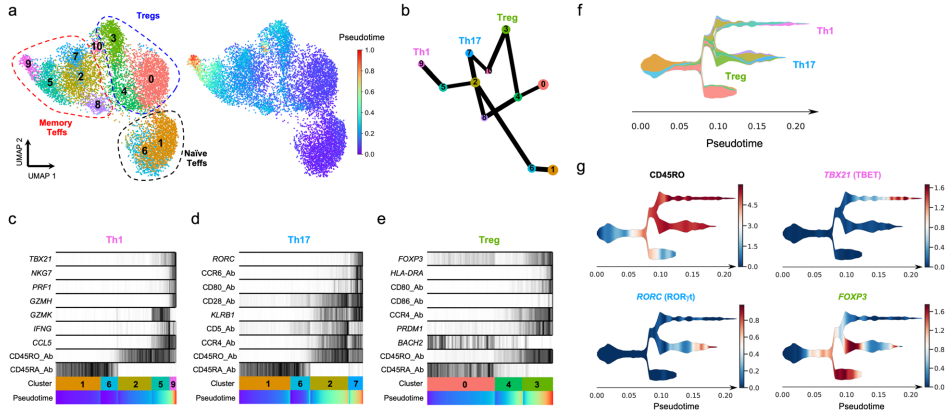
△点击放大图片
a UMAP图描述了所鉴定的T细胞簇中每个单个细胞的推断扩散假时间。
b 重建已识别的T细胞簇之间的发育轨迹的图。边缘权值表示在集群之间存在连接时的置信度。采用基于分区的图抽象(PAGA)方法对转录和蛋白质组学数据进行分析。
c-e重建了已鉴定的Th1(c)、Th17(d)和Treg(e)谱系分化的PAGA路径。每个轨迹都描述了谱系特异性转录因子和所选择的差异表达基因的表达。
f 使用单细胞轨迹重建(流)方法识别的谱系分化轨迹的示意图。颜色编码对应于a.a中描述的聚类分配.
g 与记忆相关的CD45RO亚型和谱系特异性转录因子TBX21、RORC和FOXP3的表达.
共刺激分子CD80和CD86的表面表达标志着体内激活的treg的一个子集
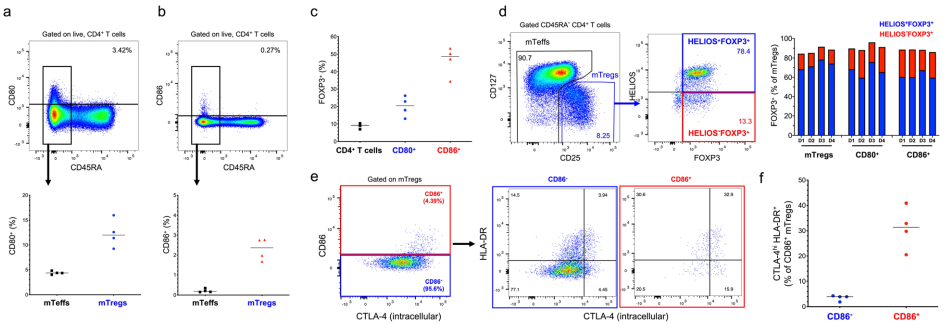
△点击放大图片
a,b通过流式细胞术检测来自4个健康供体的CD4+T细胞中B7分子CD80(a)和CD86(b)的体外表达。散点图描述了CD45RA-Teff和CD45RA-CD127lowCD25+Tregs群体中CD86+T细胞的频率。
c散点图描述了FOXP3+细胞在总细胞、CD80+和CD86+CD4+T细胞中的频率。
d 根据典型的Treg转录因子FOXP3和螺旋体的细胞内表达来描述Treg亚群的门控策略。散点图描述了在总mTregs、CD80+mTregs和CD86+mTregs中,4个供体中HELIOS+FOXP3+和HELIOS-FOXP3+亚群的频率。
e 通过流式细胞术检测CD86+和CD86- mtregs中CD86和CD4+T细胞激活标志物CTLA-4和HLA-DR的共表达。
f 散点图描述了CD86+和CD86- mtregs中CTLA-4hiHLA-DR+细胞的频率。通过细胞内免疫染色检测CTLA-4的表达。
一种罕见的具有公认的免疫调节特性的循环CCR9+T细胞亚群的特性
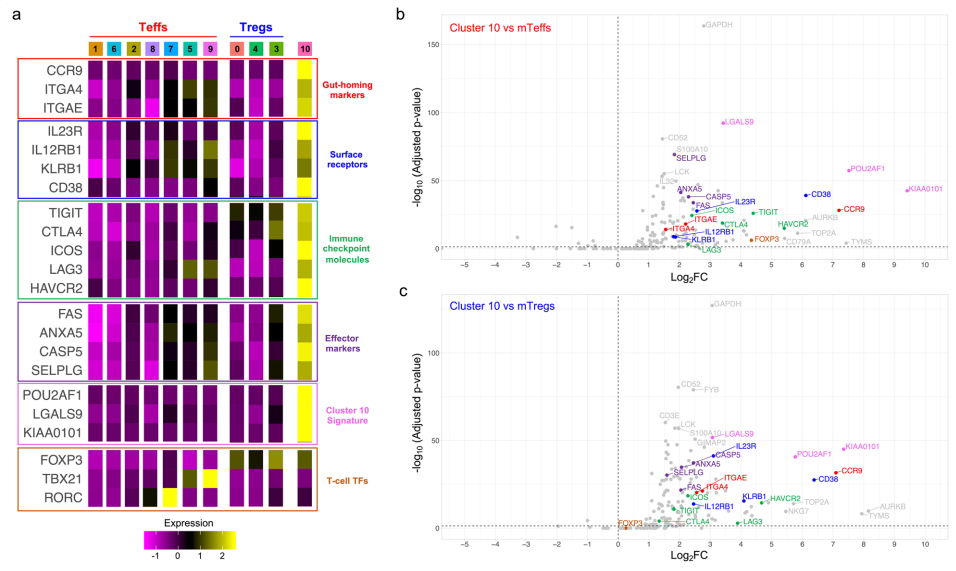
△点击放大图片
热图描述了簇10中选择的差异表达基因的每个已识别的T细胞簇的平均比例表达。根据其功能注释将标记分为肠道归巢标记、表面受体、免疫检查点分子、T细胞效应标记、10簇标记基因和T细胞转录因子。b,c火山图描述了簇10和mTeff(b)或mTreg(c)簇之间被评估的mRNA转录本的差异表达。
靶向scRNA-seq和蛋白质组学方法在从血液和组织中分离出来的CD45+免疫细胞的异质群体中描述了不同的功能亚群
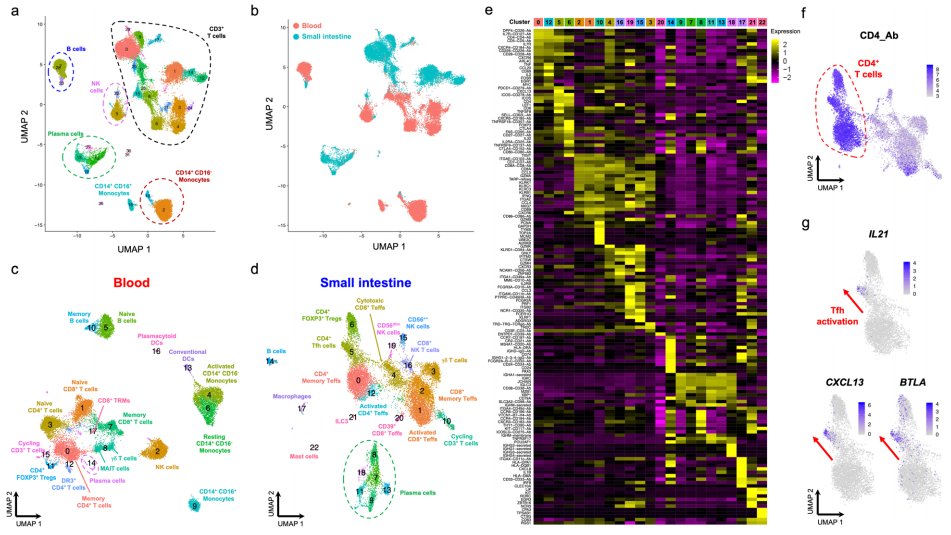
△点击放大图片
a UMAP图描述了靶向scRNA-seq的聚类,以及从血液中分离的总CD45+细胞(n=31,907)的转录数据,以及两名活动性疾病(CD)患者的配对十二指肠活检。
b样本标签信息识别从血液或配对的十二指肠活检中分离出来的样本。
c-d UMAP图显示从血液(c)或配对十二指肠活检(d).中分离的CD45+细胞聚集
e显示从十二指肠活检中分离出的CD45+免疫细胞中每个鉴定簇的前10个差异表达基因的热图。
f从小肠分离的CD3+T细胞中CD4蛋白水平(AbSeq)的表达。
g Tfh效应基因IL21、CXCL13和BTLA在组织驻留的CD4+T细胞中的表达梯度。
结论:
在这项研究中,结合目标scRNA-seq和蛋白质表达分析提供了人类原代CD4+T细胞的高分辨率图谱,并确定了血液和组织中Th1、Th17和调节性T细胞(Treg)分化的精确轨迹。这种多组学方法提供的敏感性鉴定了CD4+treg表面的B7分子CD80和CD86的表达,进一步证明了B7的表达有可能识别最近在循环中激活的T细胞。示识别CD80/CD86表达激活treg和一种罕见的CCR9+T细胞亚群,血液组织归巢特性和假定的免疫调节功能。
Reference:Discovery of CD80 and CD86 as recent activation markers on regulatory T cells by protein-RNA single-cell analysis.