01 新冠之肺纤维化
提到肺纤维化,不得不和最近的新冠联系起来。确实,新冠患者很大一部分由于进行性肺纤维化而死亡。
在一份新冠患者的临床研究中,4%的急性呼吸窘迫综合征(ARDS)患者1周之内就已经发现纤维化,24%的患者在1到3周之间发现肺纤维化,61%的患者在大于3周的病程中发现。研究呼吁,为了有效干预肺纤维化,相关措施应该在ARDS发作的第一周内就实施。
前段时间有个纪录片,全程记录了新冠患者崔志强从患病到康复出院的过程,他也是首位达到出院标准的肺移植患者。移植手术的时候,医生就提到,他的肺已经灰中泛黑,高度纤维化、萎缩、变小。
02 什么是肺纤维化
如果看完上面那个视频,许多同学们一定有很多疑问,什么是肺纤维化,为什么要肺移植?
肺纤维化是一种极难治疗且死亡率高的肺部疾病。它的特征是由疤痕形成引起的肺部结构的进行性和不可逆性破坏,最终导致器官功能衰竭,气体交换中断和呼吸衰竭而死亡。
特发性肺纤维化(IPF)是一种病因不明的特别严重的肺纤维化,诊断后的平均生存期仅2.8年。当前,可用于进行性肺纤维化的唯一有效疗法是肺移植。这是难题,也是契机。
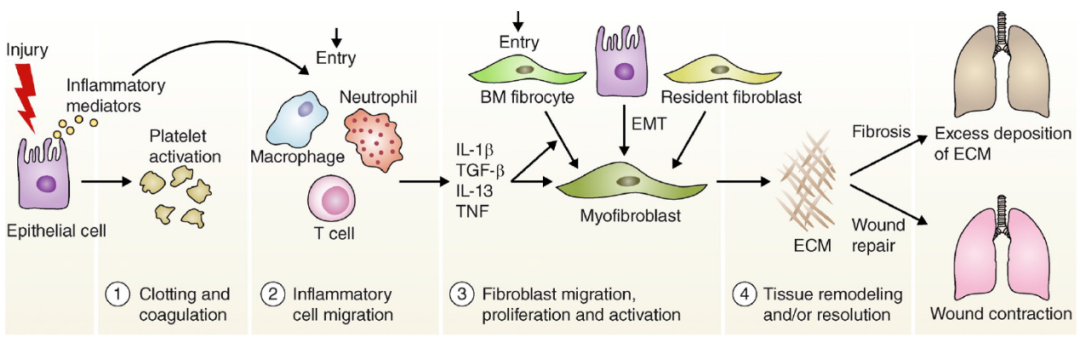
损伤修复四阶段
△点击放大图片
我们先来看看正常情况下肺组织是如何损伤再生修复的?损伤修复有四个不同的阶段,包括凝血期,炎症期,成纤维细胞迁移/增殖阶段,以及正常组织结构的最终愈合阶段。
凝血期:组织损伤后,上皮细胞/内皮细胞开始释放炎性介质,从而启动抗纤溶-凝血级联反应。
炎症期:炎症细胞的浸润,血小板激活会促进血管扩张和增加的通透性,从而使炎症细胞(例如嗜中性粒细胞,巨噬细胞,淋巴细胞和嗜酸性粒细胞)聚集损伤部位。
成纤维细胞的增殖和激活:这些炎症细胞会产生各种细胞因子和趋化因子,这些因子会放大炎症反应并触发成纤维细胞增殖和募集。这里有个重要的EMT转化过程,就是上皮细胞转分化为成纤维细胞样细胞。一旦成纤维细胞被激活,它们就会转化为成肌纤维细胞,表达α-SMA和ECM成分。
伤口愈合阶段:成肌纤维细胞促进伤口收缩,伤口边缘向中心迁移,上皮/内皮细胞分裂并迁移至ECM基质上,从而使受损组织再生。
以上是正常修复的四个阶段,但俗话说“过犹不及”,当修复过程过度且一发不可收拾时,就会发生纤维化。
03 肺纤维化如何上手研究
如果你是刚进实验室的新人,研究方向也正好是肺纤维化,那一定是我们的缘分,赶紧往下看吧。如果你发现室友/同学正在为肺纤维化头疼,赶紧把这篇文章转发给TA吧。
首先我们要知道如何造模型。许多科研工作者都是在小鼠/大鼠中进行建模和研究,包括药物(博来霉素),颗粒物(石棉和二氧化硅),辐射,闭塞性细支气管炎和慢性移植物抗宿主诱发肺纤维化。
博来霉素应该是使用最多,最经典的模型药物了,它本身是一个化疗抗生素,但是在使用过程中,发现了约有10%的患者出现肺毒性,最后可能会约1%的患者发展为肺纤维化,所以现在广泛用于肺纤维化造模。
一般通用的造模方式是麻醉动物后,剪开颈部皮肤,暴露气管,直接注射博来霉素,1.2-1.25U/kg,缝合皮肤,3周以后取肺检测。当支气管肺泡灌洗液(BALF)细胞数量(主要是中性粒细胞,淋巴细胞等)和胶原蛋白沉积明显增高时可以视为造模成功。造模成功是第一步,成功了才能进行下一步的机制研究。
分子机制千千万,我们怎么去选择呢?别慌,看看小优的吐血整理。
转化生长因子-β(TGFβ)
近二十年来众多研究表明TGF-β在发病过程中起着重要作用,TGF-β可以促进上皮细胞的活化,增殖和分化,促进成肌纤维细胞的增殖,促进细胞外基质(ECM)如胶原蛋白、纤粘连蛋白的表达和抑制ECM的降解。TGF-β在细胞生长和分化伸出了众多只手,只手遮天(调控),即使不做纤维化,应该也有了解过TGFβ的强大功能。
看到这,也许你有疑问,既然TGF-β做的这么透彻,那么直接用TGF-β抑制剂不就行了?现实情况是TGF-β抑制剂从实验到临床的进度非常缓慢,可能是IPF的起因太复杂,也可能是动物模型和人类疾病尚有很大差异,目前仍然没有批准的药物可以临床使用,所以机会留给了大家。
既然讲到了TGFβ,那么和TGFβ有关的miRNA我们必须得提一下。研究表明,miR-21在IPF患者的肺部和博来霉素诱导的肺纤维化小鼠中异常表达,这和TGFβ密切相关。而miR-21的靶基因是几种抑癌基因,异常表达的miR-21可以增强成纤维细胞的增殖和分化,以及凋亡抗性,从而加剧纤维化,所以关于miR-21抑制剂也是一个值得研究的点。
关键词:TGFβ,miR-21
推荐产品:
| 名称 | 货号 |
| TGF-β Antibody | 3711 |
| TGF-B1 Quantikine ELISA | DB10OB |
| miRNeasy Mini Kit | 217004 |
| TGF-β Fibrosis Pathway Antibody Sampler Kit | 77397 |
炎性介质
特发性或全身性硬化肺纤维化患者的手术活检和血清中都检测到了TNF水平升高。在小鼠体内,过表达细胞因子的小鼠会发展成进行性肺纤维化。TNF抑制剂可以抑制成肌纤维细胞的胶原合成,可以阻断某些肺纤维化的形成,但在一些研究中也发现,TNF抑制剂会使疾病恶化,所以这里也是个需要研究和优化的创新点。
和TNF一样,IL-1β,趋化因子KC和MIP-2,都在疾病中发现表达增加。有研究者已经使用IL-1R1、MyD88、ASC、Caspase-1和Nalp3敲除小鼠说明了炎性小体和炎性因子在肺纤维化中的重要作用。
IL-17A在肺纤维化患者的支气管肺泡灌洗液中发现有增加。随后,在小鼠实验中,验证了IL-17A和IL-17RA发挥了重要作用。
这里,讲一个有意思的点,尽管IL-17A的主要来源是γδT细胞(啥是γδT?百度一下),但是研究发现,CD4+ Th17细胞才是在肺纤维化中IL-17A的主要来源,而且进一步研究发现γδT细胞分泌的IL-22可以保护肺纤维化。所以在疾病模型中,这两种细胞和因子似乎上演了一出无间道,这里也是值得深挖的一个点。
关键词:TNF,IL-1β,趋化因子,炎性小体,IL-17A
推荐产品:
| 名称 | 货号 |
| Mouse TNF-alpha Quantikine ELISA Kit | MTAOOB |
| TNF-α(D5G9) Rabbit mAb | 6945 |
| Mouse IL-1 beta/lL-1F2 Quantikine ELISA Kit | MLBOOc |
| IL-1β(D3U3E) Rabbit mAb | 12703 |
| Mouse CxCL1/KC Quantikine ELISA Kit | MKCOOB |
| cxCL1/CxCL2(E5MGD) Rabbit mAb | 24376 |
| NLRP3(D4D8T) Rabbit mAb | 15101 |
| Mouse IL-17A/F Quantikine ELISA Kit | M17AFO |
| Mouse Chemokine Panel 31-Plex | LX-12009159 |
| Mouse Cytokine 23-plex Assay | LX-M60009RDPD |
| Human Reactive Inflammasome Antibody Sampler Kit ll | 25620 |
| Mouse Reactive lnflammasome Antibody Sampler Kit | 20836 |
氧化应激
氧化应激会使炎症反应持续进行,从而加剧纤维化。我们前面讲到的NLRP3炎性小体其实就是受到活性氧(ROS)的驱动,而ROS是由线粒体和NOX酶产生的。有研究表明,NOX4在小鼠模型以及人IPF中都很活跃,而且,NOX4也是TGFβ1的下游,促进成肌纤维细胞分化和ECM合成。
最近也有研究报道,谷氧还蛋白(GLRx)活性在纤维化的肺中大大减少, PSSG随之增加。缺少GLRx的小鼠对博来霉素或者过表达活性转化生长因子β-1(AdTGFB1)诱导的肺纤维化更加敏感,而相反,肺上皮细胞中GLRx的转基因过表达减弱了纤维化。进一步研究发现,直接给予GLRx可以逆转肺纤维化。
关键词:氧化应激,ROS,NOX4,GLRx
推荐产品:
| 名称 | 货号 |
| Cellular ROS Assay试剂盒 | ab113851 |
| Reactive Oxygen Species (ROS) Detection Assay Kit | K936 |
| Nox4 Antibody | NB110-58849 |
| Glutaredoxin 1 antibody | ab45953 |
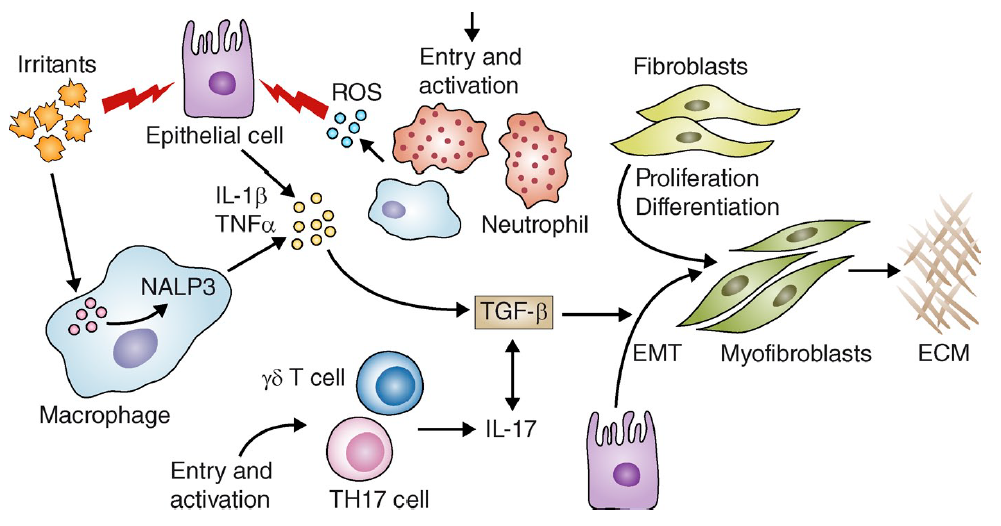
肺纤维主要机制汇总
△点击放大图片
以上都是研究的比较多的机制,还有一些其他机制也值得我们去探究:
Wnt信号通路
Wnt-β-catenin信号通路也是诱导EMT的一个重要信号通路。有研究报道,使用了WISP1的中和抗体后,能够减轻博莱霉素诱导的小鼠肝纤维化。相同的,整合素α3β1也是EMT的一个重要诱导因素,所以这两个有望成为新的靶点。
DNA甲基化
有科研工作者对纤维化肾脏中的成肌纤维细胞进行了全基因组甲基化扫描,揭示了几种独特DNA甲基化修饰。其中一种就是对Rasal1的表达沉默,从而诱导RAS这种致癌基因的表达增加,导致成纤维细胞的增殖和分化。有研究报道,DNA甲基转移酶抑制剂可以保护小鼠纤维化。这是一个比较直接的靶点了,做表观遗传的同学们可以深入研究一下。
肺微生物
俗话说“遇事不决,量子力学;机制不明,肠道菌群”,如果以上机制你都没有兴趣,可以试试最近热门的肠道菌群。有研究报道肺微生物群会促进IPF的发展。菌群失调会促进肺泡炎症和异常修复,因此肺微生物群的调节也可能是治疗的新靶点。
推荐产品:
| 名称 | 货号 |
| β-Catenin (D10A8) XPRRabbit mAb | 8480 |
| -Catenin Antibody Sampler Kit | 2951 |
| lntegrin a3Antibody | MAB1952 |
| lntegrin β1Antibody | 4706 |
| lntegrin a4(D2E1)XPRRabbit mAb | 8440 |
| lntegrin β4(D8P6C)XPRRabbit mAb | 14803 |
| Integrin β3(D7X3P)XPRRabbit mAb | 13166 |
| Integrin β5(D24A5)Rabbit mAb | 3629 |
| Wnt3a (C64F2) Rabbit mAb | 2721 |
| Wnt Signaling Antibody Sampler Kit | 2915 |
| 5-methylcytosine(5-mC)抗体 | ab73938 |
04 后话
小优主要列举了研究比较多的一些机制,如果只是简单做下药效和机制的,可以选择一条最明显的通路去套用(研究),这样发个三五分的文章不是问题。如果要更近一步,需要找到确定的靶点,敲除和过表达,多层次验证肯定少不了的。如果做着做着,发现多个蛋白的相互嵌套关系,多条通路的相互作用,可以冲一冲一区的杂志了。
当然,各位同学如果志在CNS,建议不要参考以上经典机制,创新是最重要的,需要从现象到机制再到解释现象,讲一个完整的,别人没有听过的故事。
参考文献
1.George PM, et al. Pulmonary fibrosis and COVID-19: the potential role for antifibrotic therapy. Lancet Respir Med. 2020 Aug;8(8):807-815.
2.Wynn TA. Integrating mechanisms of pulmonary fibrosis. J Exp Med. 2011 Jul 4;208(7):1339-50.
3.Antje M, et al. The bleomycin animal model: a useful tool to investigate treatment options for idiopathic pulmonary fibrosis? Int J Biochem Cell Biol. 2008;40(3):362-82.
4.Border WA, et al. Transforming growth factor beta in tissue fibrosis. N. Engl. J. Med. 1994,331:1286–1292.
5.Kisseleva T, et al. 2008. Mechanisms of fibrogenesis. Exp Biol Med. (Maywood). 233:109–122.
6.Liu G A, et al. miR-21 mediates fibrogenic activation of pulmonary fibroblasts and lung fibrosis. J Exp Med. 2010, 207:1589–1597.
7.Bringardner BD, et al. The role of inflammation in the pathogenesis of idiopathic pulmonary fibrosis. Antioxid. Redox Signal. 2008 10:287–301.
8.Anathy V, et al. Reducing protein oxidation reverses lung fibrosis. Nat Med. 2018 Aug;24(8):1128-1135.
9.Kim KK, et al. Epithelial cell alpha3beta1 integrin links beta-catenin and Smad signaling to promote myofibroblast formation and pulmonary fibrosis. J Clin Invest. 2009, 119:213–224.
10.O'Dwyer DN, et al. Lung Microbiota Contribute to Pulmonary Inflammation and Disease Progression in Pulmonary Fibrosis. Am J Respir Crit Care Med. 2019 May 1;199(9):1127-1138.