作为分子互作检测的金标准,Biacore基于表面等离子共振技术(SPR)可以实时、无标记、定量地表征分子间相互作用,目前已经被中国、美国和日本药典收录。借着在线双背景扣除、灵敏度高、数据重现性佳、功能全面等绝对优势,Biacore逐渐成为基础科研中发表高分文章的的“夺金”利器。目前,已经为超过 4 万篇文献发表和上百种大小分子药物上市提供了可靠的数据支持。
自新冠疫情爆发以来,Biacore已经在病毒入侵机制,病毒蛋白结构基础研究,新冠病毒治疗性药物的研发,包括抗体药物和小分子药物的筛选、表征、竞争等研究中都发挥了重要作用。接下来小优会在病毒入侵机制研究、药物研发、疫苗生产及质控等方面,带大家领略下Biacore在新冠研究领域的丰功硕果哟!
01 病毒入侵机制研究和抗体药研发
清华大学张林琦教授团队在两年内连续发表6篇SCI,包括2篇《Nature》、1篇《Immunity》、2篇《Nature Communications》与1篇《Cell research》,利用Biacore全面解析了新冠病毒入侵机制、筛选并分离了新冠中和抗体、解析了新冠抗体中和机制、探究了新冠病毒突变株逃逸抗体中和的分子机制并解读了新冠病毒公共抗体及病毒突变的关系。
A. 病毒入侵机制解读
2020年3月,课题组在《Nature》上发表文章《Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor》[1] ,用Biacore直接表征了新冠病毒RBD与ACE2受体相互作用的过程(图1),揭示了ACE2是特异性介导新冠病毒侵染细胞的结构基础,为治疗性抗体药物开发以及疫苗的设计奠定了坚实基础。
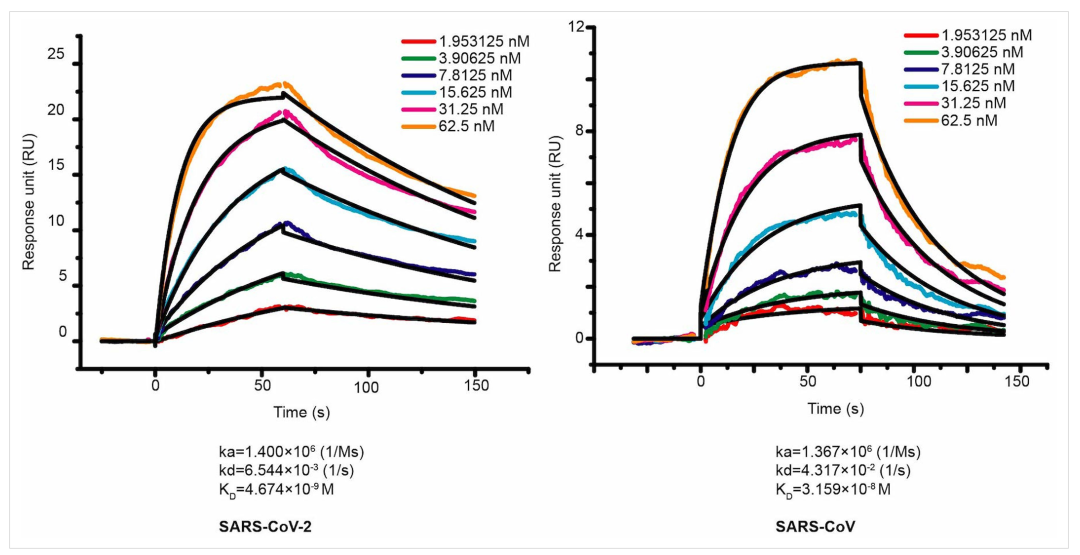
图1 SARS-CoV-2 RBD、SARS-CoV RBD与ACE2的动力学表征
△点击放大图片
B. 抗体筛选及表位鉴定分析
2020年5月,课题组在《Nature》上发表文章《Human neutralizing antibodies elicited by SARS-CoV-2 infection》[2] 。研究人员从8例SARS-CoV-2感染者的单个B淋巴细胞中分离并鉴定出了206个特异性靶向RBD的单克隆抗体,发现这206个单克隆抗体的中和活性与其竞争ACE2结合RBD的能力密切相关。研究人员借助Biacore巧妙的设计了表位鉴定(epitope binning)和竞争筛选实验(competition screen)(图2),助力找到一系列高活性中和抗体(P2C-1F11、P2B-2F6、P2C-1A3等)。
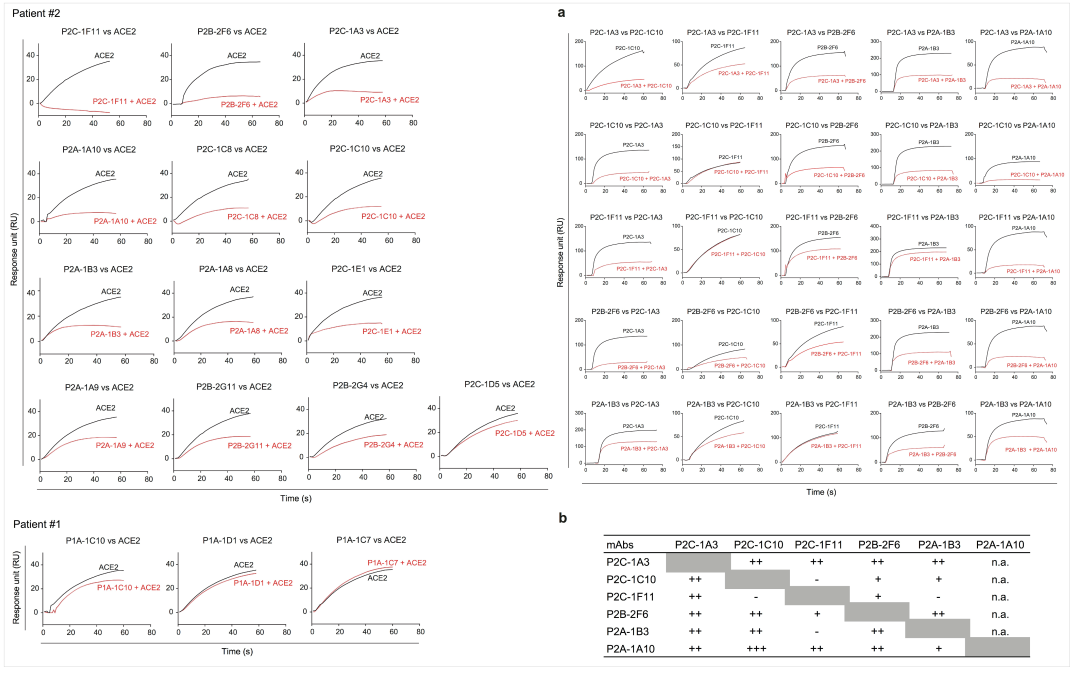
图2 中和抗体与ACE2的竞争作用及表位鉴定分析
△点击放大图片
C. 抗体中和机制解读
2021年3月,课题组在在《Cell research》发文:《Structural basis for bivalent binding and inhibition of SARS-CoV-2 infection by human potent neutralizing antibodies》[3] 。针对从8例新冠病毒感染者的B细胞中分离并鉴定出了206株特异性靶向RBD的单克隆抗体,研究课题组解析了10株靶向SARS-CoV-2 RBD的高效中和抗体与Spike蛋白的复合物结构,利用Biacore完成了这些抗体与RBD的动力学表征及ACE2的竞争分析实验(图3),深入研究了IgG形式二价抗体结合S蛋白的结构基础与其诱导S1蛋白脱落(Shedding)的可能分子机制。类似的研究还有2021年1月在《Nature Communications》上发表的文章《Antibody neutralization of SARS-CoV-2 through ACE2 receptor mimicry》[4] 。
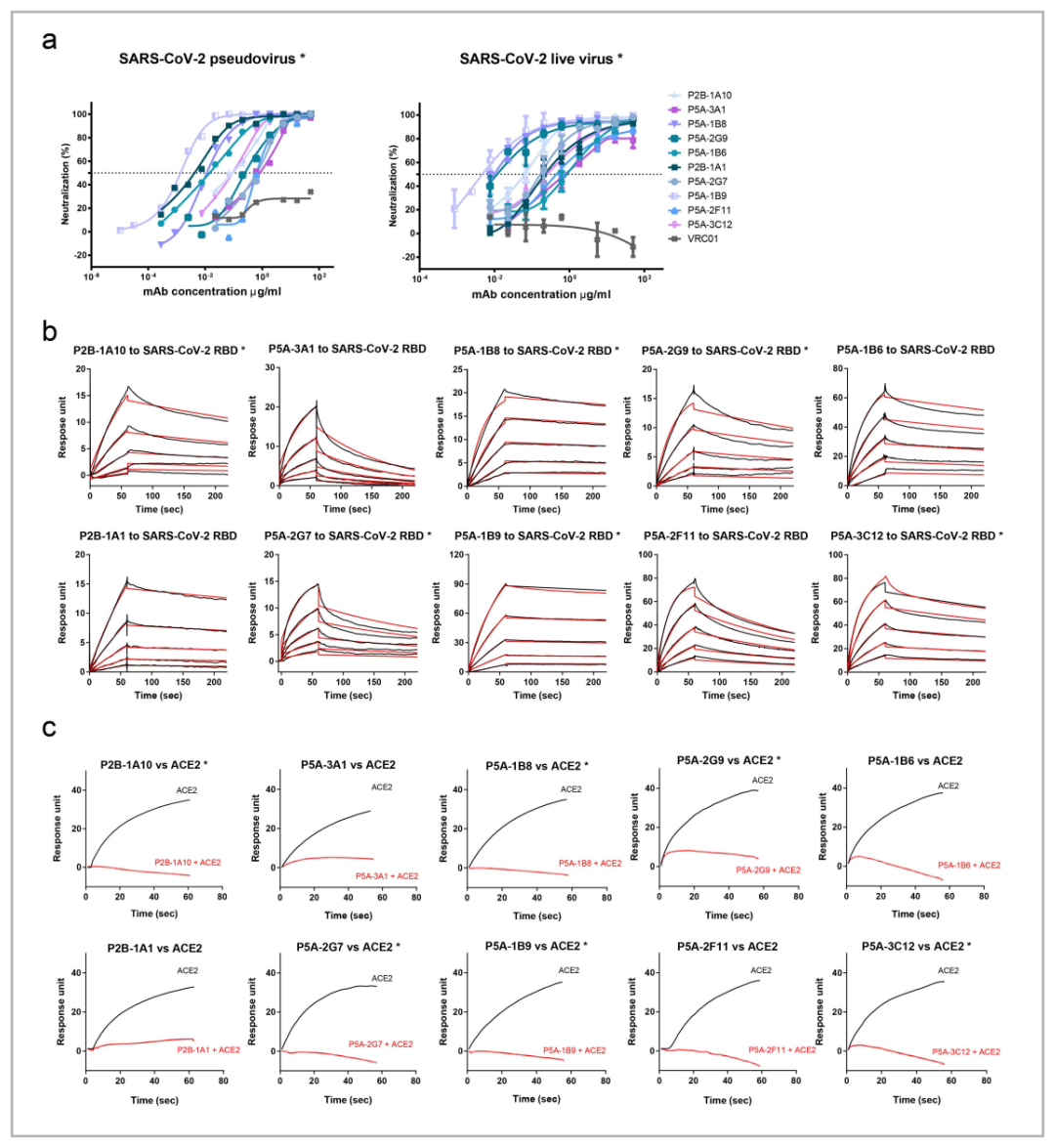
图3 10株中和单抗与SARS-CoV-2 RBD的动力学表征及与ACE2的竞争分析
△点击放大图片
D.新冠病毒突变株逃逸抗体中和的分子机制
2021年6月,研究团队在《Immunity》上发表文章《Analysis of SARS-CoV-2 variant mutations reveals neutralization escape mechanisms and the ability to use ACE2 receptors from additional species》[5] 。研究人员通过假病毒中和实验、解析免疫复合物晶体结构、借助Biacore设计并完成动力学表征实验等(图4),从细胞水平、原子水平、分子水平逐一解析了新冠病毒突变株逃逸抗体中和的分子机制。
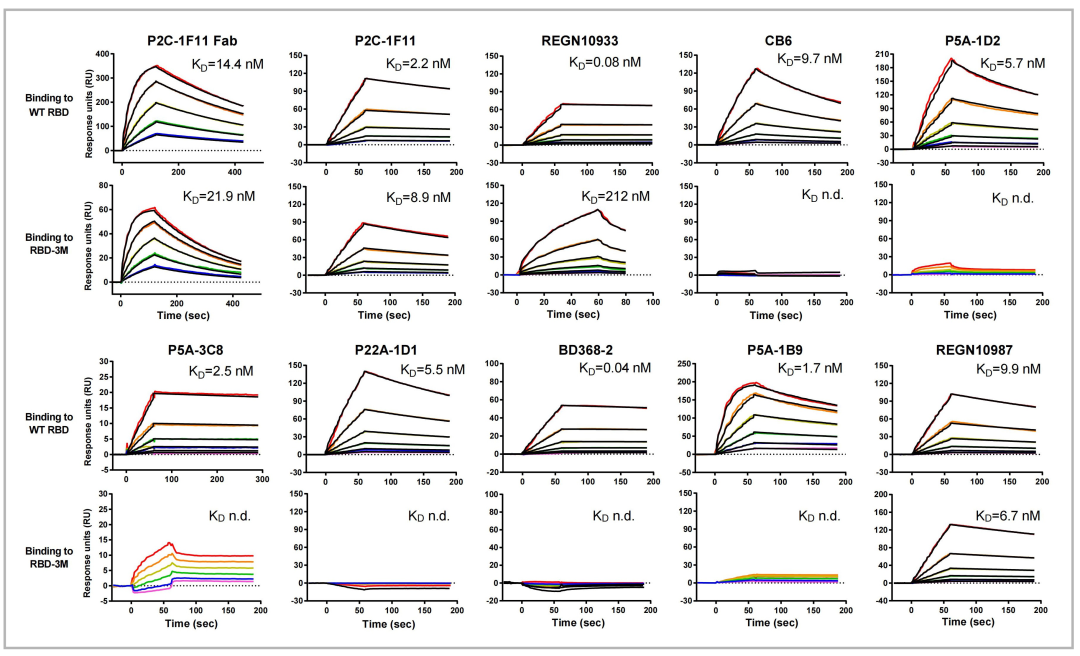
图4 不同中和抗体或Fab与野生型/突变型RBD的动力学表征
△点击放大图片
E.新冠病毒公共抗体及病毒突变的关系解读
2021年7月,研究团队在《Nature Communications》上发表文章《Potent and protective IGHV-53/3-66 public antibodies and their shared escape mutant on the spike of SARS-CoV-2》[6]。文中发现不同患者体内均能诱导出IGHV3-53/3-66基因谱系的抗体,被称为公共抗体(public antibody)。研究团队分析四株公共抗体与RBD复合物的结构信息,通过经典的点突变方式并借助Biacore剖析了不同公共抗体与RBD发生相互作用的关键氨基酸位点,发现该类公共抗体与RBD的结合角度、结合表位非常相似,与ACE2均有强竞争能力。该类公共抗体对新冠病毒野生株具有强效中和能力,仓鼠动物模型的保护实验也证明该类抗体对新冠病毒野生株具有非常出色的保护能力。
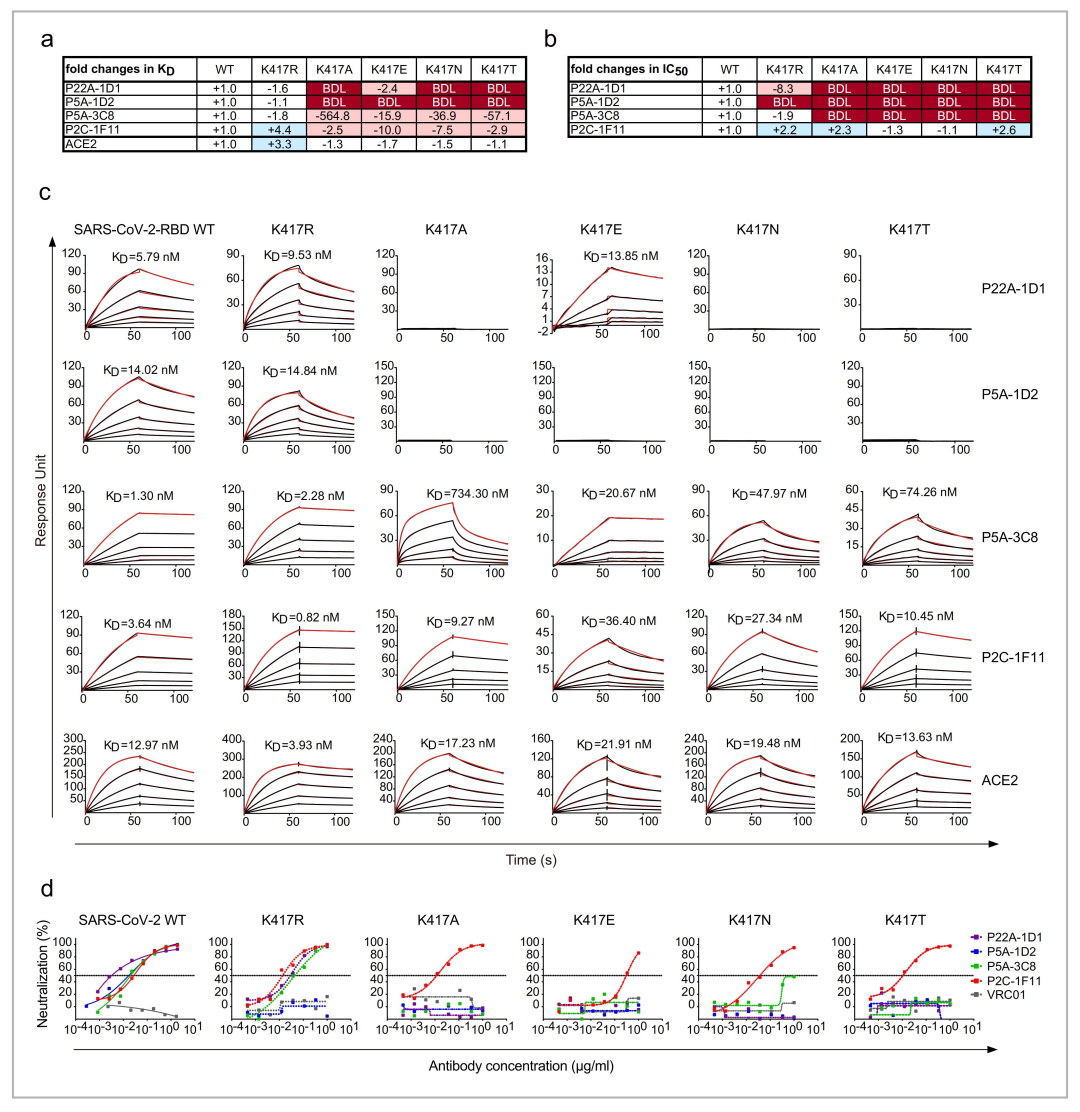
图5 5株公共抗体与SARS-CoV-2 RBD的动力学表征
△点击放大图片
02 助攻疫苗研发与生产
新冠疫苗的研发过程中,Biacore同样贡献卓著,核酸疫苗、亚单位疫苗以及纳米颗粒疫苗等,在不同的研发阶段都大量使用了Biacore。Biacore不仅可以检测纯化的蛋白之间的结合,还可以直接检测血清等复杂样品,这对于疫苗的研发非常有利,可以大大提高实验效率。
A. mRNA疫苗
2020年9月BioNtech公开了其利用变异的新冠病毒D614G毒株开发的mRNA疫苗——BANCOVID的研发数据[7]。以Biacore为代表的竞争性实验数据显示,疫苗接种后产生了针对S蛋白整个胞外域(S1和S2亚基)的特异性抗体。该实验中,研究人员将新冠病毒的Sipke蛋白S1和S2亚基同时偶联在芯片上,免疫后的小鼠血清进样后,与固定的S1+S2蛋白有明显结合,证明免疫产生了针对S1/S2的抗体。而在小鼠血清中预先混合S1或S2或S蛋白,都不同程度地降低了响应值,证明产生的抗体与S1和S2抗原均有结合(图6,左)。将免疫后小鼠血清中的抗体纯化后,重复Biacore竞争实验,也得到了相同的结果(图6,右)。这说明BANCOVID疫苗免疫小鼠后产生了针对整个Spike蛋白的中和抗体。结合其他的动物实验结果,表明BANCOVID是一个很好的针对新冠病毒D614G毒株的疫苗候选。
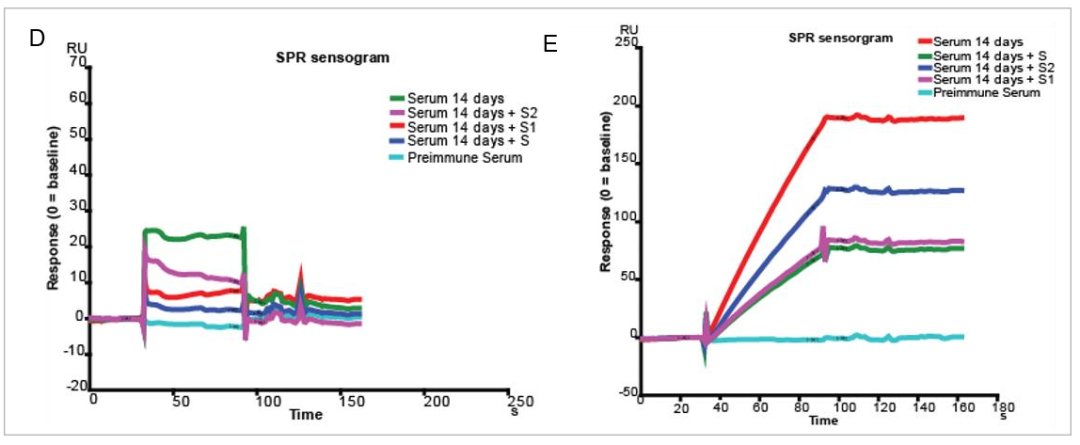
图6 Biacore检测免疫小鼠血清中的抗体与病毒S蛋白的结合
△点击放大图片
B.亚单位疫苗
2022年5月4日,中国科学院微生物所高福院士团队联合智飞生物开发了全球首个获批的新冠重组蛋白亚单位疫苗,长期保护力75.7%[8]。研究人员设计了新冠病毒S蛋白RBD二聚体亚单位疫苗,通过Biacore实验发现,设计的这种具有稳定的串联重复单链的RBD二聚体——RBD-sc-dimer,和RBD单体相比,与ACE2受体的亲和力相当(图7)[9],成功保留了疫苗的效力。而且比RBD单体有更好的免疫原性和保护作用。
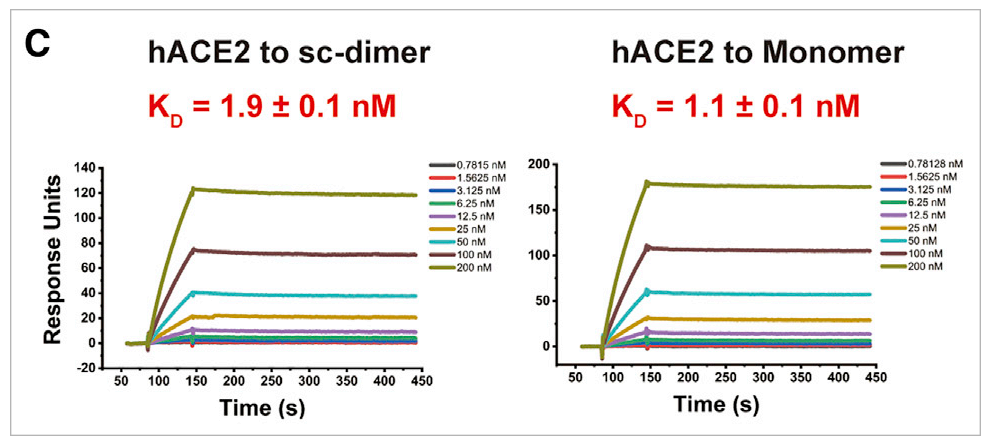
图7 RBD-sc-dimer和RBD单体与ACE2受体的亲和力比较
△点击放大图片
值得一提的是,这种疫苗设计的策略在针对MERS和SARS的疫苗开发中同样适用。研究人员同样利用Biacore检测了MERS和SARS的二聚体抗原与相应受体的结合,结果表明MERS和SARS的二聚体抗原与相应受体的亲和力均与单体相当(图8)[9],并且使得免疫小鼠产生的中和抗体滴度明显提高。表明该策略可普遍应用于其他β冠状病毒的疫苗设计,从而应对未来可能出现的、由冠状病毒引起的新型传染病。
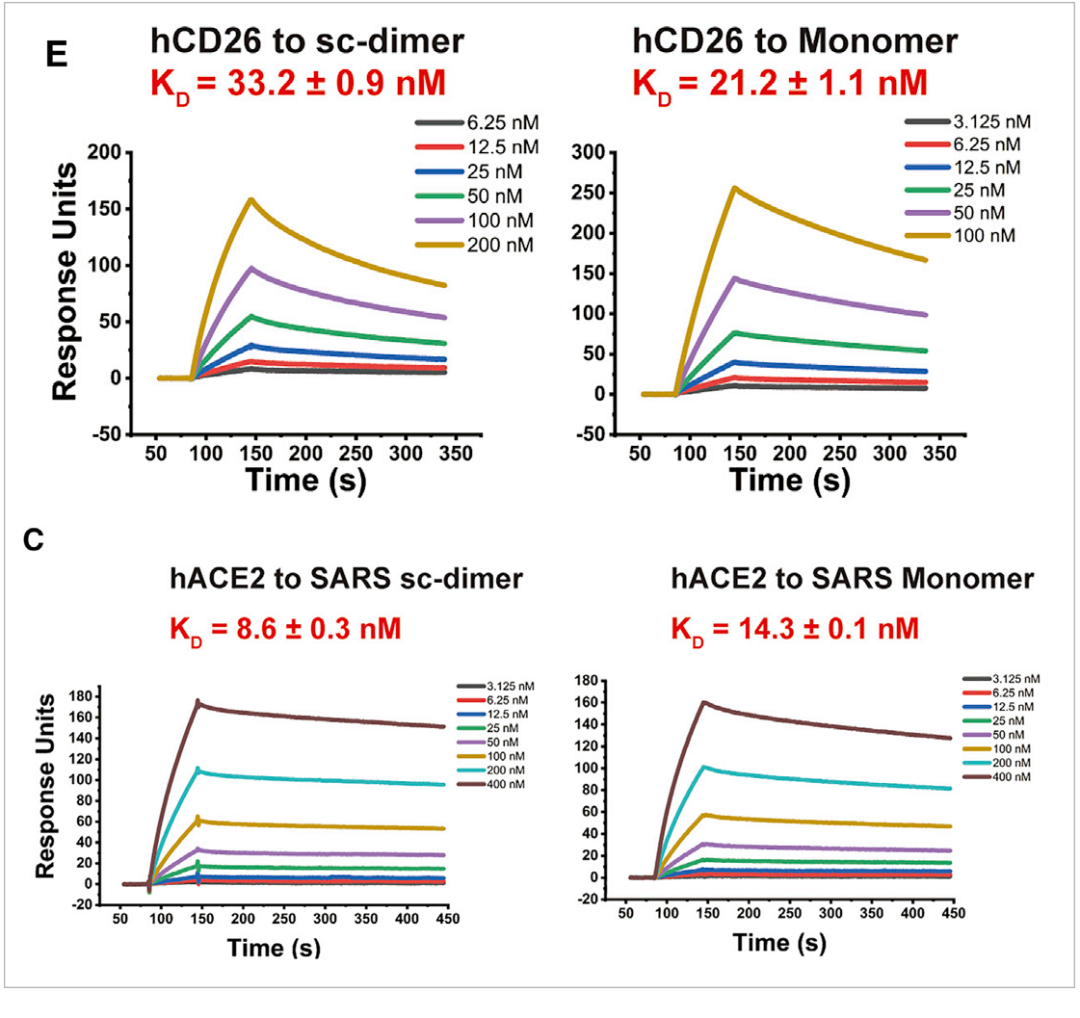
图8 MERS和SARS病毒二聚化RBD和单体RBD与相应受体的亲和力比较
△点击放大图片
2022年4月,高福院士团队再次在《Cell》杂志上发表了文章,题为《Protective prototype-Beta and Delta-Omicron chimeric RBD-dimer vaccines against SARS-CoV-2》[10],作者基于之前的同型二聚体策略,新开发了一种嵌合RBD-dimer疫苗的方法,该方法比同型RBD-dimer疫苗诱导了更广泛的免疫应答。作者首先设计了prototype-beta嵌合的RBD-dimer疫苗。利用Biacore,将多种RBD-dimer 和 RBD-monomer固定在CM5芯片上,然后将hACE2和5种不同抗体(CB6\CV07-270\C110\S309\CR3022)稀释成不同的浓度梯度进样。结合随后的动物实验,证明嵌合疫苗在应对SARS-CoV-2变异方面有其独特的优势和极强的推广性。
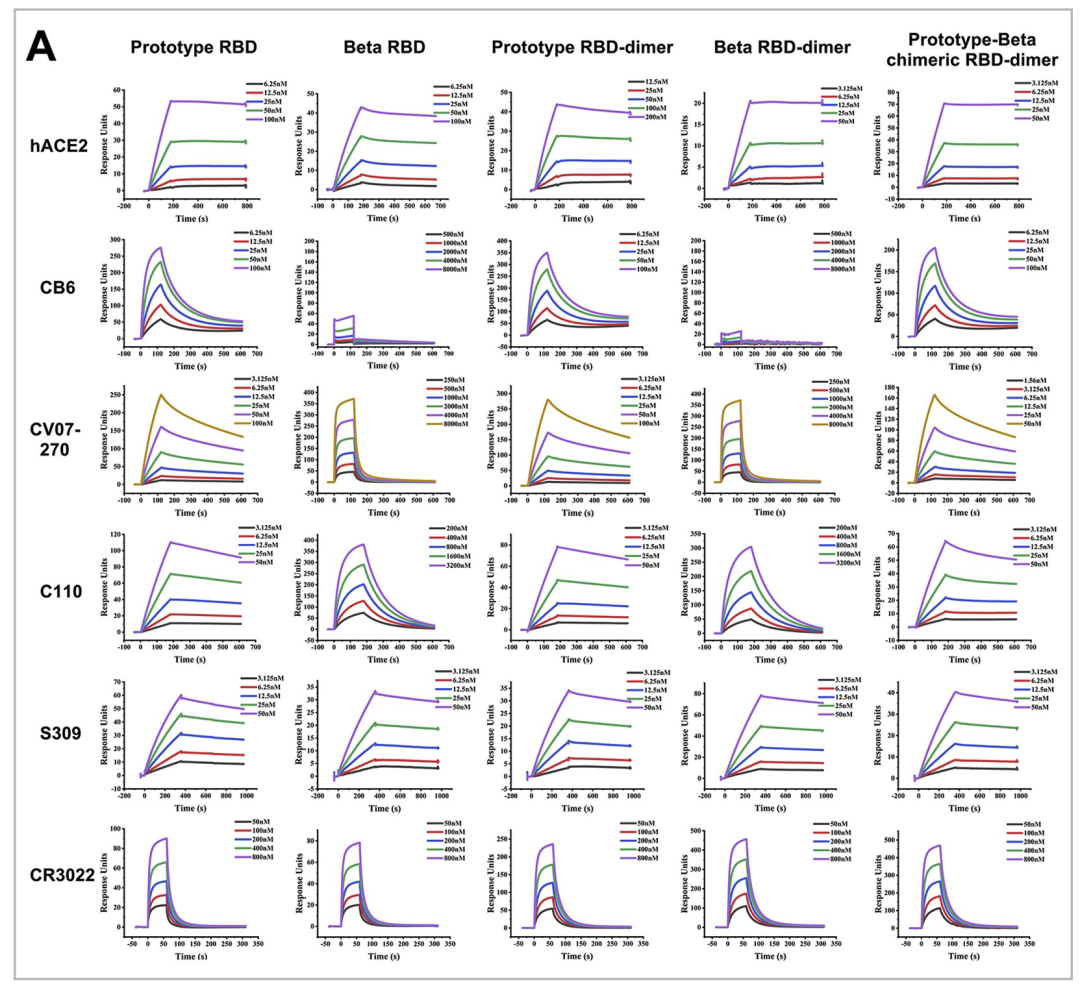
图9. Biacore检测Prototype RBD, Beta RBD, Prototype RBD-dimer, Beta RBD-dime, Prototype-Beta chimeric RBD-dimer与hACE2和5种单克隆抗体的结合
△点击放大图片
为了适应目前流行的病毒突变体,作者据此又设计了Delta-Omicron嵌合疫苗,同样利用Biacore检测了Delta RBD, Omicron RBD, Omicron-Delta chimeric RBD-dimer与hACE2和5种单克隆抗体的结合,随后的动物实验也同样证明了Delta-Omicron嵌合疫苗可以很好地保护小鼠免受Delta或Omicron攻击。
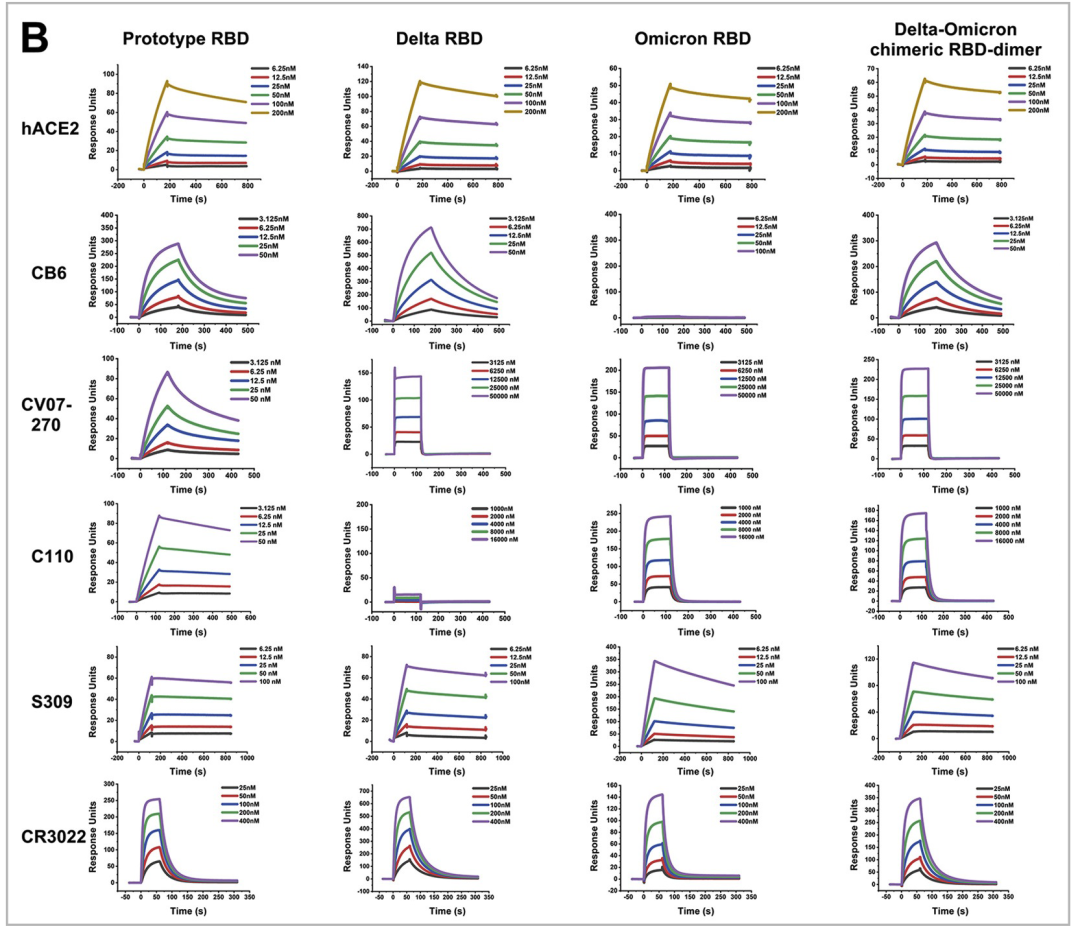
图10. Biacore检测Delta RBD, Omicron RBD, Omicron-Delta chimeric RBD-dimer与hACE2和5种单克隆抗体的结
△点击放大图片
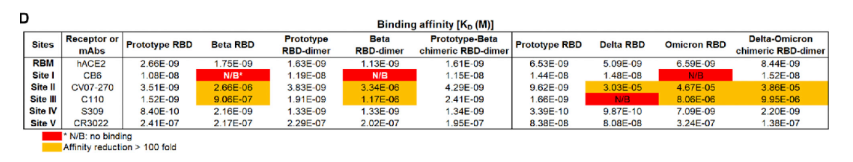
表1. Biacore检测Prototype RBD, Beta RBD, Prototype RBD-dimer, Beta RBD-dime, Prototype-Beta chimeric RBD-dimer; Delta RBD, Omicron RBD-dimer, Omicron-Delta chimeric RBD-dimer与hACE2和5种单克隆抗体的结合亲和力
△点击放大图片
C.纳米颗粒疫苗
中山大学人类病毒学研究所张辉教授课题组研发的 纳米颗粒疫苗,可以实现在单个疫苗表面同时展示24个相同或不同的新冠病毒抗原,增强疫苗的保护性免疫响应,诱导的中和抗体可以显著地抵御机体免遭新冠病毒感染。研究人员构建了两种铁蛋白纳米颗粒疫苗,一种是RBD纳米颗粒疫苗,一种是RBD-HR(heptad repeat,七肽重复区)嵌合的纳米颗粒疫苗。通过Biacore互作实验发现,这两种构建的纳米颗粒疫苗和RBD单体一样,具有结合ACE2受体的能力,并且亲和力相当(图11)[11]。
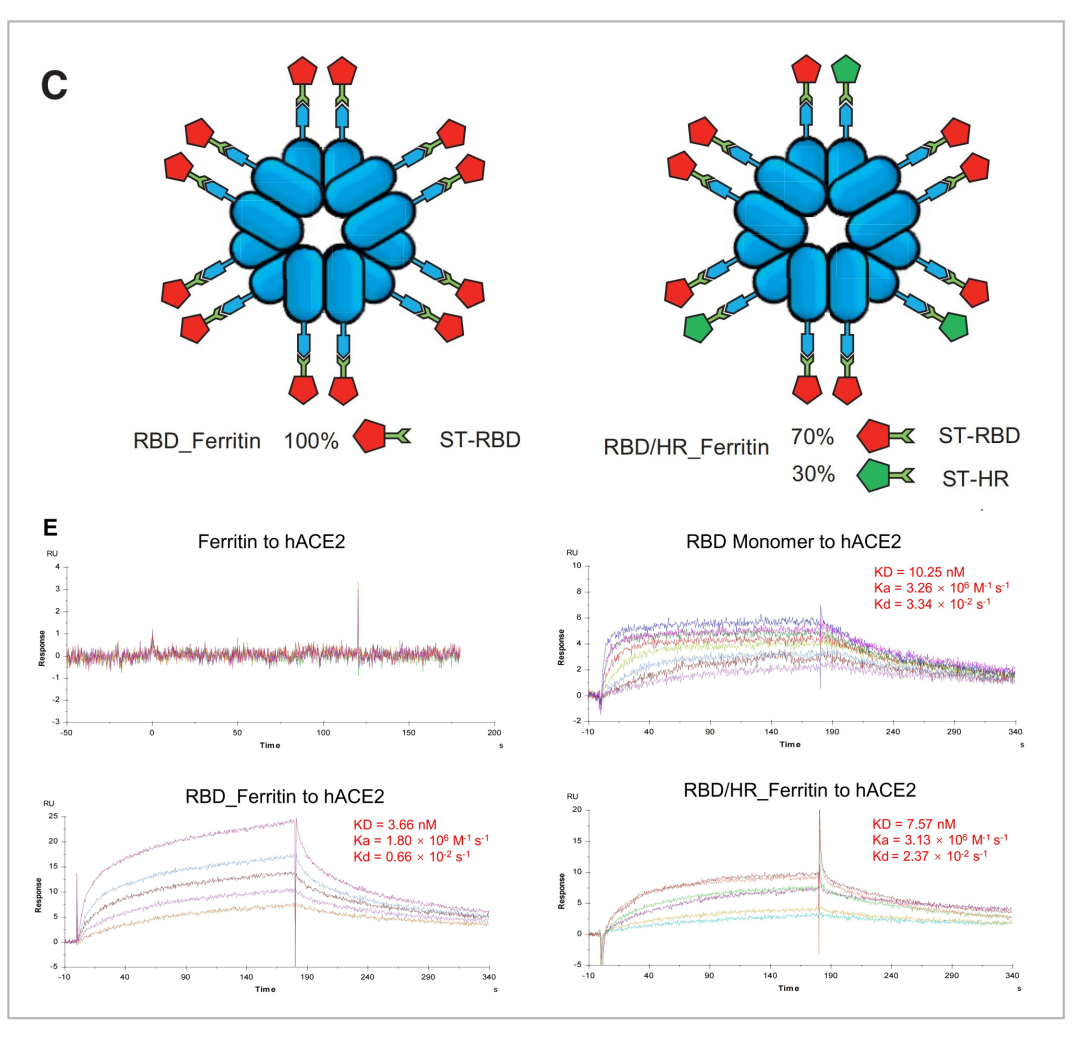
图11 RBD单体以及构建的两种纳米颗粒疫苗RBD_Ferritin和RBD/HR_Ferritin与ACE2的结合
△点击放大图片
综上所述,Biacore科学的管路设计、连续的进样方式、完备的功能模块、智能的数据分析软件、稳定的产品性能,在新冠这场战役中发挥着举足轻重的作用。不仅在新冠病毒入侵机制研究,从抗体药物的设计与开发到新冠疫苗的研发与上市,从纯品蛋白到血清粗样品,从动力学/亲和力表征到表位分析,Biacore都以广泛的应用方向,值得信赖的数据,陪伴科研人员奋战在与新冠疫情艰苦斗争的一线,让我们可以早日摆脱这场旷日持久的疫情!
优宁维可提供的部分相关产品:
| 产品货号 | 产品名称 |
| 28994951 | Series S Sensor Chip NTA, 1-pack |
| 28995043 | NTA Reagent Kit |
| BR100827 | HBS-P+ buffer 10X 4x50ml |
| 28990944 | Superdex 200 Increase 10/300 GL |
| BR100530 | Series S Sensor Chip CM5, 3-pack |
| 557835 | Hu CD19 PE-Cy7 SJ25C1 100Tst |
| 558117 | Hu CD3 Pacific Blue UCHT1 100ug |
| 558207 | Hu CD8 Pacific Blue RPA-T8 100ug |
| 558121 | Hu CD14 Pacific Blue M5E2 100ug |
| 560222 | Hu CD27 APC-H7 M-T271 100Tst |
| 555786 | Hu IgG FITC G18-145 100Tst |
| 410708-5mg | PE anti-human IgG Fc |
| 29091596 | Superose 6 Increase 10/300 GL |
| A-17-1 | GraphPad Prism 9 |
| A21445 | ALEXA FLUOR 647 GOAT A |
| 664185-2003 | BD flowjo |
| A16073 | Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, FITC |
| E4550 | Luciferase Assay System |
| 17549854 | HiTrap MabSelect PrismA, 5x5 mL |
| 210518 | QuikChange Lightning 10 rxn |
| 130-120-787 | His Antibody, PE |
| A11034 | Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor® 488 conjugate |
| 552051 | APC-Cy7 Rat Anti-Mouse CD4 |
| 554429 | APC Rat Anti-Mouse IL-2 |
| 506324-100ug | PE/Cyanine7 anti-mouse TNF-a Antibody |
| 100204-A | FITC anti-mouse CD3 Antibody |
| 100734-A | PerCP/Cyanine5.5 anti-mouse CD8a Antibody |
| 504104-Inquire | PE anti-mouse IL-4 Antibody |
| 10361012 | MAX Efficiency DH10Bac Competent E.coli |
| 17524802 | HISTRAP HP 5 X 5 ML |
| 28989335 | HiLoad 16/600 Superdex 200 pg |
| 17040303 | HITRAP PROTEIN A HP 5 X 5 ML |
| 29149603 | Series S Sensor Chip CM5 10-pack |
| 4444434 | TaqMan Fast Virus 1-Step Master Mix kit |
| 17371201 | Ni Sepharose excel 25 ml |
| 74104 | RNeasy Mini Kit |
| 00-4201-56 | eBioscience TMB Solution |
| 11-0031-82 | CD3e Monoclonal Antibody (145-2C11), FITC |
| 100429-A | Alexa Fluor 700 anti-mouse CD4 Antibody |
| 100752-2 | Brilliant Violet 510 anti-mouse CD8a Antibody |
| 103006 | FITC anti-mouse/human CD44 Antibody |
| 104407 | PE anti-mouse CD62L Antibody |
| 552879 | PE-Cy7 Hamster Anti-mouse CD69 Antibody |
| 505810-50ul | APC anti-mouse IFN-g Antibody |
| 504103-Inquire | PE anti-mouse IL-4 Antibody |
| 17-2093-80 | CD209b (SIGN-R1) Monoclonal Antibody (eBio22D1 (22D1), APC |
| 25-0112-82 | CD11b Monoclonal Antibody (M1/70), PE-Cyanine7 |
| 142421-200ul | Brilliant Violet 421 anti-mouse CD169 (Siglec-1) Antibody |
| MF48005 | F4/80 Monoclonal Antibody (BM8), APC |
| 406606-50ul | FITC anti-mouse IgG1 Antibody |
| 406707-50ul | PE anti-mouse IgG2b Antibody |
参考文献
[1]Lan J , Ge J, Yu J, et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor[J]. Nature 581: 215–220 (2020).
[2]Ju B, Zhang Q, Ge J, et al. Human neutralizing antibodies elicited by SARS-CoV-2 infection[J]. Nature 584, 115–119 (2020).
[3]Yan R, Wang R, Ju B, et al. Structural basis for bivalent binding and inhibition of SARS-CoV-2 infection by human potent neutralizing antibodies[J]. Cell research 31: 517-525 (2021).
[4]Ge J, Wang R , Ju B, et al. Antibody neutralization of SARS-CoV-2 through ACE2 receptor mimicry[J]. Nature Communications 12, 250 (2021).
[5]Wang R , Zhang Q , Ge J , et al. Analysis of SARS-CoV-2 variant mutations reveals neutralization escape mechanisms and the ability to use ACE2 receptors from additional species[J]. Immunity ,54, 1611–1621 (2021).
[6]Zhang Q, Ju B, Ge J, et al. Potent and protective IGHV3-53/3-66 public antibodies and their shared escape mutant on the spike of SARS-CoV-2[J]. Nature Communications 12, 4210 (2021).
[7]Baray JC. et al. BANCOVID, the first D614G variant mRNA-based vaccine candidate against SARS-CoV-2 elicits neutralizing antibody and balanced cellular immune response[J]. bioRxiv, 2020. doi: https://doi.org/10.1101/2020.09.29.319061.
[8]Lianpan Dai, et al. Efficacy and Safety of the RBD-Dimer–Based Covid-19 Vaccine ZF2001 in Adults[J]. NEJM, 2022. DOI: 10.1056/NEJMoa2202261
[9]Dai L , Zheng T , Xu K , et al. A universal design of betacoronavirus vaccines against COVID-19, MERS and SARS[J]. Cell 182, 722–733 (2020).
[10]Kun X, Ping G, et al. Protective prototype-Beta and Delta-Omicron chimeric RBD-dimer vaccines against SARS-CoV-2[J]. Cell 185, 1–14 (2022).
[11]Ma X. C, Zou F. et al. Nanoparticle Vaccines Based on the Receptor Binding Domain (RBD) and Heptad Repeat (HR) of SARS-CoV-2 Elicit Robust Protective Immune Responses. Immunity 53, 1315–1330(2020).