2000多年前,人类就从感染瘟疫并恢复健康的病人会对这种疾病产生抵抗力的案例中获得启示,从而认识到免疫的存在并发现其强大功能。除了瘟疫之外,肿瘤事实上也受到免疫系统的牵制。肿瘤免疫也是近年来很热门的研究方向之一,肿瘤的定义也从单纯的肿瘤细胞聚集演变为一个复杂的器官样结构,由肿瘤细胞、免疫细胞、成纤维细胞、血管内皮细胞和周围的其他基质细胞组成。肿瘤附近的各种细胞和成分,如免疫浸润细胞、血管,细胞外基质等构成的结构,也称为肿瘤免疫微环境,已成为肿瘤学最热门的研究课题之一。今天小优给大家分享的其中一篇文章就是今年发表在Nature上的关于T细胞对肿瘤免疫的调节。
除了肿瘤免疫之外,类器官也是近年来蓬勃发展热门研究方法,那类器官与肿瘤免疫这两大热门结合在一起又可以碰撞出什么样的火花呢?2019年,Nature protocol上发表了一篇关于肿瘤类器官和T细胞共培养的protocol,使用肿瘤类器官和自体外周血共培养体系对肿瘤反应T细胞(tumor-reactive T cells)进行了功能性评估。通过病人的肿瘤样本建立肿瘤类器官模型,将其与来自病人外周血的淋巴细胞,进行一段时间的的共孵育,可以产生真正具有肿瘤杀伤活性的特异性T细胞,且并不会对正常组织进行杀伤,这是一个对精准医疗具有相当的推动意义的成果。
接下来我们一起来看看这两篇文章的研究思路吧。
PART1 Programme of self-reactive innate-like T cell-mediated cancer immunity 自身反应类先天性 T 细胞介导癌症免疫程序
今年4月20日,一篇在《nature》上发表的关于自身反应类先天性T细胞可以介导癌症免疫程序的文章,揭示了一种免疫抗癌的全新机制,并且找到一种极具抗癌潜力的T细胞,有望推动免疫疗法向全新方向发展。在本篇文章的研究过程中发现了一种缺乏PD-1却高度表达自然杀伤细胞受体的T细胞,根据这类T细胞的特征,研究将其命名为类先天性杀伤型T细胞(Killer Innate-like T cell, ILTCK),因为ILTCK与传统CD8+ T细胞不同,它的激活不依赖树突细胞,并且特性更接近先天性淋巴细胞。接下来我们详细看下文章的研究思路吧。
(1)ILTCKs 具有不同于CD8+ T的转录组,其抗原受体可以识别未突变的肿瘤抗原
为了研究肿瘤浸润性T细胞之间的异质性,实验进行了单细胞RNA 测序 (scRNA-seq) ,分析了来自 MMTV-PyMT(PyMT) 小鼠乳腺肿瘤组织的 CD45+TCRβ+CD8α+ 细胞,发现结果分出五个不同的簇,并且表明PyMT 小鼠中的肿瘤浸润性 CD8α+ T 细胞表现出不同的分化和增殖状态,进一步研究发现ILTCK 分化程序代表了一种进化上保守的肿瘤引发的免疫反应。新发现的ILTCK不表达PD-1和其他免疫抑制受体,因此不会进入细胞耗竭状态。这说明ILTCK能够更轻松地躲过癌细胞的反击。研究也的确观察到ILTCK对肿瘤细胞展现出了更强大的细胞毒性。
这类新发现的ILTCK与传统T细胞有着一个最大的区别,那就是大部分传统T细胞倾向于识别肿瘤新生抗原,但ILTCK识别的是肿瘤原生抗原。这就使ILTCK可以在原生抗原遍布的肿瘤内部更好地发挥作用,并且因为不表达PD-1也不会经历细胞耗竭,可谓是能够持续性发展的抗癌T细胞类型。

图1、αβILTCK与传统的CD8+ T细胞分化特征不同,它以TCR特异性依赖方式的在胸腺中发育
△点击放大图片
a、从三只小鼠指定细胞群中分离的 TCR 对进行CDR3 分析,超过 50% PD-1+ T细胞 TCR 库归因于五个独特的 TCR 对,反映了它们的寡克隆扩增。相比之下,NK1.1+ αβILTCK TCRs 主要是多克隆的,具有适度的克隆扩增 。实验没有检测到 NK1.1+ αβILTCKs 和 PD-1+ T 细胞使用的任何 TCR 对,这表明它们不是从共享祖细胞发展而来的。
b、TCR 报告基因分析示意图。为了确定每个子集中 TCR 的特异性,实验分析了使用改进的 TCR 报告基因测定系统,来分析它们对原发性 PyMT 癌细胞的反应性 。
c、在与原代共培养后,表达指定 TCR 的 CD8+ 报告细胞中 GFP+ 细胞的频率PyMT 癌细胞。33 个NK1.1+ αβILTCK 衍生的 TCR 中的 26 个显示出对异源癌细胞的显著反应性,表明它们识别来自多只小鼠的癌细胞共有的未突变抗原。相比之下,PD-1+ T 细胞衍生的 TCR 均未对高于由不相关 OT-I TCR 建立的背景水平的异源癌细胞产生反应,这意味着它们对个体肿瘤特异性新抗原具有反应性。
d、TCR受体交换实验的示意图。初始 CD8+ T 细胞的内源性TCR用NK1.1+ αβILTCK 衍生的TCR取代。工程细胞被转移到肿瘤小鼠体内,并在7天后进行分析。
e,f、在过继转移到肿瘤受体小鼠中后,表达 αβILTCK衍生的TCR的CD8+ T 细胞显示 PD-1 表达上调,但 NK1.1 没有上调。
g、通过用 Rag1-/- Lineage-c-Kit+Sca1- (LSK) 细胞的混合物重建致死性辐照的 PyMT 小鼠产生 TCRretrogenic 骨髓嵌合体,这些细胞用表达所示 NK1.1+ αβILTCK 衍生的 TCR 和 Rag1+/+ 总骨髓细胞。
h,i、PD-1和NK1.1由供体来源的肿瘤浸润性CD8+ T细胞在TCR逆转录性骨髓嵌合体中表达指示的单克隆或多克隆TCR。αβILTCKs 不依赖于树突状细胞介导的次级淋巴器官的启动,并且与传统的 CD8+ T 细胞来源不同。实际上,在肿瘤中发育表达 αβILTCK 衍生的 TCR 的胸腺细胞一致且特异性地产生 NK1.1+ αβILTCK,但不产生 PD-1+ T 细胞。因此,NK1.1+ αβILTCK 和 PD-1+ T 细胞代表了两种相互排斥的细胞命运选择,并且在胸腺细胞发育过程中以TCR 特异性依赖的方式对任一谱系的发生。
(2)ILTCKs 会被竞争选择并且可以在肿瘤中不断补充
以上研究说明NK1.1+ αβILTCK 和 PD-1+ T 细胞代表了两种相互排斥的细胞命运选择。虽然具有多克隆TCR库的胸腺细胞主要产生常规CD4或CD8单阳性T细胞,但那些含有单克隆 αβILTCK TCR的胸腺细胞仅产生 CD4-/loCD8-/lo 细胞。到目前为止,所有已知的TCRαβ+ T 细胞在发育过程中都会在胸腺中经历 CD4+CD8+ 双阳性阶段。正如预期的那样,肿瘤中驻留的 NK1.1+ αβILTCKs 和 PD-1+ T 细胞由在 CD4+CD8+胸腺细胞中短暂活跃的Rorc-cre等位基因决定命运,并且研究发现NK1.1+ αβILTCK可能是CD4+CD8+胸腺细胞上缺乏经典MHC-I表达的结果。通过阳性选择后,CD4+CD8+胸腺细胞瞬时表达低水平的PD-1。相比之下,表达αβILTCK-TCR的胸腺细胞保持高PD-1表达,这说明表明是经过强TCR刺激的结果。进一步发现表明,强烈的自身反应性驱动αβILTCK 谱系定型,类似于指定iNKT细胞和肠上皮内淋巴细胞(IEL) 命运的“激动剂”选择过程。
相当大比例的带有αβILTCK-TCR 的胸腺细胞共同表达PD-1和CD122,这种表型让人想起胸腺祖细胞。除了肿瘤内的αβILTCKs,表达αβILTCK TCR 的胸腺细胞也可以分化成小肠IELs,两个群体都表达CD8αα 同源二聚体。在过继转移到携带淋巴细胞减少的肿瘤小鼠后,多克隆TCRβ+CD4-/lo CD8-/loPD-1+CD122+ 胸腺祖细胞瘤内产生αβILTCK 和肠道IEL。然而,在淋巴细胞充足的小鼠中,αβILTCK 和 IEL祖细胞移植到肿瘤中而不是小肠中,进一步研究也表明ILTCKs会不断的补充到肿瘤组织中。

图2、携带 αβILTCK-TCRs 的胸腺细胞经历激动剂选择和不断地重新填充肿瘤
△点击放大图片
a,b、虽然具有多克隆 TCR 库的胸腺细胞主要产生常规的 CD4 或 CD8 单阳性 T 细胞,但那些含有单克隆 αβILTCK TCR 的胸腺细胞仅产生 CD4–/loCD8–/lo 细胞。
c,d、供体 αβILTCK 祖细胞衍生细胞的频率,确定为 CD45.1+TCRβ+ 存在于来自 CD45.2+ Rag1–/– (n = 3) 或 Rag1+/– PyMT 受体的肿瘤和小肠上皮 (SI) 小鼠(n = 3)。下图显示了 PD-1 和 NK1.1 在 CD45.1+TCRβ+ 供体细胞上的表达模式。在过继转移到携带淋巴细胞减少的肿瘤小鼠后,多克隆 TCRβ+CD4-/lo CD8-/loPD-1+CD122+ 胸腺祖细胞开始在瘤内出现αβILTCK 和肠道出现IEL。然而,在淋巴细胞充足的小鼠中,αβILTCK 和IEL祖细胞移植到肿瘤中而不是小肠中。
(3)FCER1G的表达标志着αβILTCK-谱系的细胞
为了深入了解 ILTCK 谱系的规则,实验比较了肿瘤浸润性 NK1.1+ αβILTCKs 和 PD-1+ T 细胞与它们各自的胸腺祖细胞的基因表达谱,发现它在αβILTCK 祖细胞中上调但在其在αβILTCK祖细胞中上调但在成熟祖细胞中被抑制的基因在与抗原刺激相关的基因中富集。αβILTCK祖细胞中Lat和Cd2的下调可能会抑制TCR信号传导,使成熟的αβILTCKs不容易被耗尽。值得注意的是,编码许多NK受体和信号分子的基因在αβILTCK祖细胞中表达上调,并在成熟的NK1.1+αβILTCKs8中保持高表达。
虽然αβILTCK祖细胞的过继转移持续产生NK1.1+αβILTCKs,但仍有相当一部分是NK1.1−细胞。这不太可能是αβILTCK祖细胞之间预先存在TCR异质性,因为表达单克隆TCR的胸腺细胞也产生NK1.1−和NK1.1+亚群。与PD-1+T细胞相比,NK1.1-细胞在转录上更类似于NK1.1+αβILTCKs,但它们在胸腺αβILTCK祖细胞中富集的转录本表达更高。接下来的实验表明 FCER1G 特异且稳定地标记致力于αβILTCK 谱系的细胞。在CD4-CD8α-TCRβ+CD1d-NK1.1- 胸腺细胞中,FCER1G+ CD122+ 群体表达高水平的 PD-1 并且缺乏颗粒酶 B 表达,其表型与由 CD122 和 PD-1 共表达定义的 αβILTCK 和 IEL 祖细胞相同。在肿瘤浸润性T细胞中,FCER1G+CD122+ 群体保持为CD4-,大多数上调CD8αα同源二聚体并且一致缺乏 PD-1 表达。无论其激活状态如何,FCER1G 表达都足以识别肿瘤浸润性 αβILTCK。
总的来说,这些发现将 FCER1G 确定为αβILTCK 谱系定义标记,并证明αβILTCK 程序代表了小鼠和人类中进化上保守的肿瘤引发的免疫反应。

图3、FCER1G的表达标志着αβILTCK-谱系的细胞
△点击放大图片
a,b、流式细胞术分析来自PyMT小鼠的TCRβ+CD1d−NK1.1−胸腺细胞和TCRβ+CD4−CD1d−肿瘤浸润T细胞中FCER1G、CD122、CD4、CD8α、CD8β、PD-1、NK1.1和GZMB的表达。
c,d、CD45+TCRβ+CD4−细胞在结肠癌患者的肿瘤组织或邻近正常结肠中表达FCER1G。
(4)ILTCK可被设计用于癌症治疗
与之前的研究表明NK1.1+αβILTCKs严重依赖于促炎细胞因子IL-158相一致,实验发现在缺乏Il15的小鼠中观察到FCER1G+CD122+胸腺αβILTCK祖细胞几乎完全缺失。但是与健康的乳腺组织相比,转化的乳腺上皮细胞中IL-15的表达明显增加。IL-15在结肠癌患者的肿瘤上皮细胞中也很容易被检测到,而FCER1G+的频率,而不是PD-1+,T细胞与IL-15水平呈正相关。为了研究癌细胞表达的IL-15是否调节αβILTCK反应,接下来进行了系列的小鼠实验,发现ILTCKs 感知癌细胞衍生的 IL-15 用于癌症免疫监视。值得注意的是,IL-15 足以诱导 NK1.1 和 GZMB 的上调以及胸腺 αβILTCK 祖细胞中伴随的 PD-1 下调。当过继转移到淋巴细胞充足的 PyMT 宿主中时,带有STAT5B-CA 的 αβILTCK 祖细胞很容易在肿瘤组织中定植并经历强大的扩张和效应分化,导致肿瘤生长减少。
相比之下,过继转移的 STAT5B-CA的胸腺 CD8 单阳性 T 细胞没有移植或分化,可能是由于肿瘤反应性克隆的频率低,并且预期肿瘤生长没有改变。因此,αβILTCK 中的 IL-15可以成为开发癌症疗法的有效工具。
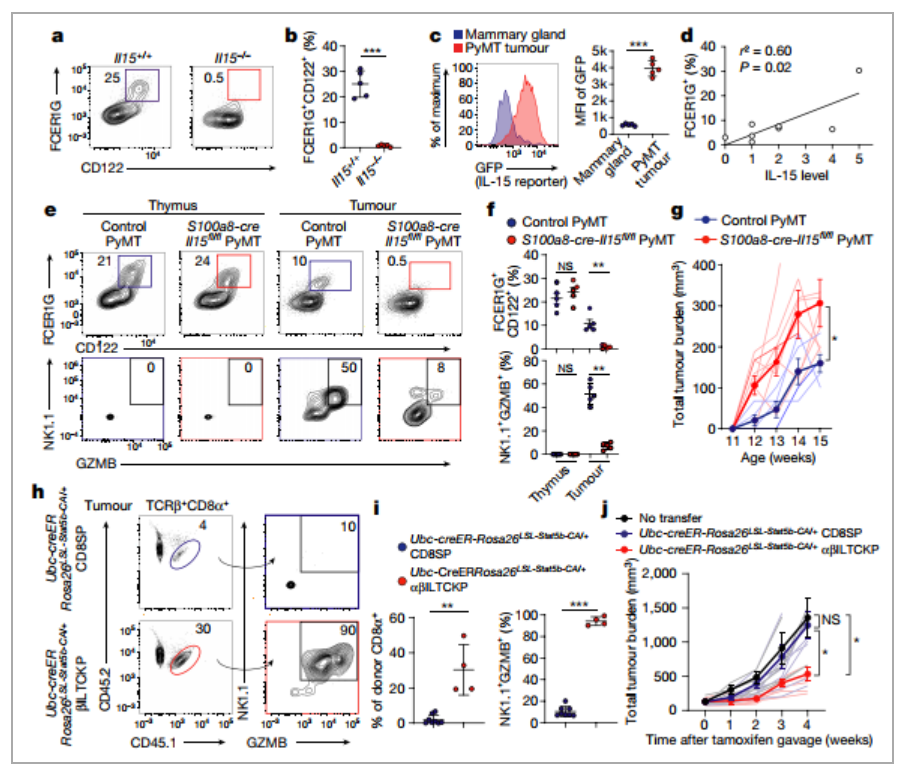
图4、αβILTCKs可以感知癌细胞表达的IL-15,并且可诱导αβILTCKs中IL-15信号的过度激活从而抑制肿瘤生长
△点击放大图片
a,b、流式检测来自 Il15−/−和 Il15+/+小鼠的 TCRβ+CD1d−NK1.1−CD4−CD8α− 胸腺细胞FCER1G和CD122 的表达。
c、报告基因检测来自IL-15对照和PyMT小鼠的CD45-EpCAM+细胞表达的GFP。
d、CD45+TCRβ+CD4-细胞中FCER1G+细胞的频率与结肠癌患者肿瘤组织中IL-15表达水平之间的相关性。
e,f、流式分析TCRβ+CD1d-NK1.1-CD4-CD8α-胸腺细胞和来自 S100a8-cre-Il15fl/fl PyMT 的 CD45+TCRβ+CD4-CD1d- 肿瘤浸润细胞中 FCER1G 和 CD122 的表达,对照为PyMT小鼠,以及NK1.1 和 GZMB 在 FCER1G+CD122+ 细胞中的表达。
g、指定基因型小鼠的肿瘤负荷。对照为PyMT和 S100a8-creIl15fl/fl PyMT小鼠。
h,i、流式分析过继转移的TCRβ+CD8α+ 肿瘤浸润细胞和 NK1.1 以及GZMB 表达的供体细胞中的CD45.1+CD45.2+ αβILTCK 祖细胞或 CD8 单阳性 T 细胞。
j、无细胞过继转移的小鼠的肿瘤负荷、Ubc-creERRosa26LSL-Stat5b-CA/+ 胸腺 CD8 单阳性 T 细胞或 αβILTCK 前体。
本篇文章ILTCK的发现不仅为肿瘤免疫疗法开辟了新思路,也为T细胞系的演化提供了新视角。研究团队对这一新发现能带来的潜在应用非常期待,过往的肿瘤免疫认知和相关疗法大部分是建立在以传统T细胞为中心的框架之上。
文章剖析完了之后小优也给大家总结好了本篇文章中用到的部分产品清单哦!
| 分类 | 货号 | 名称 |
| 培养基 | SH30809.01 | RPMI 1640 |
| 培养基 | SH30023.01 | DMEM/F12 |
| 辅助试剂 | SH30256.01 | PBS |
| 辅助试剂 | SH30030.02 | HBSS |
| 辅助试剂 | abs9133-500ml | EDTA, 0.5 M, pH 8.0 |
| 辅助试剂 | SH30337.03 | Hepes Buffer (Powder) |
| 血清 | SH30406.05 | New Zealand Characterized Foetal Bovine Serum |
| 双抗 | SV30010 | 双抗 |
| 组织保存 | 130-100-008 | MACS Tissue Storage Solution |
| 样本制备 | 130-095-929 | Tumor Dissociation Kit, human |
| 筛网过滤 | 130-098-462 | MACS SmartStrainers(70 μm) |
| 死细胞去除 | 130-090-101 | Dead Cell Removal Kit |
| 分选磁珠 | 130-093-476 | CD137 Microbead kit, human |
| 分选柱 | 130-042-401 | LS Columns |
| 细胞分离液 | 17089109-1 | Percoll |
| 胶原酶 | LS004180 | Collagenase, Type 3 |
| 胶原酶 | LS004174 | Collagenase, Type 2 |
| DNA酶 | AM2224 | DNASE I |
| 细胞因子 | 285-IF-100 | rhIFN-γ |
| 细胞因子 | 255-SC-01M | rh SCF |
| 细胞因子 | 236-EG-01M | rh EGF |
| 细胞因子 | 251-KG-010 | rh FGF-7 |
| 细胞因子 | 345-FG-025 | rh FGF-10 |
| 细胞因子 | 215-GM-050 | rh GM-CSF |
| 细胞因子 | 201-LB-01M | rh IL-1β |
| 细胞因子 | 204-IL-010 | rh IL-4 |
| 细胞因子 | 210-TA-005 | rh TNF-alpha |
| 细胞因子 | 206-IL-01M | rh IL-6 |
| 抗体 | AF-488-NA | Mouse/Rat Thrombopoietin/Tpo Antibody |
| 小分子化合物 | 2939/10 | A 83-01 |
| 小分子化合物 | 10010399-25mg | SB202190 |
| 小分子化合物 | 14010-1 | Prostaglandin E2 |
| 小分子化合物 | 1254/1 | Y-27632 dihydrochloride |
| 流抗 | 556547 | Annexin V FITC Apop Dtec Kit I 100Tst |
| 流抗 | 555553 | Mouse anti-human HLA-ABC (PE-conjugated) |
| 流抗 | 556650 | Mouse IgG1 k isotype control (PE-conjugated) |
| 流抗 | 555801 | Mouse anti-human CD107a (PE-conjugated) |
| 流抗 | 332771-100ug | Mouse anti-human CD3 (PerCP-Cy5.5-conjugated) |
| 流抗 | 555346 | Mouse anti-human CD4 (FITC-conjugated) |
| 流抗 | 562429 | Mouse anti-human CD8 (BV421-conjugated) |
| 流抗 | 554702 | Mouse anti-human IFNg (APC-conjugated) |
| 流抗 | 550890 | Mouse anti-human CD137 (APC-conjugated) |
| 流抗 | 555556 | Mouse anti-human HLA-DR/DP/DQ (sodium azide free) |
| 流抗 | 554724 | TRANSPORT INHIBITOR SOLN 0.7ML |
| 流抗 | 555029 | GolgiPlug Trnsp Inhb 1mL |
| 固定破膜剂 | 554714 | Fixation/Permeabilization solution kit |
| DNA纯化试剂盒 | 69504 | DNeasy blood and tissue kit |
PART2 Generation of Tumor-Reactive T Cells by Co-cultureof Peripheral Blood Lymphocytesand Tumor Organoids 外周血淋巴细胞和肿瘤类器官共培养生成肿瘤反应性 T 细胞
癌症免疫疗法已显示部分上皮性癌症患者的临床活性。但是目前针对研究个体患者的癌症 T 细胞相互作用和了解反应能力的决定因素依然比较缺乏。本篇文章建立并验证一个诱导和分析肿瘤特异T细胞平台以个性化的方式对上皮性癌症作出反应,并证明了自体肿瘤类器官和外周血淋巴细胞的共培养可用于富集错配修复缺陷型结直肠癌和非小细胞肺癌患者外周血中肿瘤反应的T细胞。
(1)错配修复缺陷型结直肠癌(dMMRCRC)类器官的特征,可以通过与类器官的共培养来诱导循环T细胞中的肿瘤反应性
错配修复缺陷直肠癌来源的肿瘤组织构建好类器官之后从形态学和免疫染色等方面验证了它具有原始肿瘤的的特征。接下来在干扰素(INF-γ)刺激后筛选MHCI类表达,从类器官中鉴定出9个MHC-I熟练的肿瘤类器官,结果发现被归类为MHCI类缺陷的肿瘤类器官是来源于MHCI类缺陷的肿瘤,这表明MHCI类的缺失不是类器官培养的特征。

图1、错配修复缺陷型结直肠癌(dMMRCRC)类器官的特征
△点击放大图片
(A) 肿瘤类器官和原始肿瘤组织的 H&E 染色。类器官显示出类似于原始肿瘤结构的形态。CRC-2 类器官显示类似于原发性肿瘤的充满粘蛋白的腺体的囊性小管。CRC-5 类器官和原发性肿瘤包括具有分层的管状腺体上皮。类器官 CRC-6P 包含在原发性肿瘤中也可见的复杂筛状腺体。类器官 CRC-6M 由不规则的小梁结构组成,形成不良的腺体,类似于转移。
(B) 肿瘤类器官的突变负荷,由每个肿瘤外显子组的非同义突变数量决定。
(C) 根据 TCGA,在超突变结直肠癌中显着突变的基因的突变状态。突变基因以红色表示。
(D) 流式检测细胞表面 MHC I 类表达。用 200 ng/mL IFNg 刺激类器官 24 小时或不进行刺激。
(E) 流式检测细胞表面 PD-L1 表达。用 200 ng/mL IFNg 刺激类器官 24 小时或不进行刺激。
有50%自体肿瘤类器官在共培养2周后,INF-γ分泌和CD107a在自体肿瘤类器官刺激诱导的CD8+T细胞中上调,并且这种反应是可以重复出来的。接下来实验也验证了CRC-9的高反应性表明存在一个肿瘤反应性的T细胞群。那T细胞在与肿瘤类器官共培养前肿瘤反应性是怎么样的呢。实验用来自已经发生了肿瘤反应CRC-9患者的大量CD8+T细胞,在共培养2周后,发现这一细胞群出现的频率增加了约10倍,但是来自CRC-11、CRC-12和CRC-13患者的T细胞在类器官共培养前没有显示出任何的肿瘤反应性,这说明T细胞和类器官的共培养可以用于扩大之前没发现肿瘤反应的T细胞群。

图2、通过与自体肿瘤类器官共培养来诱导循环 T 细胞的肿瘤反应性
△点击放大图片
(A) 实验工作流程。从 dMMR CRC中建立肿瘤类器官,并在与来自同一患者的外周血淋巴细胞共培养之前用IFNg刺激24小时。每周用新鲜的肿瘤细胞刺激PBL,后用流式评估2周的T 细胞和肿瘤类器官共培养对 T 细胞杀伤性的影响。
(B) 在与自体共培养2周后,对 CD8+ T 细胞流式分析。
(C) 与自体共培养2周获得的类器官 CD8+ T 细胞诱导的、IFNg 产生和 肿瘤类器官CD107a 细胞表面的表达情况。
(D) 在 PBL 分离后或 2 周后对患者 CRC-9 的 CD8+ T 细胞进行流式分析。
(E) PBL 分离后,与自体肿瘤类器官共培养2 周获得的类器官诱导的IFNg 产生和 CD8+ T 细胞的 CD107a 细胞表面表达情况。
(2)诱导非小细胞肺癌(NSCLC)患者循环T细胞的肿瘤反应性
接下来的实验验证了类器官与从外周血中获得肿瘤反应性T细胞群共培养的策略也可用于NSCLC。通过类似CRC类器官的方法生成了NSCLC类器官,这些类器官在INF-γ刺激下表达不同水平的PD-L1。体外实验发现PBMCs暴露于自体肿瘤类器官中共培养2周后,有2例患者肿瘤反应性CD8+群体有出现扩大,但是在与类器官共培养之前,没有均一的出现这些反应。系列实验表明在与两种上皮性肿瘤中共培养的PBMCs和自体肿瘤类器官来诱导患者特异性肿瘤反应性T细胞反应这种方法还是可行的。
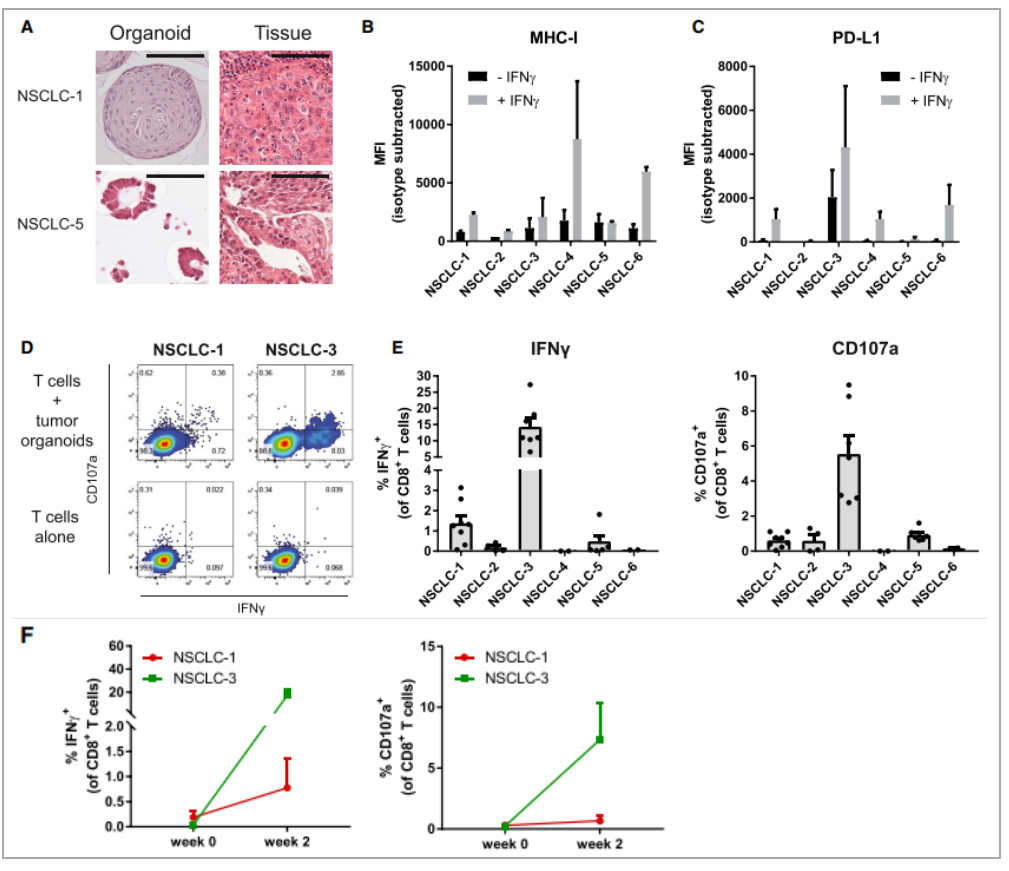
图 3. NSCLC 患者循环 T 细胞肿瘤反应性的诱导
△点击放大图片
(A) 肿瘤类器官和原始肿瘤组织的H&E染色。类器官显示出类似于原始肿瘤结构的形态。
(B、C) 流式检测细胞表面的MHC I 类和 PD-L1 (C) 表达。实验组为用 200 ng/mL IFNg 刺激类器官 24 小时,对照组是没有受到刺激。
(D) 在与肿瘤类器官自体共培养2周后,流式分析CD8+ T细胞的肿瘤反应性。
(E) 通过与肿瘤类器官自体共培养2周获得的CD8+ T 细胞的类器官诱导的 IFNg 产生和 CD107a 细胞表面表达的量化检测。
(F) PBL 分离后直接或通过 2 周自体肿瘤类器官共培养获得的类器官诱导的 IFNg 产生和 CD8+ T 细胞的 CD107a 细胞表面表达的量化。
(3)类器官反应性 T 细胞反应的特异性和CD4+ T 细胞对异种组织培养成分的反应性
为验证肿瘤类器官诱导T细胞的反应性对INF-γ的依赖性,实验与经过INF-γ预刺激和没有经过INF-γ预刺激的肿瘤类器官进行了对CD137激活T细胞反应的情况比较,结果发现无论INF-γ预刺激如何,对肿瘤类器官的CD8+T细胞反应都基本一致。接下来为了分析T细胞对用于诱导肿瘤类器官的反应性的限制,实验建立了正常的结肠和肺类器官,并进行了PBLs共培养实验,结果发现T细胞的反应性只出现在了PBLs共培养肿瘤类器官中,正常的组织或pMMRCRC类器官中则没有观察到这一反应性。接下来的系列实验也验证了在共培养过程中,被诱导的T细胞应答仅限于肿瘤类器官。

图 4. 类器官反应性 T 细胞反应的特异性
△点击放大图片
(A) 用 200 ng/mL INF-γ预刺激和没有经过INF-γ预刺激的肿瘤类器官进行了对CD137激活T细胞反应的情况比较。
(B) 流式分析用肿瘤器官或健康结肠器官刺激的 CD8+ T 细胞。
(C) 对用肿瘤类器官或健康结肠类器官刺激的CD8+ T细胞进行CD137表达进行量化分析。
(D) 流式分析通过与错配修复缺陷 (dMMR) CRC 类器官共培养 2 周获得的 CD8+ T 细胞。
(E) 用 dMMR CRC 类器官或错配修复熟练 (pMMR) CRC 类器官重新刺激的类器官,通过与 dMMR CRC 共培养 2 周获得的 CD8+ T 细胞的类器官诱导的 IFNg 产生和 CD107a 细胞表面表达量的检测。
(F) 用肿瘤消化物、正常肺消化物、NSCLC 类器官或健康肺类器官刺激的 CD8+ T 细胞的流式分析。
(G) 用肿瘤消化物、正常肺消化物、NSCLC 类器官或健康肺类器官刺激的CD8+ T 细胞产生的IFNg 的检测。
除了肿瘤反应性CD8+T细胞反应外,实验还发现在肿瘤类器官刺激下发生的CD4+T细胞反应,而且在有些情况下CD4+T细胞的反应性在正常组织对照类器官也会出现。那CD4+T细胞的反应性的反应性是来源于哪儿呢?实验取患者CRC-1的PBMCs并生成单核细胞来源的树突状细胞,并加上基质胶或照射过的肿瘤细胞或健康结肠类器官。结果发现共培养系统诱导的CD4+T细胞的应答不是针对肿瘤抗原的。
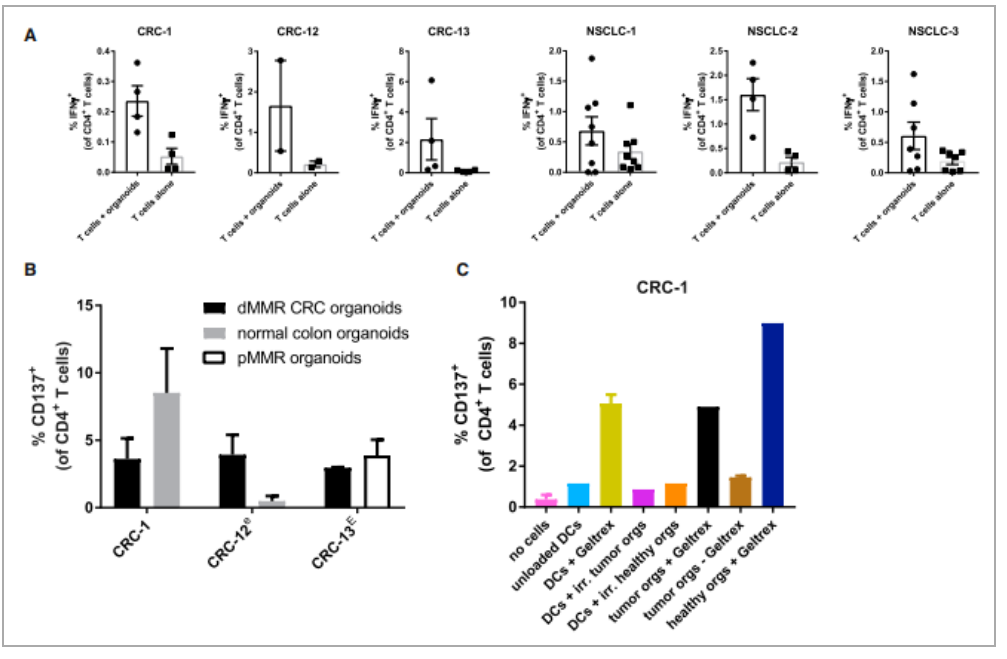
图 5. CD4+ T 细胞对异种组织培养成分的反应性
△点击放大图片
(A)通过与自体肿瘤类器官共培养2周获得的CD4+ T细胞自发和器官诱导的IFN-γ产生的定量检测。
(B)用于诱导的肿瘤类器官、正常结肠类器官或来自同一患者的 pMMR CRC。通过与自体肿瘤类器官共培养 2 周获得 T 细胞,并在指定的情况下进一步使用快速扩增方案进行扩增在某些情况下,之前是基于 CD137 的肿瘤反应性细胞富集。
(C)PBMCs并生成单核细胞来源的树突状细胞,并加上基质胶或照射过的肿瘤细胞或健康结肠类器官进行共培养,检测CD137的表达量。
(4)ILTCKs 具有不同于CD8+ T的转录组,其抗原受体可以识别未突变的肿瘤抗原
那类器官可否作为评估T细胞破坏肿瘤的工具呢?实验把肿瘤类器官与自体肿瘤反应性T细胞共培养3天,然后检测T细胞的存活率,结果发现暴露于自体T细胞的肿瘤类器官存活率显著降低。MHCI类阻断抗体的可以提升肿瘤细胞的存活,这说明也会出现抗原特异性CD8+T细胞反应。接下来的实验也验证了T细胞能有效地杀死肿瘤类器官,但不会对健康类器官的存活造成影响。各种数据也表明,上皮性肿瘤类器官可以作为评估T细胞破坏肿瘤的工具。

图6、肿瘤类器官被自体肿瘤反应性 T 细胞杀死
△点击放大图片
(A) 检测T 细胞共培养时的杀伤力。共培养3天后,类器官解离成单细胞,并用流式检测细胞死活。
(B)在存在绿色荧光caspase-3/7探针的情况下培养或没有T细胞的NSCLC-1类器官72小时观察。类器官是共培养前用 CellTrace Yellow(洋红色)标记,加入 T 细胞后出现凋亡(绿色)细胞。当 MHC I 类和 MHCII 类被阻断,T 细胞聚集在类器官周围,但细胞凋亡减少,类器官仍然较大。
(C)对匹配的 NSCLC 和健康肺类器官的杀伤检测。
(D)在有或没有 T 细胞的情况下,在caspase-3/7 探针绿色荧光存在下培养 72 小时后检测NSCLC-3的健康和肿瘤类器官情况。
这篇文章阐述了外周血淋巴细胞和肿瘤类器官共培育获得的肿瘤应答T细胞具有肿瘤特异性和杀伤性,这进一步推动了肿瘤免疫治疗的发展。
本篇文章用到的部分产品小优也给大家整理好了,感兴趣的老师可以联系优宁维哦!
| 分类 | 货号 | 名称 |
| 基质胶 | 3533-005-02 | Cultrex PathClear BM |
| 基质胶 | BME001-05 | Cultrex UltiMatrix |
| 细胞因子 | 236-EG-01M | rhEGF |
| 细胞因子 | 4645-RS-025 | rhR-Spondin 1 |
| 细胞因子 | 6057-NG-025 | rhNoggin |
| 细胞因子 | 3718-FB-025 | rhFGF basic/FGF2 |
| 细胞因子 | 5036-WN-010 | rhWnt-3a |
| 细胞因子 | 285-IF-100 | rhIFN-γ |
| 细胞因子 | 202-IL-050 | rhIL-2 |
| 小分子化合物 | 1254/50 | Y-27632 dihydrochlor |
| 小分子化合物 | 2939/50 | A 83-01 |
| 小分子化合物 | 4423 | CHIR 99021 |
| 抗体 | 744394 | Hu CD137 Ligand BV605 C65-485 |
| 抗体 | 742229 | Hu CD8 BB700 HIT8a |
| 抗体 | 566557 | Hu CD107a BB700 H4A3 |
| 抗体 | 566960 | Hu IFN-γ R718 B27 |
| 抗体 | 13684T | PD-L1 (E1L3N®) XP® Rabbit mAb |
| 细胞分离液 | 17144002 | FICOLL PAQUE PLUS |