自噬
在外界压力、饥饿、缺氧和内质网应激等特殊情况下,细胞受自噬相关基因的调控,利用溶酶体降解、选择性地清除自身受损、衰老或过剩的生物大分子和细胞器,释放出游离小分子供细胞回收利用的正常动态生命过程。
自噬被认为是机体的一种自我生存机制,它在细胞和组织动态平衡中起到关键作用。
自噬机制的受损会诱发一系列疾病包括肿瘤、神经退行性疾病、代谢相关疾病、免疫性疾病、微生物感染等。
2016 年日本细胞生物学家大隅良典因“在细胞自噬机制方面的发现”获得诺贝尔奖。他的研究开启了理解自噬作用在许多胜利过程中关键作用的崭新道路。
建立自噬模型,研究自噬的发生机制、自噬与疾病的关系近年来一直是热门研究方向。
分类
根据包裹物质及运送方式的不同可将自噬分为三类:巨自噬(Macroautophagy),微自噬(Microautophagy)和介导自噬(Chaperone-mediated autophagy),通常说的自噬泛指巨自噬。
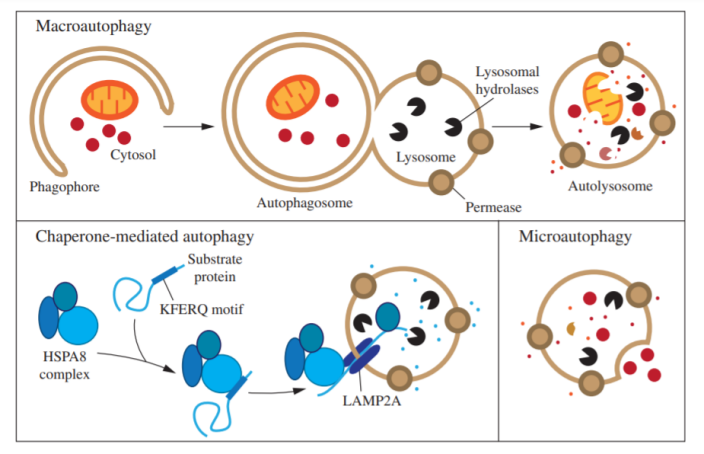
图1 自噬分类示意图
△点击放大图片
过程
自噬的本质其实是细胞内的膜重排,一个完整的自噬过程包括自噬启动、自噬体形成、自噬溶酶体形成,降解及再利用。
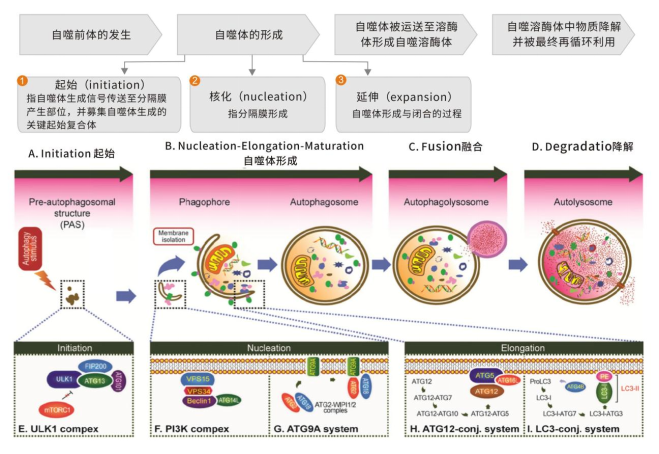
图2 自噬过程示意图
△点击放大图片
细胞自噬重要基因和自噬中的信号通路相关信息可查看《细胞死亡与细胞功能》
小优细节君今天要介绍的主角是目前公认的自噬标记物:微管相关蛋白1的轻链3(microtubule-associated-proteinlight-chain-3,LC3)
LC3蛋白合成后被具有蛋白内切酶活性的Atg4在羧基端剪切,产生胞浆定位的LC3-I。在自噬过程中,LC3-I会被包括Atg7和Atg3在内的泛素样体系修饰、加工,与磷脂酰乙醇胺(PE)偶联,形成脂质化形式的 LC3-II,定位于自噬体的内外膜上。
自噬体和溶酶体融合后,外膜上的LC3-II被Atg4切割,产生LC3-I循环利用;内膜上的LC3-II被溶酶体酶降解,导致自噬溶酶体中LC3含量很低。
因而,LC3蛋白水平被用来作为自噬评价和测定的公认指标,当与溶酶体抑制剂联用时,可以量化自噬流(一定时间内自噬过程发生的强度)。
总结:在自噬体形成过程中,胞浆定位的LC3-I与PE结合并插入到自噬体的双层膜中形成LC3-II。
LC3 检测要点
01 样本表达
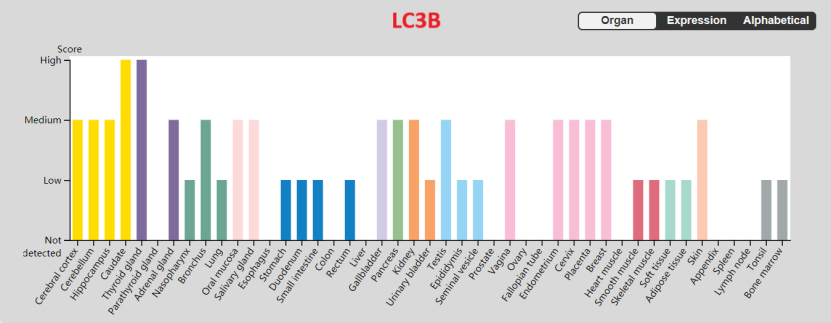
在哺乳动物中,存在 4 种LC3 同工型(LC3A、LC3B、 LC3B2和 LC3C),在不同的组织细胞中表达会有差异。
目前主要研究的是LC3A和LC3B,LC3A主要在大脑中表达,其他组织的表达较低。LC3B在脑、内分泌组织等有较高的表达,在肝脏、结肠、心肌、脾脏等基本不表达。LC3B2许多组织中都有较高的表达,在骨骼肌中基本不表达。

△点击放大图片
△点击放大图片
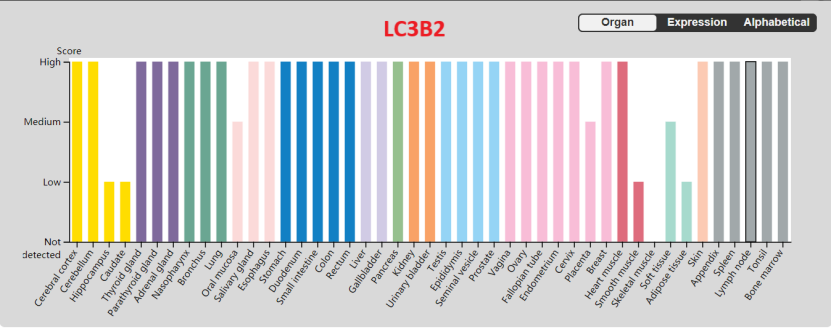
图3 人体组织中LC3A、LC3B、LC3B2的蛋白表达水平差异(来源:The Human Protein Atlas)
△点击放大图片
02 特殊处理、药物抑制
LC3-I和LC3-II存在一个生成-降解的动态过程。自噬小体有一个生成、融合、降解的过程,即“自噬流”。
所以,单时间点LC3-II的表达改变并不能体现自噬的改变,需要使用一些阻断溶酶体降解的药物(如氯喹、巴佛洛霉素A1等),判断在干预手段下,细胞的自噬程度的改变。
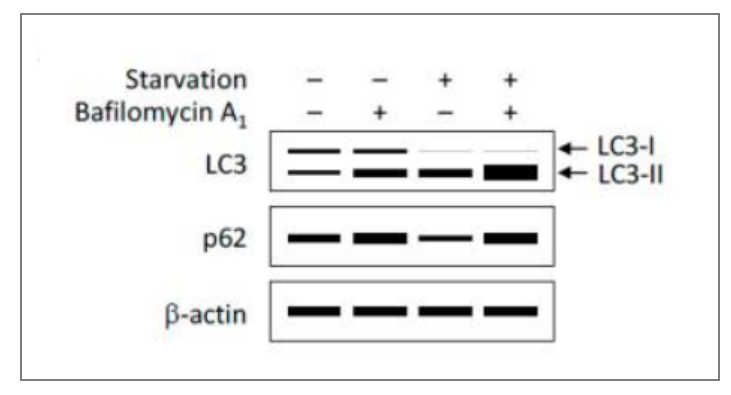
图4 饥饿或巴佛洛霉素A处理对自噬的影响
△点击放大图片
03 结果分析
部分细胞本身LC3-I的基础水平就很低, LC3-I本身就很容易降解,也更易在SDS上样缓冲液中降解, 对反复冻融更为敏感。
目前的LC3抗体所检测的抗原表位都位于LC3的N端,由于PE基团结合可能导致N端区域的构象变化,使得抗体对LC3-II的亲和性更高,所以LC3-II条带显色深并不能代表该样本处于高自噬状态。
在半定量时,除了使用LC3-II/LC3-I的比值外,也有科学家使用LC3-II与管家蛋白(Housekeeping Protein)的比值进行半定量。
图5 CST LC3A/B Antibody #4108
△点击放大图片
LC3的条带数与样品本身有关。有的细胞系检测到的可能就只有一条带,即使是同一细胞系,细胞状态不同,样本上样量不同,曝光时间不同等因素都会导致只能看到一条带。这跟细胞的状态,细胞的处理条件也有关系,遇到问题需要具体分析。
04 膜相关蛋白
作为脂化和膜相关蛋白,在细胞裂解后,对其进行冰上短暂超声,促进蛋白的溶解,将LC3从膜上解离。
超声方法:35-40%的功率条件下破碎3次,每次超声10秒,每次间隔10秒。如没有超声仪,可用1ml注射器针头,冰上反复抽打裂解液10次左右,达到类似于超声的效果。
05 小分子蛋白
LC3-I的分子量约16KD,由于LC3-II接合了PE基团,理论上LC3-II的分子量比LC3-I更高。但是,由于带负电的PE改变了LC-II的性质,使其疏水性更强,导致其在电泳中迁移率更高,所以在SDS-PAGE中LC3-II显得分子量比LC3-I小。
LC3-I与LC3-II仅有2KD差异,在WB中需注意:建议使用高浓度分离胶(如15%)进行分离;转膜时,使用小孔径0.22um转印膜,湿转70V 1.5h,可用丽春红染色观察转膜效果。
部分推荐产品:
| 货号 | 产品名称 |
| 4599S | LC3A (D50G8) XP® Rabbit mAb |
| 86060S | LC3A (E5C9B) Rabbit mAb |
| 2775S | LC3B Antibody |
| 3868S | LC3B (D11) XP® Rabbit mAb |
| 83506S | LC3B (E5Q2K) Mouse mAb |
| 4108S | LC3A/B Antibody |
| 12741S | LC3A/B (D3U4C) XP ® Rabbit mAb |
| 14723S | LC3C (D1R8V) Rabbit mAb |
| 4445T | Autophagy Antibody Sampler Kit |
| abs815906-1mg | Bafilomycin A1 |
| abs817875-5mg | Wortmannin |
| abs810030 | Rapamycin |
| abs810575-25mg | 3-MA |
| abs880011-1kit | Autophagy agonist and inhibitor kit |
参考文献:
Parzych KR, Klionsky DJ. An overview of autophagy: morphology, mechanism, and regulation. Antioxid Redox Signal. 2014 Jan 20;20(3):460-73. doi: 10.1089/ars.2013.5371. Epub 2013 Aug 2. PMID: 23725295; PMCID: PMC3894687.
Li X, He S, Ma B. Autophagy and autophagy-related proteins in cancer. Mol Cancer. 2020 Jan 22;19(1):12. doi: 10.1186/s12943-020-1138-4. PMID: 31969156; PMCID: PMC6975070.
Yoshii SR, Mizushima N. Monitoring and Measuring Autophagy. Int J Mol Sci. 2017 Aug 28;18(9):1865. doi: 10.3390/ijms18091865. PMID: 28846632; PMCID: PMC5618514.
Glick D, Barth S, Macleod KF. Autophagy: cellular and molecular mechanisms. J Pathol. 2010 May;221(1):3-12. doi: 10.1002/path.2697. PMID: 20225336; PMCID: PMC2990190.
Levine B, Kroemer G. Biological Functions of Autophagy Genes: A Disease Perspective. Cell. 2019 Jan 10;176(1-2):11-42. doi: 10.1016/j.cell.2018.09.048. PMID: 30633901; PMCID: PMC6347410.
https://www.univ-bio.com/study-center/solution/PCD.html