01 认识线粒体乙酰化
近年来,蛋白翻译后修饰可以算是在生命科学研究领域一直持续不退的的研究热点之一。蛋白质翻译后修饰 (Protein translational modifications,PTMs) 是指在蛋白质合成的过程中,某些具有生物化学功能性基团在修饰酶的作用下共价结合到蛋白质骨架或者侧链上,形成一种化学修饰。通过这些翻译后修饰,在许多生物学过程中发挥着重要的作用,并与人类的多种疾病的发生息息相关。目前已知的蛋白质翻译后修饰有400多种类型。其中磷酸化、糖基化、甲基化、乙酰化、泛素化为几种主要的蛋白质翻译后修饰类型,这些在小优之前的推文中也有阐述哦,感兴趣的老师可以翻阅。
目前研究最多的是组蛋白的乙酰化修饰,其在表观调控过程中至关重要。乙酰化修饰(acetylation)是指在酶(或非酶)的作用下将乙酰CoA的乙酰基团转移至蛋白质氨基酸残基上。之前小优也给大家解析过一篇关于组蛋白乙酰化的文章。其实除了组蛋白乙酰化外,在胞浆和其他亚细胞中的大量蛋白上,也存在着丰富的乙酰化修饰,我们称为非组蛋白的乙酰化修饰,部分非组蛋白修饰在代谢调控功能中也至关重要。
线粒体是细胞中必不可少的细胞器,作为细胞能量供应中心,不仅产生ATP,还产生活性氧(ROS)和生物合成代谢物。作为代谢信号中心,线粒体能够激活细胞信号通路和核基因表达来调节多种细胞过程。
已有研究证明,线粒体乙酰化广泛存在,是线粒体蛋白的重要调控机制,线粒体的乙酰化由定位于线粒体的去乙酰化酶家族中的sirt家族介导。sirt3是NAD+依赖的去乙酰化酶,是第一个被发现的线粒体去乙酰化酶,随后的研究发现定位于线粒体中的sirt4、sirt5也介导线粒体乙酰化的去乙酰化。
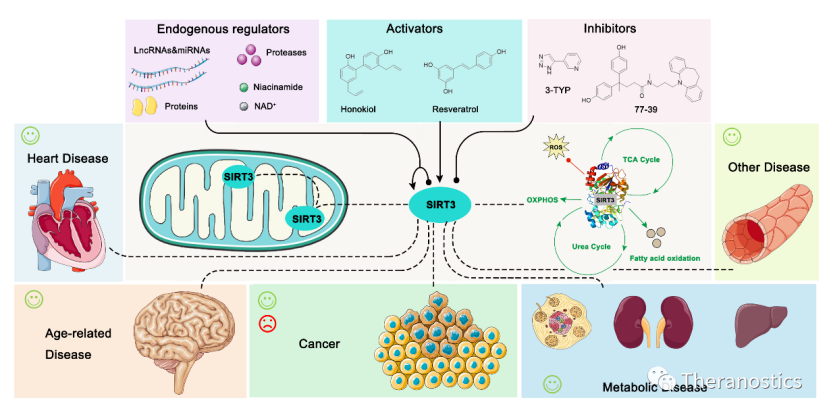
02 线粒体乙酰化相关疾病
线粒体作为细胞能量控制的细胞器,参与葡萄糖、脂肪酸和氨基酸等物质的分解与合成代谢,调控细胞生理和病理活动,当然线粒体的乙酰化也参与多种疾病发生的过程。线粒体蛋白过度乙酰化可以加速糖酵解反应,进而促销恶性肿瘤的发生;此外高代谢率的组织和器官对线粒体功能障碍更为敏感,线粒体的过度乙酰化也被证明参与衰老,神经退行性疾病,肝脏疾病,肾脏疾病,心脏病和其他代谢性疾病的发生发展进程。SIRT的去乙酰化功能,可以抑制线粒体的过度乙酰化,因此目前,SIRT3也作为多种人类疾病有希望的治疗靶标。
△点击放大图片
03 经典文献解读
近年来乙酰化、线粒体、代谢也是国自然研究热点。
在这里,小优精心研读了一篇关于线粒体乙酰化和代谢相关发表于Cell Death Disease.(IF:9.685)的高分文章,文章内容有点长,大概需要5min时间,建议大家收藏再阅读哦!
去乙酰化酶3在肾纤维化过程中调节肾小管上皮细胞线粒体蛋白乙酰化和代谢

△点击放大图片
该文章揭示了近端肾小管上皮细胞( TECs )参与调节能量代谢的线粒体蛋白在TEC中被乙酰化并被SIRT3(去乙酰化酶)靶向。SIRT3在赖氨酸385处对丙酮酸脱氢酶E1α(PDHE1α)的去乙酰化在与肾纤维化相关的代谢重编程中起着关键作用。
(1) 在人类慢性肾脏疾病(CKD)中鉴定SIRT3调节的乙酰化
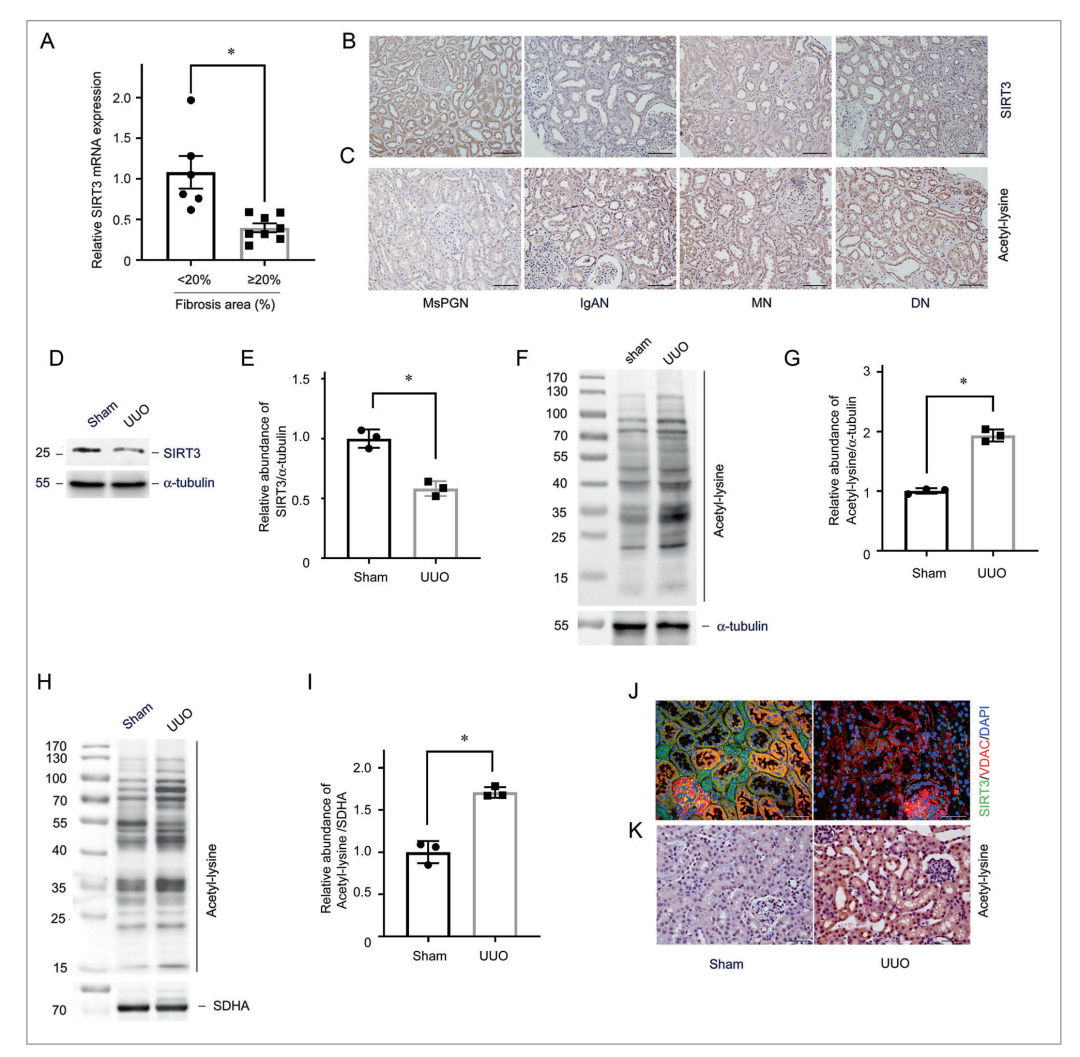
图1 SIRT3调节肾纤维化中管状线粒体蛋白的乙酰化
△点击放大图片
基质沉积面积超过20%的高纤维化组的SIRT3 mRNA水平降低(图1A)。通过免疫染色发现,SIRT3蛋白主要定位于正常肾脏的肾TEC中,但在各种CKD患者的肾活检中,在纤维化区域中减少。此外,正常肾脏的乙酰化量较低,纤维化肾脏的样品中乙酰化量增加(图1C)。
(2) 肾纤维化小管中SIRT3缺失导致线粒体蛋白过度乙酰化
Western印迹分析显示,在单侧输尿管梗阻(UUO)的小鼠中,SIRT3的表达以时间依赖性的方式降低,同时纤维连接蛋白(FN)和I型胶原表达增加(图1D,E),导致蛋白质乙酰化的整体升高(图1F,G)。因为SIRT3是线粒体脱乙酰酶,我们在UUO后从小管中分离线粒体,从UUO小鼠的小管中检测到线粒体蛋白乙酰化增加(图1H,I),免疫染色进一步证实了线粒体中SIRT3的降低和乙酰化的增加(图1J,K,)。
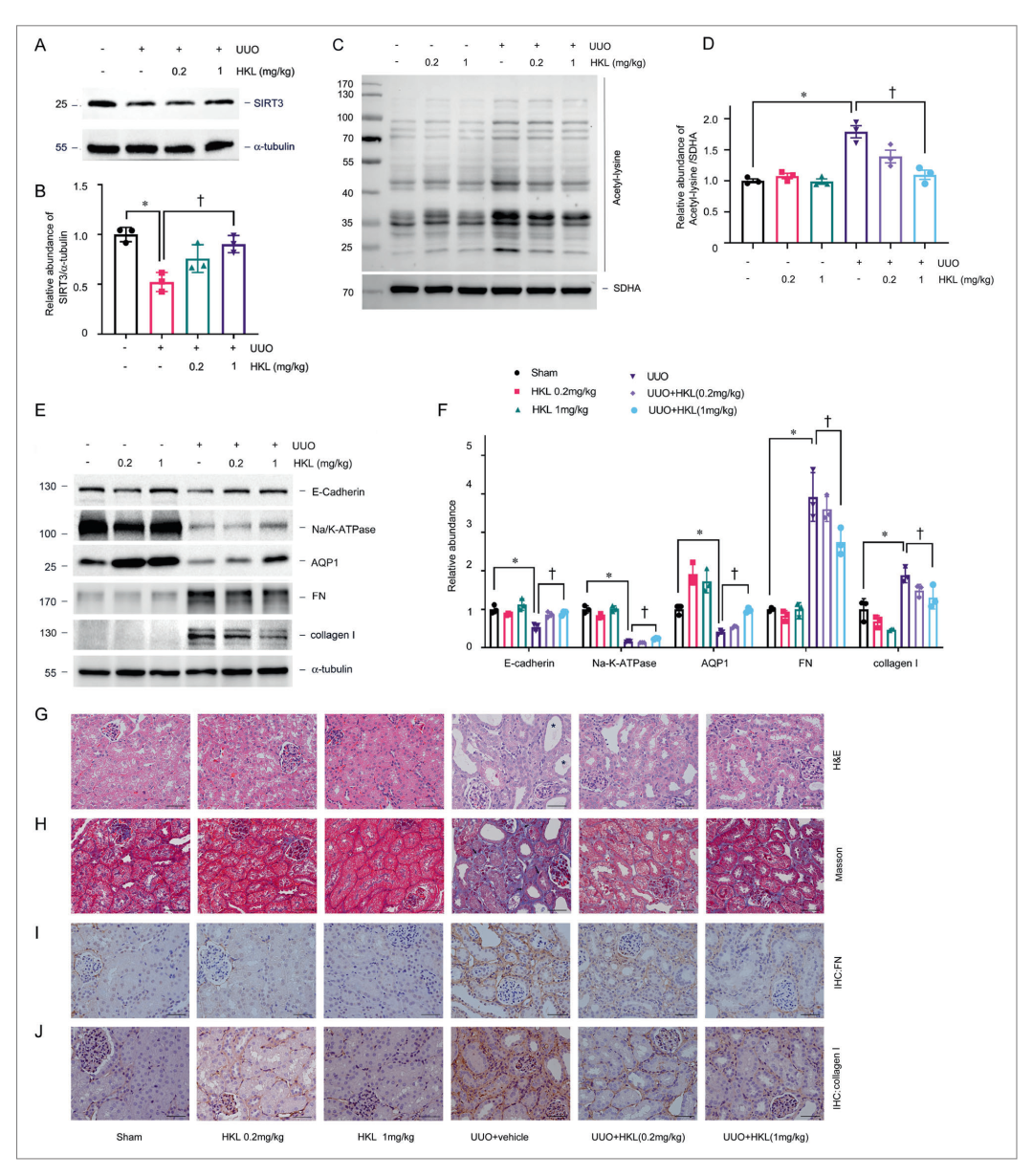
图2 和厚朴酚减少线粒体乙酰化和肾脏纤维化
△点击放大图片
本文用和厚朴酚(HKL)(SIRT3的激活剂)治疗C57BL/6J雄性小鼠,发现HKL恢复了SIRT3的表达,并显著降低了小管中的线粒体乙酰化(图2A–D)。并且研究了SIRT3激活是否与肾小管损伤和肾纤维化相关。HKL保留了近端小管细胞标记物(包括Na/K-ATP酶、水通道蛋白1(AQP1)和E-钙粘蛋白的表达,减轻了小管萎缩,并减少了UUO诱导的胶原I、FN表达所指示的细胞外基质蛋白的积累(图2E–J)。
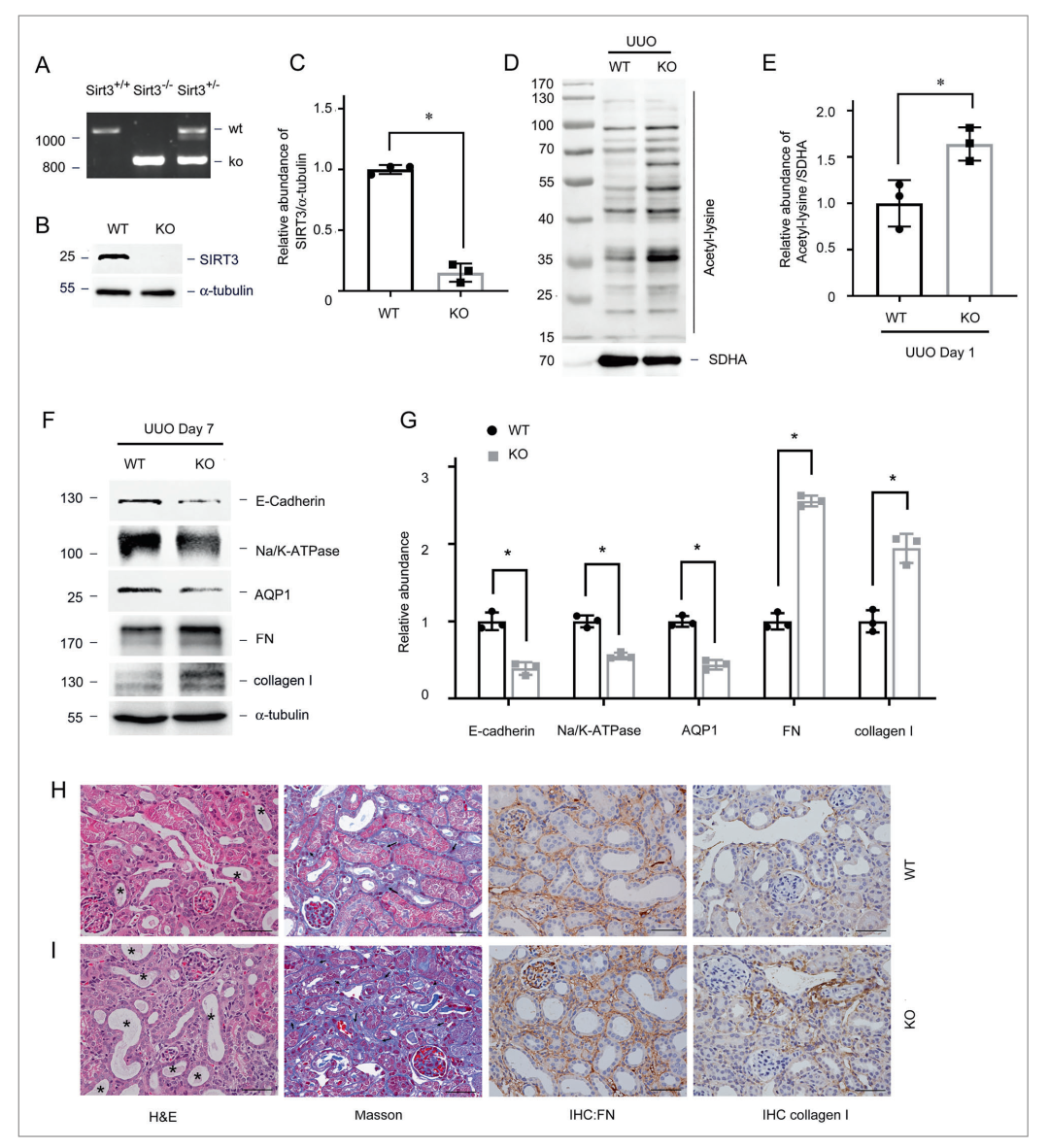
SIRT3的敲除加重肾脏纤维化。
△点击放大图片
通过分析Sirt3敲除(KO)小鼠的线粒体乙酰化谱(图3A-C)。与野生型(WT)对照同窝小鼠相比,Sirt3 KO小鼠在UUO后出现明显的线粒体乙酰化和严重纤维化(图3D–I)。
(3) SIRT3在体外调节线粒体乙酰化

图4 SIRT3调节TGF - β 1诱导的TECs线粒体高乙酰化
△点击放大图片
转化生长因子-β(TGF-β)是肾纤维化的主要调节因子,TEC与TGF-β1孵育1小时导致SIRT3表达降低,线粒体乙酰化增加(图4A–E)。与体内结果一致,HKL激活SIRT3也减少了线粒体乙酰化,并阻断了TGF-β1诱导的TEC表型变化(图4F–I)。我们用3-(1H-1,2,3-三唑-4-基)吡啶(3-TYP)阻断SIRT3,并评估了破坏SIRT3调节的线粒体乙酰化的效果。3-TYP发挥了与上述TGF-β1相同的表型转化(图4J–M)。我们研究了用针对Sirt3的小干扰(si)RNA抑制Sirt3表达对乙酰化的影响,以确定Sirt3在乙酰化中的作用。TEC中SIRT3表达减少导致线粒体乙酰化增加(图4N–O)并诱导TEC损伤(图4P–Q),这与3-TYP的作用一致。这些体外数据表明,SIRT3介导与促纤维化刺激相关的TEC中线粒体乙酰化的增加。
(4) 促纤维化刺激显著改变了小管线粒体蛋白乙酰化
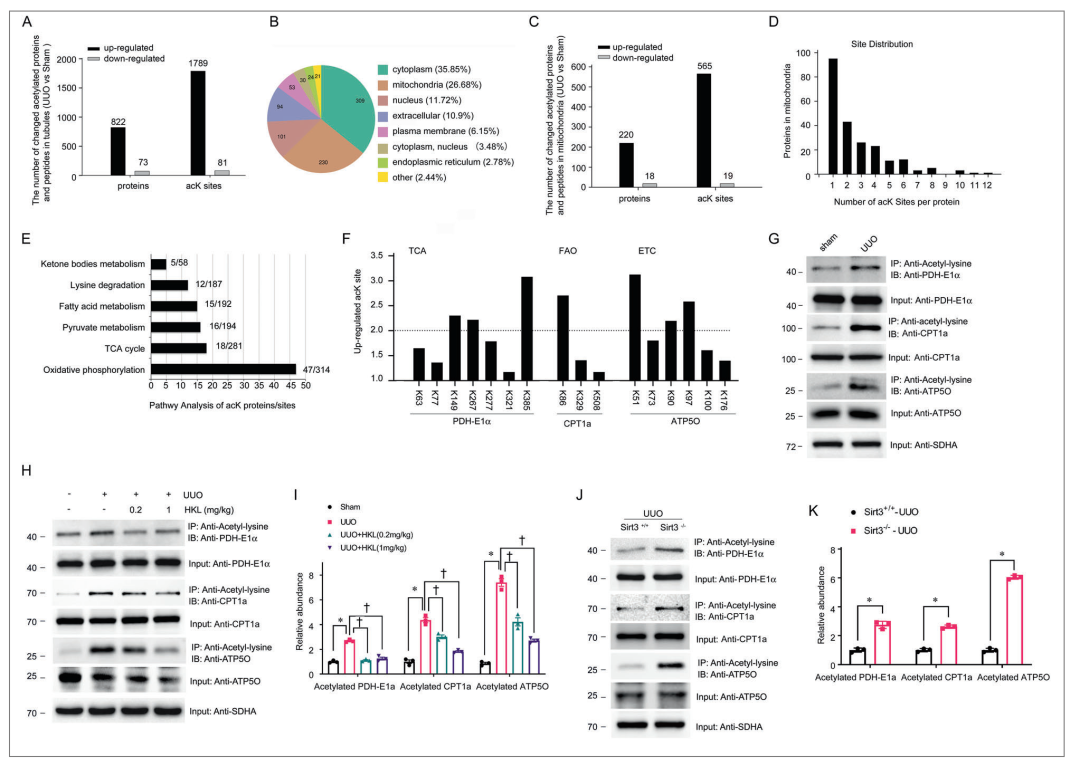
图5 在肾纤维化中SIRT3的缺失导致线粒体乙酰化
△点击放大图片
822个蛋白质中1789个位点的乙酰化在UUO小鼠中增加了两倍以上(图5A)。根据这些蛋白质的GO细胞区室注释来评估这些蛋白质,以确定修饰蛋白质的亚细胞定位。改变的乙酰化蛋白大部分位于细胞质中,占所有改变蛋白的35.85%。线粒体占改变的乙酰化蛋白的26.68%(图5B)。分析了纤维化肾脏线粒体中乙酰化修饰蛋白的变化,在238个( 92.44 % )线粒体蛋白发生改变的位点中,有220个( 565个)位点的乙酰化水平升高> 2倍,占所有乙酰化位点的96.91 % (图5C )。线粒体蛋白被多乙酰化,57.4%具有至少两个AcK位点(图5D)。
对高乙酰化线粒体蛋白进行通路富集分析,发现主要通路受赖氨酸乙酰化调控,如氧化磷酸化( 47种蛋白质中的313个位点)、TCA循环( 18种蛋白质中的281个位点)、丙酮酸代谢( 16种蛋白质中的194个位点)、脂肪酸代谢( 15个蛋白的192个位点)、赖氨酸降解( 12种蛋白质中的187个位点)、酮体代谢( 5个蛋白质中的58个位点)等(图5E)。因为近端TEC的代谢活动主要依靠线粒体FAO产生ATP供能。并进一步确定了参与线粒体代谢途径中大多数酶过程的线粒体蛋白上的赖氨酸乙酰化位点(补充材料)。
然后,我们检查了参与TCA循环、FAO和ETC的蛋白质中的乙酰化位点。我们发现,TCA循环中PDHE1α中的三个位点、ETC中肉碱棕榈酰转移酶1(CPT1)中的一个位点和ATP合成酶亚基O(ATP5O)中三个位点增加了2倍以上(P<0.01)(图5F)。为了进一步证实线粒体蛋白的乙酰化,我们使用抗AcK抗体免疫沉淀从对照手术小鼠和UUO小鼠分离的管状线粒体裂解物,并对其进行针对PDHE1α、CPT1a和ATP5O的蛋白质印迹。研究结果证实,纤维化肾小管中的线粒体蛋白高度乙酰化(图5G)。
这些数据总体上表明,促纤维化刺激导致与代谢途径相关的线粒体蛋白的过度乙酰化。
(5) 线粒体代谢由SIRT3通过乙酰化调节
已有研究表明,SIRT3调控线粒体蛋白的乙酰化。HKL阻断UUO (图5H , I)小鼠PDHE1 α、CPT1a和ATP5O的高乙酰化。相反,有UUO的Sirt3 KO小鼠比WT小鼠(图5J , K )有更多的乙酰化PDHE1 α、CPT1a和ATP5O。总之,这些结果表明SIRT3可以抵消在肾纤维化进展过程中乙酰化对线粒体代谢的影响。

图6 在纤维化肾脏的小管中,PDHE1 α的乙酰化增加
△点击放大图片
对UUO小鼠肾小管上调乙酰化蛋白进行细胞组分GO富集分析,发现丙酮酸脱氢酶复合体( PDHC )是富集最明显的GO term (图6A)。之前用抗Ac K免疫沉淀管状线粒体裂解液,在纤维化肾脏中发现高乙酰化的PDHE1 α (图5G )。已有研究表明,PDHE1 α乙酰化导致PDHE1 α磷酸化,抑制丙酮酸脱氢酶复合体( PDC )活性。本研究从纤维化肾脏分离的肾小管,进行酶活实验和蛋白免疫印迹也发现,赖氨酸PDHE1 α乙酰化增加伴随着PDH酶活性降低和PDHE1 α磷酸化的增加(图6B - D)。
通过HKL激活Sirt3抑制PDHE1 α磷酸化并恢复UUO (图6E - G)小鼠PDH酶活性。相反,UUO的Sirt3 KO小鼠有更多的PDHE1 α磷酸化,并且伴随PDH酶活性降低(图6H - J).
(6) SIRT3通过PDHE1α脱乙酰调节PDH酶活性
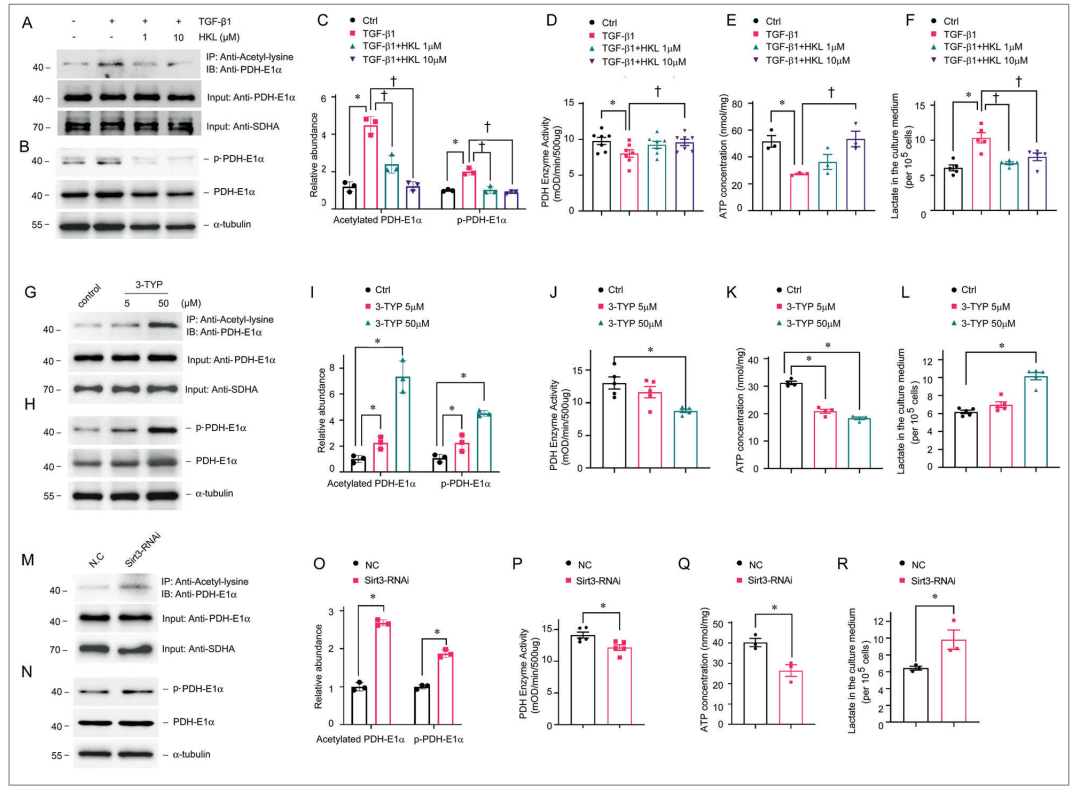
图7 SIRT3调控肾小管上皮细胞PDHE1 α乙酰化和PDH酶活性
△点击放大图片
本文研究了SIRT3在体外与TGF-β1孵育的TEC中对PDHE1α乙酰化的调节作用。我们发现,PDHE1α乙酰化的增加伴随着PDH酶活性的降低和PDHE1β磷酸化的增加(图7A–D)。HKL对SIRT3的激活抑制了PDHE1α乙酰化,HKL恢复了正常水平的磷酸化的PDHE1β、PDH酶活性、ATP水平和乳酸盐生成(图7A-F)。使用3 - TYP抑制SIRT3活性,并通过Sirt3 siRNA转染抑制SIRT3表达,3 - TYP或Sirt3 siRNA转染均使PDHE1 α乙酰化增加,PDHE1β磷酸化增加,PDH酶活性降低,ATP水平降低,乳酸产量增加(图7G–R)。以上结果表明SIRT3在PDHE1 α去乙酰化中发挥作用,并且在肾纤维化的发展过程中是调节TECs中的代谢开关。
(7) 乙酰化调节PDHE1α活性的位点
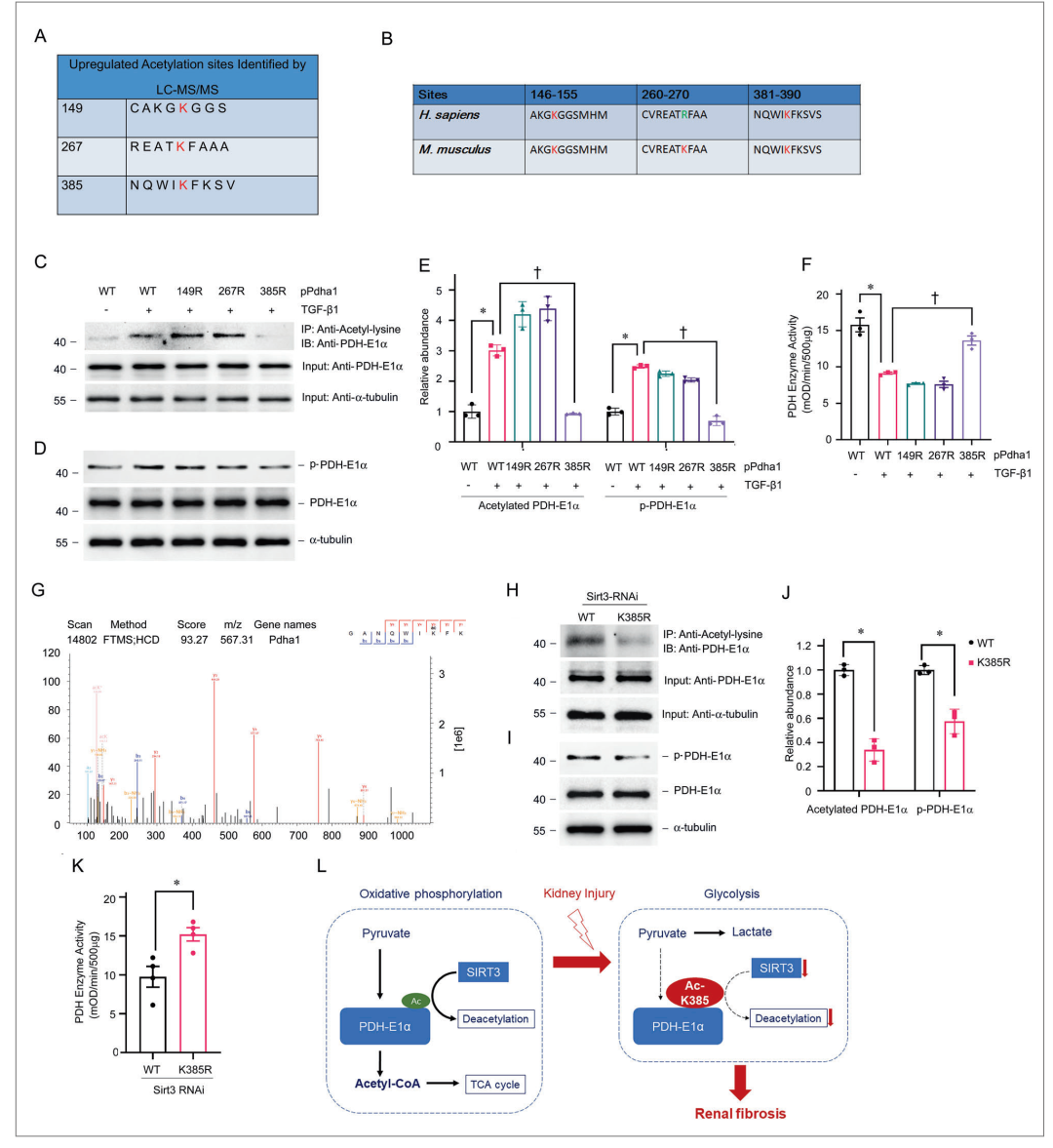
图8 TECs中SIRT3靶点PDHE1 α乙酰化位点的发现
△点击放大图片
基于质谱的蛋白质组分析确定了PDHE1α中的三个潜在乙酰化位点(图8A)。PDHE1α的K149和K385从小鼠到人类是保守的(图8B)。本文构建了PDHE1 α在K149 149R )、K267 ( 267R )和K385 ( 385R )处的乙酰化缺失K - R突变体。
抗Ac K抗体Western blotting结果显示,TGF-β1 (图8C , E)孵育的TECs中,K385是PDHE1 α的主要乙酰化位点。在TGF - β 1 (图8D , F)刺激的K385R突变的TECs中,PDH和PDHE1 α磷酸化活性保持不变。用Sirt3 siRNA转染TECs中PDHE1 α的野生型( WT )和385R突变型质粒。K385突变减弱了Sirt3敲低(图8H , J)引起的PDHE1 α的乙酰化。K385突变(图8I - K)的TECs中PDH活性较高,PDHE1 α磷酸化水平较低。这些结果表明,SIRT3调控的PDHE1 α第385位赖氨酸乙酰化是促纤维化刺激下TECs中PDH发挥功能的关键元件(图8L )。
文章部分相关产品:
| 货号 | 产品 |
| 7754-BH-005 | Recombinant Human TGF-beta 1 (Human Cell-expressed) Protein |
| 2627S | SirT3 (C73E3) Rabbit mAb |
| 9441S | Acetylated-Lysine Antibody |
| 73504 | RNeasy FFPE Kit |
| 101000046 | jetPRIME |
| 5490S | SirT3 (D22A3) Rabbit mAb |
| 9441S | Acetylated-Lysine Antibody |
| 610181 | Purified Mouse Anti-E-Cadherin(36/E-Cadherin) |
| 3010S | Na,K-ATPase Antibody |
| 11998T | SDHA (D6J9M) XP® Rabbit mAb |
| sc-2003 | Protein A/G PLUS-Agarose |
| sc-377092 | PDH-E1α |
| 9814S | Acetylated-Lysine (Ac-K2-100) MultiMab™ Rabbit mAb mix |
| 55R-1450-100assays | Lactate Assay Kit |
| abs580122-96T | ATP Synthase Microplate Assay Kit |
| 9441S | Acetylated-Lysine Antibody |
| sc-365175 | SIRT3 (F-10) |