细胞自噬(autophagy)是一种“自食”的胞内机制,是细胞在自噬相关基因的调控下利用溶酶体降解自身受损的细胞器和大分子物质,以实现细胞本身的代谢需要和某些细胞器更新的过程。自噬性细胞死亡又称之为Ⅱ型程序性细胞死亡,细胞凋亡被称为1型程序性细胞死亡。它们的主要区别:细胞凋亡依靠的是胱冬肽酶等多种水解酶,而自噬纯粹是在溶酶体的作用下发生的,而不依赖于某些酶。
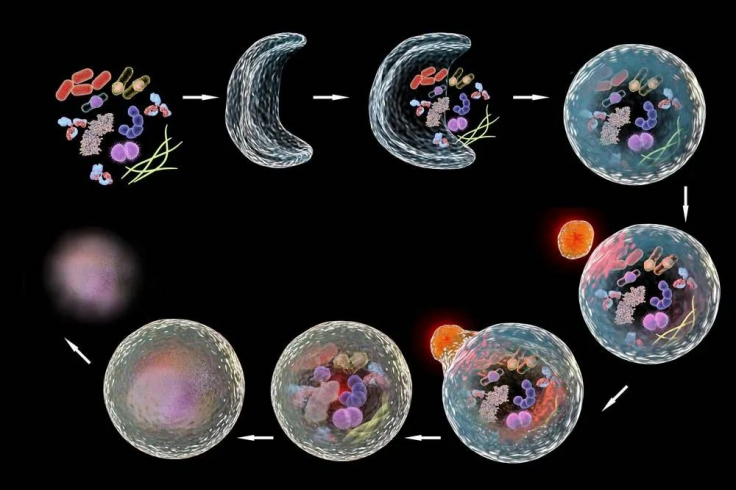
△点击放大图片
机体的生理和病理过程中都存在自噬现象,在生理条件下,细胞的基础自噬活性能清除细胞内老化、受损的生物大分子和细胞器等,以维持正常的细胞生物学功能;在饥饿、缺氧等代谢应激状态下,细胞通过自噬降解老化、受损的生物大分子和细胞器等,能获得能量来源和重建所需物质,以维持细胞的基本生命活动。因此,自噬作为细胞重要机制,不仅帮助维持生物体稳态,与个体成长、发育、分化、衰老密切相关,其功能的紊乱还参与肿瘤、自身免疫疾病、神经系统疾病、心脑血管病、代谢糖尿病等多种疾病的发生和发展。
说起自噬研究领域,那真是一个耀眼的明星,最近一个世纪里已经有两位科学家因此获得诺贝尔生理医学奖。1963年比利时科学家Christian de Duve首次在溶酶体国际会议上提出了“自噬”的概念,并于1974年Duve因发现溶酶体获得了诺贝尔生理或医学奖。但之后的几十年里,自噬一直还是个小众研究领域,直到2016 年日本细胞生物学家大隅良典因其在阐明细胞自噬的分子机制和生理功能上的开拓性研究荣获诺贝尔生理或医学奖。至此,自噬领域研究逐渐成为了科研界一颗耀眼的明星。
根据物质的性质和将物质运送至溶酶体的方法,可分为不同形式的自噬。目前,哺乳动物细胞自噬主要可分为巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)。其中,巨自噬及CMA的分子机制和生物学功能已被广泛研究,小编之前也整理过相关领域的研究,同学们可以回顾下面这三篇文章,但微自噬的研究却相对缺乏。
(1)自噬与神经退行性疾病的关系一文带你吃透,不点进来看看?
2022年9月12日,湖南大学生命医学交叉研究院王立明教授(第一作者)、美国密歇根大学Daniel J. Klionsky教授和澳门大学的沈汉明教授联合在Nature Reviews Molecular Cell Biology杂志上发表题为:The emerging mechanisms and functions of microautophagy的综述文章。点击这里,查看原文

(DOI:10.1038/s41580-022-00529-z,IF: 113.915)
△点击放大图片

该综述全面深入地概括了近年来有关微自噬的研究进展,重点介绍了多种形式的选择性微自噬(selective microautophagy),还详细讨论了微自噬的分子调控机制,微自噬与巨自噬的区别与联系,以及微自噬与人类重大疾病(例如癌症和神经退行性疾病)发生和进展的关系。
巨自噬。巨自噬的典型特征是形成一个独特的双膜细胞器,即自噬小体。在巨自噬过程中,自噬物质被一种名为“吞噬体”的隔离膜所包围。然后,吞噬体通过招募来自不同来源的膜来进行扩张,并弯曲成球形,形成具有双膜的自噬小体。最后,自噬体与晚期核内体(形成双体)及溶酶体融合,完成自噬溶酶体的形成,在自噬溶酶体中隔离的物质被消化和降解(图1a)。
巨自噬可以以环境依赖的方式靶向特定的物质。线粒体自噬、内质网(ER)自噬、溶酶体自噬、蛋白质聚集自噬、核糖体自噬和异种自噬(微生物)等等都属于巨自噬形式。
伴侣蛋白介导的自噬。在伴侣介导的自噬过程中,具有KFERQ样基序的胞质蛋白被伴侣蛋白HSPA8识别,并通过溶酶体相关膜蛋白2A(LAMP2A)和溶酶体HSPA8传递到溶酶体进行降解(图1b)。
微自噬。微自噬是真核细胞直接降解各种自噬物质的过程。在微自噬过程中,自噬物质通过膜突出和内陷直接被溶酶体和晚期核内体吸收,自噬物质在内溶酶体腔内降解(图1c)。大多数对微自噬的研究都集中在与溶酶体、液泡或核内体相关的变化上。因此,根据溶酶体的形态学变化,科学家提出了三种不同类型的微自噬:1型,溶酶体或空泡突出;2型,溶酶体或空泡内陷;3型,内吞体内陷。每种类型的潜在机制和生物学功能仍不明确。
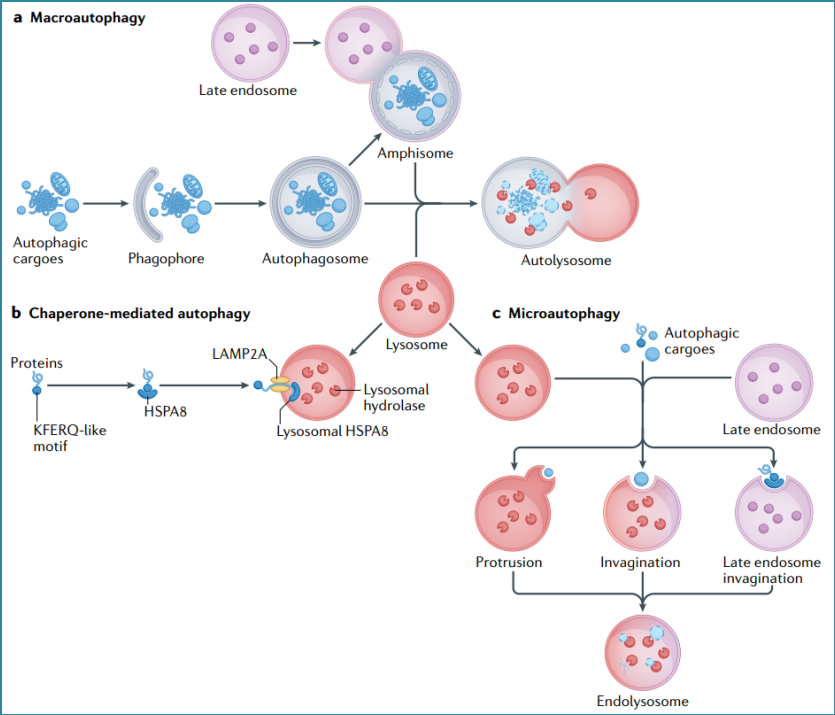
图1 巨自噬,分子伴侣介导自噬(CMA)和微自噬
△点击放大图片
巨自噬,是科学家研究最早,最透彻的,所以我们通常所说的自噬一般就是巨自噬。

对于巨自噬来说,根据物质的摄取和降解方式不同,分为非选择性和选择性自噬。同样,微自噬也分为非选择性微自噬(non-selective microautophagy)和选择性微自噬(selective microautophagy)。主要区别在于被降解底物是否有特异性。
❖非选择性自噬:以非选择性的方式发生,这包括随机摄取细胞质物质进行降解(例如,在饥饿状态下)。
❖选择性自噬:自噬体通过自噬的选择性降解特定的细胞成分。
非选择性微自噬是小鼠和大鼠肝脏在饥饿和再喂养条件下的主要自噬反应。具有酸性管腔pH值的溶酶体能够通过溶酶体膜的内陷,吸收不同类型的物质(甲基血红蛋白、卵清蛋白、溶菌酶、铁蛋白和Percoll颗粒),导致溶酶体内囊泡的形成。但其确切的分子机制和生物学功能仍有待完全阐明。
然而,近年来,人们对于选择性微自噬的研究取得了一定的进展,已经报道了一系列选择性微自噬类型(图2),包括微线粒体自噬(micromitophagy)、微内质网自噬(microreticulophagy)、微细胞核自噬(micronucleophagy)、微溶酶体自噬(microlysophagy)、微脂质体自噬(microlipophagy)、内吞体微自噬(endosomal microautophagy,eMI)以及微蛋白质自噬(microproteophagy),每一种都具有不同的功能,并受到不同的分子机制的调控。

图2 哺乳动物的选择性微自噬途径
△点击放大图片
a |微线粒体自噬。独立于自噬小体的线粒体内溶酶体降解是在稳态条件下或氧化应激反应下通过线粒体来源的囊泡(MDVs)的形成发生的。微线粒体自噬的另一种机制涉及形成一个精子发生相关蛋白18(SPATA18;也称为MIEAP)诱导的液泡(MIV),吞噬整个受损的线粒体,这一过程可以降低活性氧(ROS)的水平。b |微内质网自噬。独立于自噬体生物发生的内质网内溶酶体降解主要通过三个过程执行:(1)内质网出口位点(ERES)微自噬是降解成骨细胞前胶原,可能依赖于LC3、隔离体1(SQSTM1)和泛素(Ub);(2)通过形成溶酶体相关的囊泡,以及与可溶性SNAREs介导的内溶酶体融合;(3)急性内质网应激后恢复阶段的碎片状微网吞噬,这需要LC3、SEC62和ESCRTs机制。c|微细胞核自噬和RN/dn自噬。无自噬小体的核成分的内溶酶体降解。微核自噬可能是由环状GMP-AMP合酶(cGAS)介导的,cGAS被招募到微核中,并与LC3结合,促进微核被内溶酶体吞噬。RN/DN自噬是由两个溶酶体受体介导的,溶酶体相关膜蛋白2C(LAMP2C)和SID1跨膜家族成员2(SIDT2),用于将RNA/DNA直接摄取到溶酶体中。d|微溶酶体自噬。溶酶体损伤后,溶酶体膜蛋白可以通过溶酶体内腔内囊泡的形成以LC3依赖的方式降解,也可以通过类似环指蛋白152(RNF152)的泛素E3连接酶(E3)s介导的LC3独立但泛素化依赖的方式降解。e | 微脂质体自噬。在饥饿时,大的脂滴受到脂肪甘油三酯脂肪酶PNPLA2介导的脂解,以减少其大小。然后,较小的脂滴和溶酶体形成稳定的接触(膜接触位点(MCSs)),通过这些接触,脂质含量直接转移到这些溶酶体中进行降解。f|内吞体微自噬(eMI)。eMI通过热休克蛋白HSPA8和ESCRTs的作用降解核内体或多泡体(MVBs)中含有KFERQ样基序的蛋白。g | 微蛋白质自噬。通过内溶酶体对单个蛋白的以一种不明确的方式直接降解,这与CMA和eMI不同,可能是通过泛素化或ATG8酰化介导的。
下面我们重点介绍下线粒体微自噬、内吞体微自噬(eMI)和微蛋白质自噬。
1、线粒体微自噬
线粒体作为细胞的发电厂,几乎为所有的细胞活动提供能量。因此,线粒体质量控制对于维持细胞的正常生理机能至关重要。线粒体降解就是线粒体质量控制的一个重要机制,它是通过以下途径实现的:
❖线粒体蛋白酶
❖泛素化和蛋白酶体降解
❖巨线粒体自噬(或线粒体自噬)
❖微线粒体自噬
其中,巨线粒体自噬的相关研究最多。相比之下,人们对微线粒体自噬的了解比较少,它是指不依赖于自噬小体而直接通过溶酶体降解线粒体的过程,即线粒体来源的囊泡(MDVs)形成和MDVs内化到溶酶体腔内进行降解过程。具体来讲,有两种类型的MDVs:线粒体外膜复合体20亚基易位酶(TOMM20)阳性MDVs(图3a)和丙酮酸脱氢酶(PDH)阳性MDVs(图3b),它们是通过不同的机制形成的。
除了MDVs,线粒体也能够吸收溶酶体样细胞器,这种现象被称为“MIEAP诱导溶酶体在线粒体样细胞器的积累”(MALM);MIEAP也称为生精相关蛋白18(SPATA18)(图3c)。此外,MIEAP/spata18诱导的液泡(MIVs)直接吞噬受损线粒体和降解,也符合微自噬的标准(图3d)。当线粒体严重受损或MALM被抑制,导致高活性氧(ROS)水平时,就会产生MIV 。因此,MALM和MIV被认为是一种新的线粒体降解机制的重要因素。
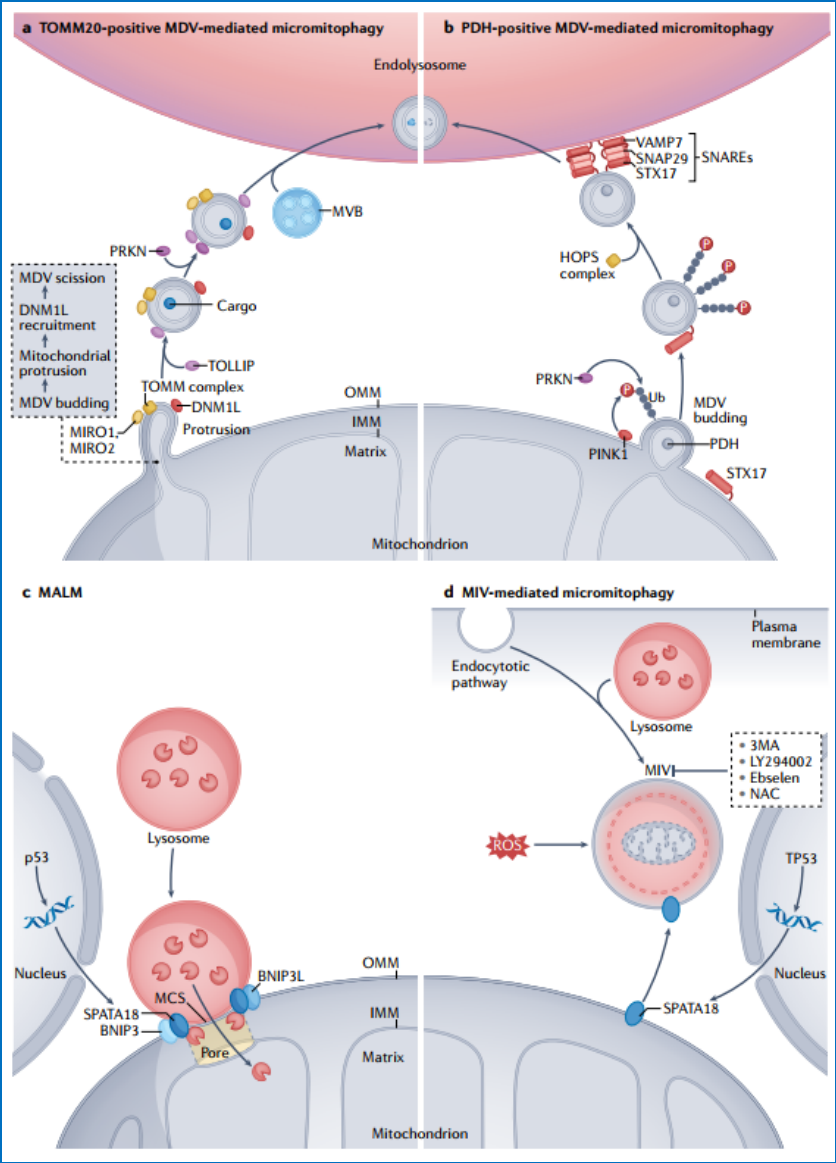
图3哺乳动物微线粒体吞噬的分子机制
△点击放大图片
2、内吞体微自噬(eMI)和微蛋白质自噬
蛋白质稳态(proteostasis)失衡是衰老和疾病的九大特征之一,其可以被泛素-蛋白酶体系统和自噬(包括巨自噬、CMA以及微自噬)调控。其中,巨自噬主要降解细胞内大的不溶性蛋白聚集体,而CMA和内吞体微自噬(eMI)以及微蛋白质自噬(microproteophagy)等微自噬可以降解细胞内单个蛋白质。
CMA是一种降解单个蛋白质的选择性自噬,其通过分子伴侣热休克蛋白HSPA8特异性识别带KFERQ样序列蛋白质形成复合体,与溶酶体膜蛋白LAMP2A结合,完成蛋白质的去折叠和溶酶体转运、降解(图4a)。
eMI,与CMA类似,也可以特异性识别带KFERQ样序列的蛋白质,通过和晚期内吞体或多泡体膜上的丝氨酸磷脂(phosphatidylserine)结合,在ESCRTs帮助下进入晚期内吞体或MVBs降解。eMI因其潜在的分子机制和潜在的生物学功能而备受关注。首先,eMI的诱导是刺激特异性的,比如哺乳动物中铁饥饿、黑腹果蝇中蔗糖饥饿、DNA损伤和氧化应激激活,但不能被内质网应激激活。第二,MVBs的形成是eMI的一个重要步骤,是内吞和自噬途径交叉路口的节点,这一过程需要ESCRT蛋白的参与。第三,CMA和eMI都需要HSPA8作为伴侣(图4b)。但eMI不需要底物蛋白质的去折叠,并且可以存在于更广泛的物种中,这与CMA有明显差异。翻译后修饰可以决定这些底物蛋白质是被转由到eMI还是CMA。eMI和CMA之间的确切关系有待进一步研究。
微蛋白质吞噬是指内吞溶酶体或液泡以不明确的方式降解单个特定蛋白质。与CMA和eMI不同的是,微蛋白吞噬的底物不包含特定的基序,如KFERQ。但泛素化(ubiquitination)、ATG8ylation(一种新的蛋白翻译后修饰)或其他翻译后修饰在介导微蛋白质吞噬发生过程中起到了重要作用。(图4c)。ULK2可以被非典型蛋白激酶Cλ/ι亚型(PRKCI)磷酸化,该亚型促进其Lys63泛素化和被内吞溶酶体降解,从而抑制巨自噬。聚集吞噬受体toll相互作用蛋白(TOLLIP)被认为是一种微蛋白吞噬受体,先天免疫信号转导适配器MYD88是toll样受体(TLR)和白细胞介素-1(IL-1)受体家族成员下游的免疫信号通路中的关键调节因子。MYD88很可能是通过微蛋白自噬降解。
然而,目前尚不清楚质膜上的MYD88是如何被传递到溶酶体进行降解的。WNT通过微蛋白质吞噬调节GSK3的降解依赖于蛋氨酸的丰度,说明微自噬和单碳代谢之间有直接联系,也支持了癌细胞增殖和生存的关键过程。所以靶向微蛋白吞噬用于癌症治疗的有非常重要的意义。
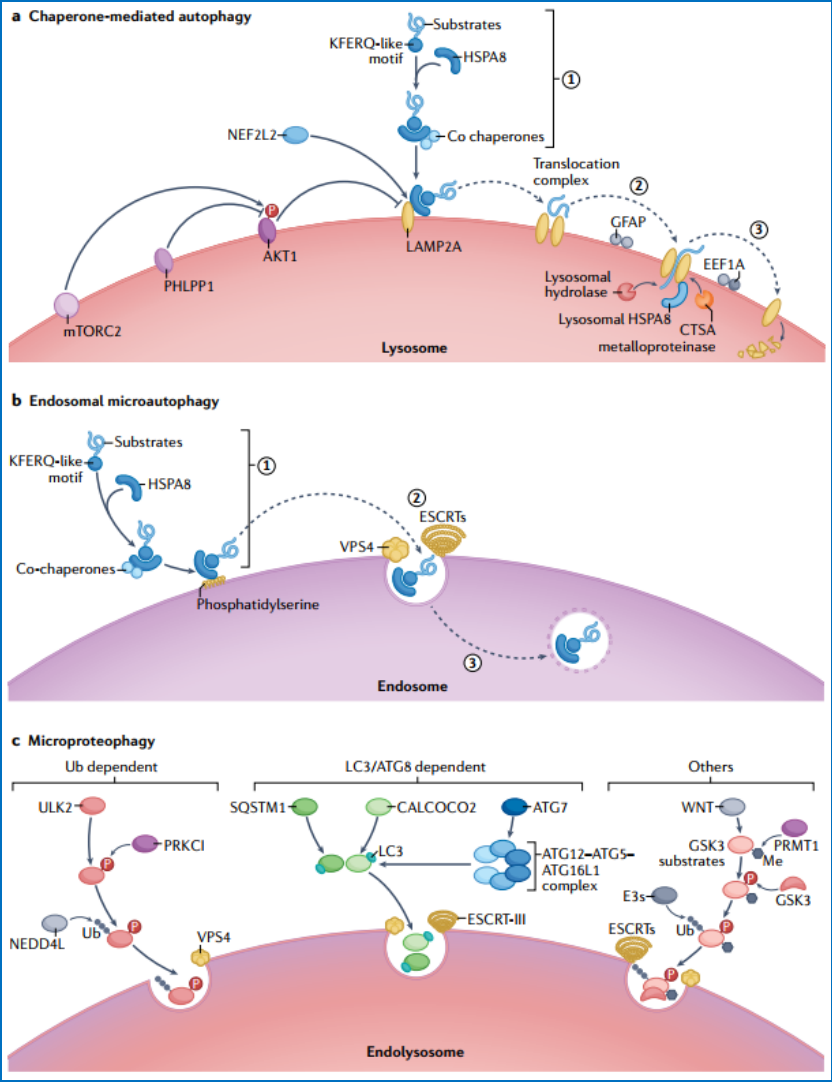
图4哺乳动物通过CMA和微自噬降解单个蛋白质
△点击放大图片

在哺乳动物细胞中,微自噬的确切调控机制在很大程度上仍然难以捉摸。与巨自噬和CMA相比,建立明确的模型来解剖微自噬要困难得多。目前,对微自噬的分子调控机制的研究主要集中于底物识别(cargo recognition)以及底物吞噬和降解(cargo engulfment and degradation)两个过程。
1、底物识别
泛素化是泛素-蛋白酶体系统和巨自噬系统中底物识别的先决条件,可以作为几种微自噬亚型的上游信号。最近的研究报道,微自噬下调液泡膜蛋白是由泛素化启动的,而泛素化是由TORC1活性控制的。另外,ATG8酰化(atg8家族蛋白,包括最常用的自噬标记物LC3,可以偶联到损伤或应激的膜和蛋白质上,这一过程简称为“ATG8酰化”)有助于蛋白质亚基和细胞器传递到内溶酶体,在微自噬的底物选择性和识别中也发挥着重要作用。
2、底物吞噬和降解
对于微自噬来说,内溶酶体膜内陷,通过目前尚不了解的分子机制来捕获靶向货物。SNARE复合体、 ESCRTs复合体以及膜接触位点(membrane contact sites)和mTOR、TFEB参与了底物的吞噬和降解过程。SNARE复合体参与微线粒体自噬、微内质网自噬和MVB与内溶酶体的融合。ESCRTs复合体对于内溶酶体内陷和腔内囊泡的生成至关重要。溶酶体和其他细胞器之间的密切接触能够提供空间重合,促进微自噬的过程。吞噬后,被隔离的物质被内溶酶体水解酶降解,这一过程依赖于V-ATP酶调控的酸化和核转录因子EB(TFEB)介导的溶酶体生物发生,TFEB主要通过直接磷酸化使mTORC1失活。然而,mTORC1和TFEB在哺乳动物细胞微自噬调控中的作用尚不明确。

微自噬具有多种生物学功能,包括蛋白质质量控制、细胞器重塑、神经元中的突触传递和胚胎发生等等。微自噬的功能障碍与多种人类疾病的发病机制有关。接下来,我们将强调重点介绍微自噬与两种与衰老相关的疾病的相关性,即神经退行性疾病和癌症。
1、神经退行性疾病
功能失调的微自噬与各种神经退行性疾病有关,如阿尔茨海默病、帕金森病和肌萎缩性脊髓侧索硬化症、亨廷顿病。超过50%的含有KFERQ样基序的突触蛋白是eMI和CMA109的潜在底物,各种神经退行性疾病相关蛋白也包含一个KFERQ样图案,如α-共聚核蛋白、MAPT,淀粉样-β前体蛋白(APP)和焦油dna结合蛋白(TDP43),这表明微自噬在轴突稳态中发挥着重要作用。在不同的神经退行性疾病中已经报道了微自噬相关基因的各种突变。
例如,ESCRT-III的亚基突变,会导致肌萎缩性脊髓侧索硬化症、额颞叶痴呆的发病以及小脑发育不全。编码ESCRT-III分解的关键酶VPS4的突变会导致多种神经发育异常的系统疾病,包括小脑发育不全和白内障、智力残疾、先天性小头畸形、肌张力障碍和细胞发育障碍贫血以及生长迟缓。VPS4的一种显性阴性形式的过表达会导致淀粉样蛋白-β的积累和MAPT的磷酸化,这是阿尔茨海默病的两个早期特征。这表明,微自噬缺陷可能是阿尔茨海默病的一个危险因素。
2、癌症
巨自噬在癌症发生发展中的作用是一把双刃剑,同时微自噬与癌症之间也密切相关。RN/dn自噬受体SIDT2是肿瘤抑制因子p53的转录靶点,SIDT2似乎具有致癌活性:敲除SIDT2使小鼠对肺腺癌和肠癌更有抵抗力。WNT信号通路具有重要的致癌功能,最近的研究表明,WNT信号通路的激活依赖于微自噬。线粒体稳态的改变,如线粒体降解受损,与肿瘤的发生有关。此外,癌细胞可以利用MDV介导的微粒体吞噬来适应和生存,这表明共同靶向巨粒体吞噬和微粒体吞噬可能是一种有效的癌症治疗新策略。

过去四十年来,自噬研究领域的迅速发展,重新燃起人们对微自噬的研究兴趣。然而,相对于巨自噬和CMA的研究,微自噬的研究仍处于起步阶段。问题和挑战比答案和解决方案要多得多。
第一,从技术上讲,目前还没有标准的实验方法,也没有适合的体外细胞和体内动物模型来研究微自噬。实际上,最具有挑战性的是如何排除自噬体参与观察到的溶酶体依赖性的降解,因为在缺乏关键的ATG蛋白如ATG5和ATG7的情况下,自噬体的生物发生仍可能会发生。
第二,不同类型的选择性微自噬的受体(receptors)尚未确定,也不清楚这些受体行使其功能时是否依赖泛素,是否会随底物一起被降解,微自噬和巨自噬是否利用相同或不同的受体来实现特定细胞器的周转。
第三,微自噬的底物运输到内吞溶酶体的分子机制还远未明确。例如,ATG8酰化在微自噬过程中的确切作用仍有待进一步阐明和确认。
第四,巨自噬和微自噬之间的关系仍不是很明确。他们之间有什么关联吗?为什么这两种自噬形式在进化上是保守的,为什么它们在同一细胞中起作用?哪一种对降解细胞成分更有效?
最后,在特定的疾病模型中,如癌症和神经疾病模型,如何特异性靶向微自噬调节?
有这么多亟待解决的挑战,我们还需要展开更多的研究以便于更深入地了解微自噬分子机制、生物学功能和其在健康和疾病中的作用。这些知识点将为研究自噬和溶酶体生物学打开新的窗口,更重要的是,将为开发治疗微自噬相关疾病的策略提供新的机会。