- 1、流式实验中死活染料的重要性&不能及时上机的样本保存方法
- 2、老板让我用流式的方法检测TH1/2/17,我却一头雾水?
- 3、在做免疫细胞分型时,CD45可有可无吗?
- 4、流式样本保存知几何
- 5、到底是磁珠分选还是流式分选?
1、流式实验中死活染料的重要性&不能及时上机的样本保存方法(点击返回目录)
Q1:为什么做肿瘤或组织样本免疫亚群分析要标记cd45和死活染料,直接只检测对应的细胞marker不行吗?
A1:确实不行,借一位老师的数据现身说法,在未染死活和cd45时获取的cd11b+f4/80+的巨噬细胞群会夹杂带自发荧光的非免疫细胞从而导致cd206异常升高,从这个结果来看造成的偏差是巨大的,所以,有条件一定要染。

△点击放大图片
Q2:样本染色后不能及时上机怎么办?如何保存最稳定?
A2:如果不能及时检测能够固定么:可以。
如果不能及时上机检测,可将已经染色的细胞在1-4%的多聚甲醛(或BD Cytofix Buffer,货号:554655)中4℃固定30min,清洗细胞,之后用适量的Stain Buffer重悬细胞,4℃避光保存。固定的细胞需要尽快上机检测一般不应超过72h。
需要避免的两个误区:
1、并不是一直将样本处于多聚甲醛中!长时间的浸润会使荧光抗体中的荧光素淬灭,一定是固定15-30min后洗掉重悬于staining buffer中。
2、前面已经做过类似固定步骤(例如固定破膜)的细胞如果能确保24h内上机,实际上无需再次固定。如不能,推荐再次固定以稳定胞内抗体的结合。
2、老板让我用流式的方法检测TH1/2/17,我却一头雾水?(点击返回目录)
小A:罗工你好,我接了一个课题,检测小鼠脾脏Th亚群的变化,一查文献就懵了,为啥脾脏的Th亚群检测的biomarker,有IFN,IL-4这些炎症因子呢?不是说一般鉴定细胞亚群都一些CD3,CD4开头的表面Marker吗?
罗工:别急,我来告诉你,之所以检测这些炎症因子,是由Th1,Th2,Th17这些Th细胞亚群的特殊性导致的。我们知道Th细胞包含了很多功能性亚群,但是截至目前,这些亚群本身的表面biomarker知之甚少,有些文章中提出一些趋化因子受体CXCR3,CCR4,CCR6是其表面marker,然而这些文章绝大部分都是human的样本。
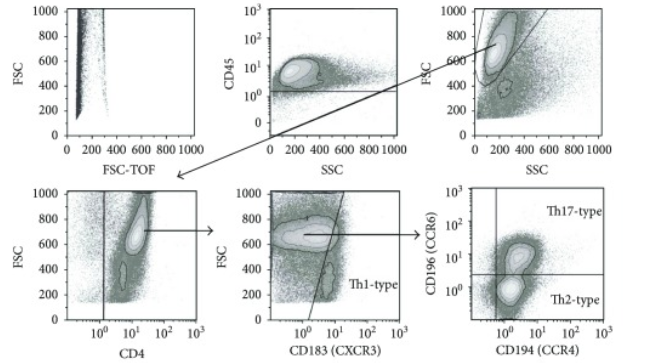
△点击放大图片
对于小鼠样本,我们只能退而求其次,从其细胞能特异性分泌某种炎症因子的特点上,来反推这类细胞是什么。比如能分泌IFN-g的细胞我们一般认为其是Th1型细胞,能分泌IL-4的我们认为是Th2型细胞。因此这些炎症因子正是用来作为鉴定区分Th亚群的关键指标,当然有时候我们也会选择更深层的核转录因子,比如Treg的常见指标就是Foxp3这个核转录因子:
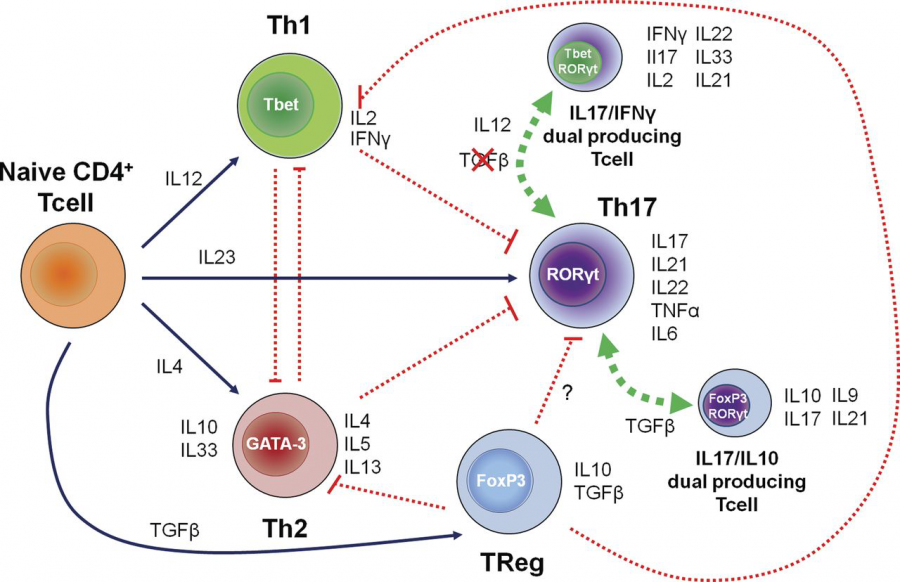
△点击放大图片
小A:哦!我大概明白了,那我就直接检测这些指标就行了?这些炎症和转录因子的流式检测和我之前做的CD3,CD4,CD8的染色有啥不一样的地方吗?
罗工:炎症和转录因子的检测和表面染色很不一样。
小A:啊?不会吧,我就会染些简单的,咋办?
罗工:别急,我来告诉你这些指标怎么染色,保证一看就懂:
首先,不论炎症还是胞内因子都是无法像CD3那样直接加抗体染色的,因为我们常用的荧光流式抗体不具备自主穿透细胞膜的功能,直接加进去只会被细胞膜挡在门外,想要染上他们,需要我们手动给细胞建立抗体进入其内部的通道,即固定/破膜步骤。固定可以让细胞内部的蛋白结构稳定下来,破膜可以让细胞表面产生孔径,方便荧光抗体进入内部染色:
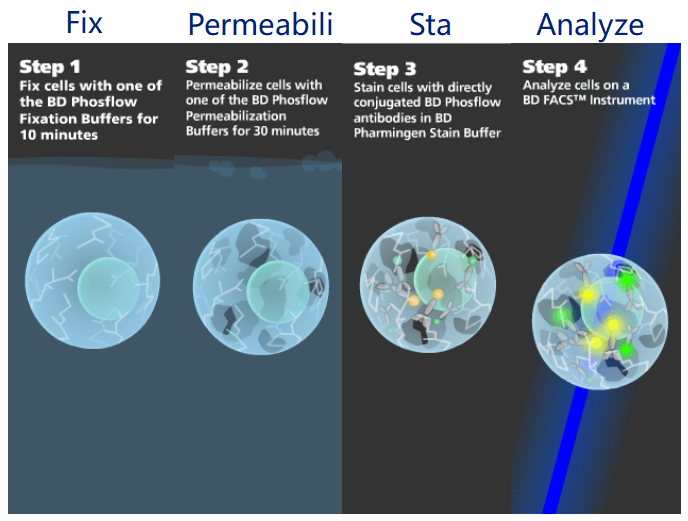
△点击放大图片
罗工:这个确实,炎症因子的流式实验会多出一个步骤,就是体外刺激。IFN,IIL-4这些分泌型细胞因子除了需要固定破膜以外,还需要对细胞前期进行激活和蛋白转运抑制的处理,这样才能保证有足够的细胞因子在胞内累积便于后期检出。
小A:体外刺激,怎么做啊?
罗工:最常见的T细胞刺激剂就是PMA+离子霉素了,这个刺激时间一般在6h左右,除了刺激以外,我们还要加入BFA或者莫能霉素来阻断富集这些因子,这样更有利于后续实验的阳性率。
小A:那这个时间太长了,做完肯定要熬夜了。。。
罗工:额,其实根据我的经验大可不必,我们可以考虑在下午或者晚间处理细胞,将细胞的激活和蛋白转运抑制的时间放在晚上,第二天过来直接收细胞,这样的时间安排就会好很多了。
小A:也就是炎症因子的染色的步骤为提取样本后的刺激阻断—表面染色—固定破膜—胞内染色,如果核转录因子就是提取样本后表面染色—固定破核膜—核内染色。这样思路就清晰多了!
罗工:是的,完整的流程就是这样!
3、在做免疫细胞分型时,CD45可有可无吗?(点击返回目录)
小R:罗工你好,前几天您帮我设计了一个肿瘤免疫亚群的(T细胞,B细胞,NK细胞,巨噬细胞,树突细胞,MDSC和几个免疫检查点)流式实验方案,但是我把我的方案拿去和我师姐讨论,她说没必要加一个CD45的指标,说免疫细胞都会表达呢,我可以删掉这个指标么?
罗工:先说结论:如果您做的实验是外周/脾脏/淋巴结的免疫亚群鉴定,样本处理比较理想的情况下CD45确实可有可无,但是如果您的样本不理想,或者实验对象是肝,脑,肺等组织器官/肿瘤/腹水等样本里的免疫细胞,CD45是非常有必要检测的。
小R:罗工,您可以再详细说明一下吗?
罗工:如果是外周/脾脏/淋巴结的免疫亚群鉴定,我们在进行红细胞裂解或者梯度密度离心后所获得细胞都是纯度非常高的PBMC,我们可以在流式细胞仪上通过FSC和SSC这2个形态学通道明确的选出免疫细胞,此时CD45就不是那么重要了。
但是也必须要说的一点,实际上我们碰到的情况是千变万化的,比如一些病人的样本或者是一些处理不好的样本,我们很难从FSC和SSC通道上获得明确的PBMC形态,此时就应该检测CD45来严谨的gate出免疫亚群了。
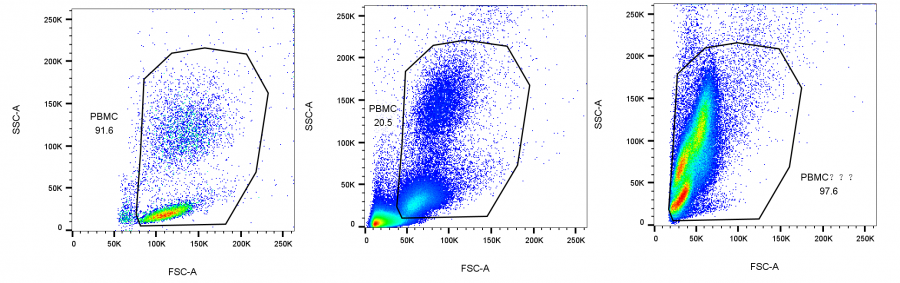
△点击放大图片
左图为分群清晰的外周血亚群,可以不染CD45;
中图为裂红不佳的外周血亚群,此时就推荐染CD45了;
右图为病人的外周血亚群,无法明确区分出免疫细胞形态,必须通过染CD45来判断。
小R:那我的样本是肿瘤组织里的免疫细胞,岂不是更难从FSC和SSC上获得免疫亚群?
罗工:没错,肿瘤等组织里的免疫细胞本身就很少,我们从肿瘤等组织中处理出来的单细胞悬液里大部分都是肿瘤/组织细胞,只有少部分才是CD45+的免疫细胞,并且非常要命的一点,组织细胞往往还会带有大量的非特异性,如果不染CD45的话会导致实验结果大量假阳性而无法分析。
小R:原来如此,GET到了,谢谢罗工!
4、流式样本保存知几何(点击返回目录)
当我们在准备开展一个流式实验时,有没有想到流式样本的保存有时反而会大大影响到最终的实验结果呢?今天罗工就流式样本的保存来给大家聊聊这方面的经验和分享。
首先,我们最常见的流式样本就是各种外周血了,最早的流式应用也是检测人外周血中的CD4等一系列的水平,从而发展为今天各类各样的流式实验的。针对人的外周血,临床上一般会使用多种多样的各类采血管进行收集,而能用于流式实验的,往往是2类抗凝采血管:EDTA抗凝管和肝素钠抗凝管。
EDTA抗凝管
△点击放大图片

肝素抗凝管
△点击放大图片
对于一般的流式实验,我们使用edta抗凝管即可,edta抗凝管保存的血样我们放置于常温或者4度都可以有效保存细胞长达24甚至是72h之久;但是,对于一些特殊的流式实验,例如,我要检测AnnexinV的凋亡,或者检测IFN,IL-4.IL-17等分泌型细胞因子,此时就应该选择肝素钠抗凝的采血管。因为上述这些实验内容都会因为EDTA的存在使实验结果受到比较大的影响。
其次,当我们的样本是各类组织,或者肿瘤样本时,我们在取出样本到处理为单细胞悬液的这段时间里,样本如果保存不当也会影响后续的细胞活性和表型,此时我们的样本应该优先浸泡在培养基或者组织保存液中等待处理,而不是简单的放在pbs或者生理盐水中,且浸泡一定要保证浸泡全部组织。
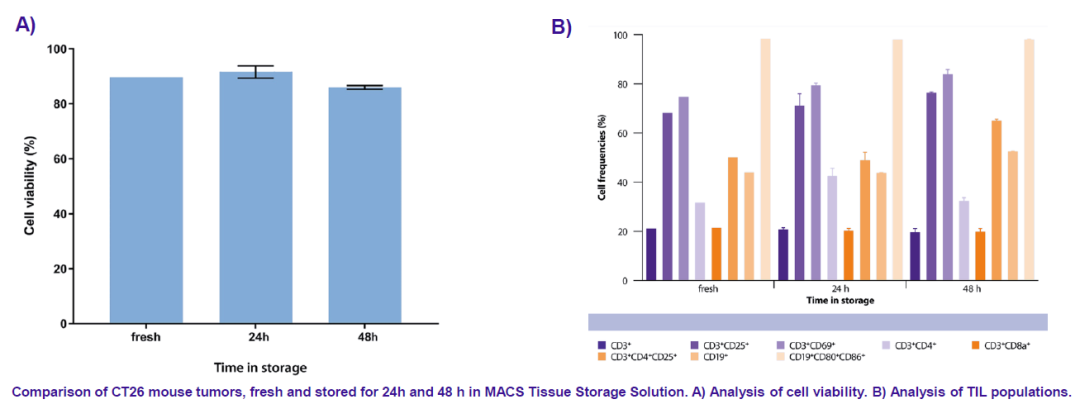
△点击放大图片
相比PBS和生理盐水,商品化的组织保存液(美天旎公司)会更加有效的保证后续流式分析时的细胞活力和亚群细胞比例稳定。
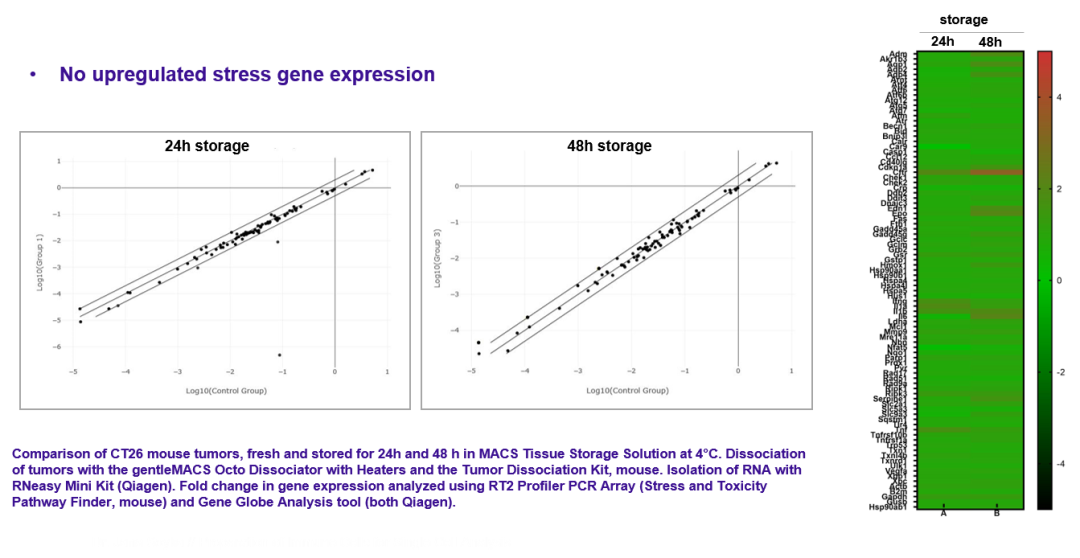
△点击放大图片
对细胞应激相关的蛋白转录谱进行研究,使用组织保存液保存的样本不引起细胞应激相关通路的改变,提示组织内细胞状态得到很好的维持。 最后,当我们把流式样本处理好并进行流式抗体标记后,这些样本也应该尽快的进行上机检测分析,否则时间一长也会影响到我们的实验结果。如果我们不能马上分析我们处理染色好的单细胞样本,应该如何操作呢?
如果我们不能及时的上机检测,可以将已经染色好的细胞在1-4%的多聚甲醛(或者BD的cytofix buffer)中4度固定20-30分钟,然后加入1ml的pbs/staining buffer离心清洗细胞,最后保存于PBS/staining buffer中4度避光即可。此时的样本经过固定可以至少保证72h内的上机效果,甚至曾经有老师1周后上机效果仍然可以。
但是在这里有2个误区大家一定要清楚:
1. 样本固定后不能一直泡在多聚甲醛固定液里,一直浸泡会导致大量的荧光抗体的荧光淬灭,例如FITC,BV510等都对多聚甲醛非常敏感,一定要固定后及时洗脱。
2. 如果您的流式实验本身就有固定/破膜的实验步骤并且能确保24h-48h内上机的,根据我们的经验无需进行再次固定这个步骤,当然如果不能,最好是再固定一次,以稳定胞内抗体和样本蛋白的结合。
5、到底是磁珠分选还是流式分选?(点击返回目录)
最近碰到了很多老师想要做细胞的体外培养,她们无一不面对一个问题,我需要的目的细胞应该如何提取出来呢?
对某类特定细胞的提纯提取,我们常用的方法有两大类:
1. 利用细胞的一些物理/生理特性进行提纯;
2. 利用细胞的一些特定biomarker进行抗原/抗体结合的提纯。
前者主要是进行一些“粗提” 例如利用细胞密度不一致的原理,从外周血中提取淋巴+单核的混合细胞PBMC,或者是直接提取粒细胞;以及我们可以利用单核细胞的贴壁特性,从小鼠骨髓中提取pbmc,然后保留培养后贴壁的细胞即为单核细胞。
后者则是更加精确的提取,例如我们要分选小鼠的Th细胞,可以用CD4标记小鼠的细胞,然后通过流式分选或者磁珠分选把CD4+的细胞拉下来,这样就能得到更加纯度高的Th细胞了。
而在利用细胞特异性marker进行细胞分离的方法上,目前有2个大分支,分别就是上述提到的磁珠分选和流式分选。
磁珠分选是基于抗体对抗原的特异性识别,使用磁性微珠直接或者间接偶联在抗体上,从而与细胞相连,在高强度、梯度磁场中达到细胞磁性分离的一种实验方法:

△点击放大图片
而流式分选,也是对细胞进行抗体标记,通过流式细胞仪的分选功能,将特定细胞分选出来的一种实验方法:

△点击放大图片
很多老师都会存在一个疑问,到底是选用磁珠分选,还是流式分选完成自己的细胞分选实验呢?今天主要根据这个给大家进行解答。
首先,我们从实验目的和实验需求出发,如果我们分选下来的细胞后续需要进行培养实验,也就是要求有一定的细胞活性和增殖力,此时肯定是磁珠分选优于流式分选的。
磁珠分选的细胞活力会更好,并且因为磁珠分选的工具可以很好的放进无菌台中,所以也不用太担心细胞分选后的染菌问题。
而流式分选因为仪器环境的问题导致分选后很容易污染,且细胞的状态和活性都会很差(流式分选的原理是细胞过电),后续在培养就很难养好了,即便养起来对实验结果的干扰也是不可预估的。
那么 流式分选是不是就一无是处呢?
并不是,我们从待分离细胞本身出发,举例来说,之前有老师要分选造血干,lin(8-10个抗体) c-kit, sca-1 CD150 CD48CD135需要10-14个抗体同时染色,如果此时使用磁珠,恐怕是相当不靠谱的选择。
而选择流式分选,就能更加精准的得到目的细胞了。
另外针对一些及其微量的细胞,直接用磁珠分选出来的纯度其实是打折扣的,我曾经就碰到一例老师从充满粒细胞的腹水样本中分离CD4,结果不论怎么分得到的CD4纯度都达不到90%,这是因为初始的CD4被大量其他杂细胞干扰,从而降低了磁珠分选的纯度。
而此时如果使用流式分选,则就不会有这种困扰了。
所以究竟是选择磁珠分选还是流式分选得到您的目的细胞,还是要综合细胞的marker是否足够磁珠分选,细胞在原始细胞群中的含量,细胞分离后的实验目的等多个方面进行判断,从而选择合适的方法进行最终的实验。