1、如何为稀有抗原挑选荧光素?StainIndex是什么(点击返回目录)
小Q:罗工您好,我有个流式问题想请教一下 。
情况是这样的:我要做Treg的流式分型检测,指标有CD4,CD25,CD127,
其中CD25我用的是FITC。上机结果发现,CD25分群很不好,我同时做了同型对照和单阳对照。您能帮我判断下原因吗?因为CD25比较重要,它的染色结果会直接导致Treg的分群结果。
罗工:Treg中使用的指标CD25,它是一个表达比较低的指标,在配色的时候通常需要遵循强弱搭配是原则,即:弱表达的抗原要选择亮的荧光素去标记。
如下是一张抗原密度表达高低的参考图,仅供参考。(样本来源:Human PBMC)。
从下图可以看到CD25是表达相对较低的抗原。

△点击放大图片
小Q:谢谢罗工,我大概了解问题出现在哪里了。我们这里的仪器是Calibur,是个两激光四通道的仪器,您建议搭配哪个荧光素呢?我这个panel中,PE和APC已经占用了。
罗工:荧光素的亮弱强度是根据染色指数(Stain Index,SI)来判断的,SI是指特定流式细胞仪器上荧光素相对强度,SI越大,荧光素越亮。
如下这个图片就是根据SI将各种荧光素强弱进行分类,可以参考。

△点击放大图片
因为Calibur只有四个通道,而PE好APC已经占用,所以我推荐您使用BB515。
BB515和FITC是在同一个通道,但是BB515是非常亮的荧光素,所以可以替代FITC染色CD25。

△点击放大图片
如下CD25-FITC和CD25-BB515的染色结果案例:用BB515有明显的分群效果的。
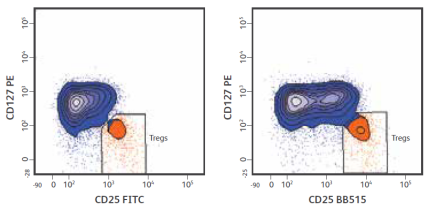
△点击放大图片
小Q:谢谢罗工,我再对方案进行重新调整。罗工,我还有另外一个问题。平时抗体用量都是按照之前师兄师姐的经验,没有一个很标准的用量,一般流式抗体的用量怎么推荐呢?您一般是如何推荐的?
罗工:抗体用量最准确的方法就是做一个抗体滴定。这个方法用来确定最佳的抗体用量和抗体浓度,以实现阳性信号尽可能强,而阴性信号尽可能低,得到一个最优的S/N(信噪比值),S/N最佳的浓度就是你要找的最好的抗体浓度。
小Q:罗工,这个抗体滴定怎么做呢?罗工:抗体滴定的操作很简单,流程可分为四步:
1、确定起始浓度,如无法确定,通用起点10ug/mL 抗体;
2、倍比稀释,连续稀释6-8个梯度;
3、计算S/N,阳性群体MFI/阴性群体MFI;
4、绘制曲线,S/N最高值对应的抗体浓度或者稀释倍数即为最佳抗体浓度。
比如看如下的图片,是CD4-FITC的抗体滴定结果,通过计算,可以看到,当抗体浓度在0.68ug/mL的时候,S/N是在最高点,所以最佳的抗体使用浓度即是0.68ug/mL。

△点击放大图片
所以你GET到了吗?
小Q:太谢谢罗工,今天又学到很多。马上要做起来。罗工,最后一个问题:在做抗体滴定的时候有有什么注意事项吗?
罗工:在做抗体滴定的时候需要注意以下几点:
1、抗体滴定的样本浓度与实际试验样本浓度保持一致(推荐106个细胞/mL);
2、抗体滴定背景干净,保证检测群体中有不表达该指标的阴性细胞;
3、抗体浓度很关键,染色体积增大,抗体量也应该增大;
4、滴定得到的浓度跟细胞数相关,细胞增加会影响染色效果,但是该数量范围很大,10-50倍波动均可行;
5、做抗体滴定时,在文章中写抗体浓度,不要写稀释比哈。
小Q:哇哦,了解,谢谢罗工!
各位小伙伴,除了今天推荐的BB515外,BD公司很多新荧光素跟之前的传统荧光相比确实好用,比如还有BB700。

△点击放大图片
2、到底什么是Lin?(点击返回目录)
经常有老师看文献时看到参考指标时会时不时的蹦出来一个lin-,然后查抗体时却发现怎么查怎么都查不到这个lin的抗体,究竟是怎么一回事呢?
这期罗工秘笈就来和大家聊聊这个熟悉而又陌生的指标:Lin。
那么到底什么是lin呢?
lin的全称又叫Lineage,或者Lineage cocktail,这个指标在流式上并不是指的某一个指标,而是指的某一类指标的集合体。
比如在做human DC细胞的鉴定时,Lin就是CD3/CD19/CD20/CD14等指标的集合指标,把这些抗体混合在一起,就叫做DC细胞的lin-指标。

△点击放大图片
Historical 4-color staining method: cluster resolution and phenotypic characteristics of mDC and pDC subsets. DC subsets were stained with lineage (lin) mAb cocktail (anti-CD3,−14,−19,−20) and with anti-CD11c and anti-CD123 (IL-3R α). mDC are lin- CD11c+ HLA-DR+ cells; pDC are lin-, CD123bright HLA-DR+.
Mario G. Solari, et al. Transplantation. ;85(11):1513-1522.
那么为什么要进行lin-的鉴定的?简单的来说,就是为了排除法。
还是以上面的DC细胞为例,human的DC细胞的表型为Lin-和HLA-DR+,如果我们单纯标记HLA-DR+,实际上有很多细胞,比如T,B等免疫细胞都会存在其阳性的细胞群,这时如果以HLA-DR+为DC亚群当然就不准了。
而我们除了HLA-DR+外此时又找不到一个合适的DC特异性标志物,于是只能退而求其次,把所有非DC细胞都排除掉,即选择CD3/CD19/CD20/CD14同时和HLA-DR进行标记,前者阴性后者阳性的即为DC细胞了。
而此时因为我们只需要上面这些其他细胞都为阴性,所以这些细胞的标记物我们可以都选择同一种荧光,从而形成的集合抗体混合物,就是我们所说的Lin-,也就是Lineage cocktail了。
所以总结一下Lin的特点:
当你的目的细胞缺乏特异性标记物时;
需要通过排除法排除其他细胞;
将需要排除的各类细胞marker进行荧光标记(可同一荧光标记,节约荧光通道),形成混合抗体,此时的混合抗体就是我们的Lin了。
当然,需要大家注意的一点就是,Lin的名字虽然是固定的,但是Lin的内容却千万不是一成不变的哦!一定不要随手查一个Lin就直接购买了,我们的Lin一定是要根据你自己的待测细胞不同而有着不同的指标集合的。
这里,我就总结一些比较常见的lin给大家分享:
1. Human DC细胞的Lin:CD3/CD19/CD20/CD14。
需要注意CD56这个指标,有的DC亚型据说会有CD56+,所以这里不纳入Lin的集合,仅供参考:

△点击放大图片
CD56 + DCs adopt certain characteristics attributed to pDCs.
(A) The expression of BDCA4 and ILT7 in different DC subpopulations from PBMC were analyzed by FACS. Data shown are one representative of 3 donors.
(B) CD123+CD56− (pDC), CD123+CD56+ (CD56+) and CD123−CD11C+ (mDC) were purified from PBMC, E2-2, Spi-B and TLR9 expression in those three DC populations were analyzed by RT-PCR.
Error bars represent standard derivation from duplicated PCR samples of same donor. Data shown are one representative of 3 donors.
(C) Purified DCs were stimulated with CpG B for 24 h, and the expression of TNFα were analyzed by ELISA. Data shown are summarized from 3 independent experiments.
(D) Lineage depleted PBMCs were stimulated with CpG B for 6 h, then stimulated cells were collected and stained with Lin, HLA-DR, CD123, CD11C and CD56 followed by intracellular staining of TNFα.
The Lin− HLA-DR+ cells were divided into CD123+CD56− (pDC), CD123+CD56+ (CD56+) and CD123− CD11C+ (mDC) subsets, TNFα expression in each DC subset were analyzed.
(E) Summarized data of (D) from 5 independent donors
Haisheng Yu, et al. Protein Cell. 2015 Apr;6(4):297-306.
2. 间充质干细胞的Lin:CD45, CD34, CD14 or CD11b, CD79a or CD19, and HLA-DR中至少选3-4个标记
参考如下:

△点击放大图片
The ISCT has proposed a minimal set of three standard criteria to be used as the uniform definition of multipotent MSCs:
1) adherence to plastic,
2) specific surface antigen expression, and 3) multipotent differentiation potential.
The phenotype of multipotent MSCs is defined to be, at a minimum, the cell surface co-expression of the antigens CD105, CD73, and CD90 (≥95% positive) and the absence of hematopoietic lineage markers CD45, CD34, CD14 or CD11b, CD79a or CD19, and HLA-DR (≤2% positive).
The ISCT has emphasized that the optimal flow cytometric assay uses multicolor analysis to demonstrate that individual cells co-express unique MSC markers and lack hematopoietic antigen expression.
3. 固有淋巴细胞(ILCs):
小鼠:
T cells (CD3+), B cells (CD45R+), monocytes (CD11b+), erythrocytes (TER-119+), and neutrophils (Gr-1+)
参考文献:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5070710/
也有一些文献选择更加细化的剔除各类细胞:CD3, CD5, CD19(B220), TCRβ, TCRγδ, Gr1, Ter119, CD8α and F4/80
参考文献:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6862482/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7025824/
人类:
CD15,CD14,CD3,CD19,CD56,CD11b
参考文献:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5948134/
同样值得一提的是,有些文献认为NK1.1或是CD56这类NK标记物在一些ILCs里也是存在表达的,所以介意的话也就不要选择为你的Lin的一员了哦。
好了,今天的罗工秘籍就到这里告一段落了,还有哪些你知道的要做lin的细胞呢?欢迎在评论区里留言哦~
3、流式对照设置之单阳管的用途(点击返回目录)
单阳管的设定标准是什么?罗工来告诉你
现在很多老师都知道光谱重叠会导致不同荧光通道间干扰,通过补偿调节可以将干扰信号减去,从而保证流式分析结果的正确。但是用来调补偿调节的单阳管很多同学不知道怎么设定 以及有哪些要求,这一期罗工将详细的给大家分享经验内容。
简单说,单阳管其实就是只加一种荧光抗体的样本管,比如你的样本有三种荧光抗体染色(FITC, PE, APC)。除了被检测样本外,另外还需要4个管子,一个是无染色的,一个是FITC阳性染色,一个是PE阳性染色,还有一个是APC阳性染色
在制备单染管时有哪些要求呢?
(1)、单染管和样本管的样本类型要保持一致,并且尽量选择处理的样本,保证有明显的阳性峰和阴性峰。
(2)、用来调节补偿的抗体必须与实验用的抗体荧光素一样。
(3)、单染管和样本管的操作方法要保持一致。例如检测胞内因子时,如果样本管进行了固定破膜,那么单染管即使是表面染色,也需要进行固定破膜。
(4)、单染管各个荧光通道的电压需与正式上样时的电压保持一直。
解释:荧光素的MFI值会因为电压的改变而改变,从而无法正确计算补偿值。
很多老师反馈说当marker丰度比较低时阳性群表达量低,很难准确区分阴阳性峰。特别是某些探索性实验。实验者本身不知道某些蛋白的表达情况,那这个时候应该怎么办呢?
我们可以选择用补偿微球代替细胞来制备单染管,商品化的补偿微球是聚苯乙烯微粒,用于优化荧光补偿设置。一般有阴性珠子和阳性珠子。充分混合后和抗体孵育,将得到阴性和阳性群比例一定的单染管。
补偿微球优点:(1)节省样本,不必使用有价值的细胞或者组织样本
(2)制备相对简单,大大减少工作量
(3)阴阳分群明显,避免了弱阳性样本信号不够强的问题。

△点击放大图片
分别使用肿瘤,脾脏和补偿微球制备的CD3单染管的分群现象
缺点:(1)有一些抗体无法用补偿微球进行染色。比如FVS系列死活染料就无法与补偿微球结合。(FVS染料与氨基结合)
(2)大多数情况下,用补偿微球计算的阴阳峰MFI相对值(Positve/negative)比样本管要大。
解释:补偿微球的阴性峰的MFI值在大多数情况下小于样本单染管,是因为补偿微球表面不会表达FcR受体,所以补偿微球的阴性珠子不会与抗体产生非特异性结合。但微球的阳性珠子和抗体结合后都会表现出强阳性,而这是一般生物样本无法达到的强度。如下图不同单染管在电压相同的情况下MFI值的差异。
那我们如果选择补偿微球制备单阳管时,又有哪些注意事项呢?
(1)使用要阴性和阳性珠子要混合均匀。
(2)补偿微球的直径颗粒度都小于大多数免疫细胞,如果阈值设置过大或者FSC/SSC电压过小,都会采集不到信号。如图为电压相同的情况下不同单染管的散点图。

△点击放大图片
(3)补偿微球上机时的电压应该按照其本身的电压设置,因为补偿微球的阳性峰都非常强,某些弱阳性实验样本的电压值套用到补偿微球上会让补偿微球的阳性峰(特别是PE这种比较亮的荧光素)超出动态范围。
(4)补偿微球不是能和所有的抗体结合,所以要依据抗体来源选择。
很多老师应该都提出过这样的疑问——单阳管是不是第一次建立模板时需要制备,后面实验就直接调用历史补偿呢?
如果Panel比较复杂是不推荐这样做的,因为调用历史补偿后都会存在过度补偿或者补偿不足的现象。特别是Panel超过十色的情况下。下图为调用历史补偿后的结果图。这种单通道补偿不准确的结果会不断累加,造成细胞群分布混乱。
那针对这种情况我们应该怎么改进呢?
(1)单阳管应该以样本为主,少数弱表达marker使用补偿微球进行补充。
(2)为了确保计算的补偿值正确,我们可以先圈出上一级细胞群,再从该细胞群分出阴阳群体。
(3)应用自动补偿后最好再观察每个通道荧光溢漏情况,再结合手动补偿进行微调。例如下图是在自动基础上再手动进行调整的
(4) 历史补偿值调用必须建立在电压,光学滤片,光路聚焦都没有任何改变的前提下。对于多色的样本,在调用的同时最好进行微调。

△点击放大图片

△点击放大图片
很多老师应该都遇到这样的现象,双参数荧光图在补偿调节后,大量的细胞群“下沉”至0值下方,无论怎样调动坐标也无法将这部分细胞群显示出来。只有打开Biex后才能显示完整的细胞群这是为什么呢?

△点击放大图片
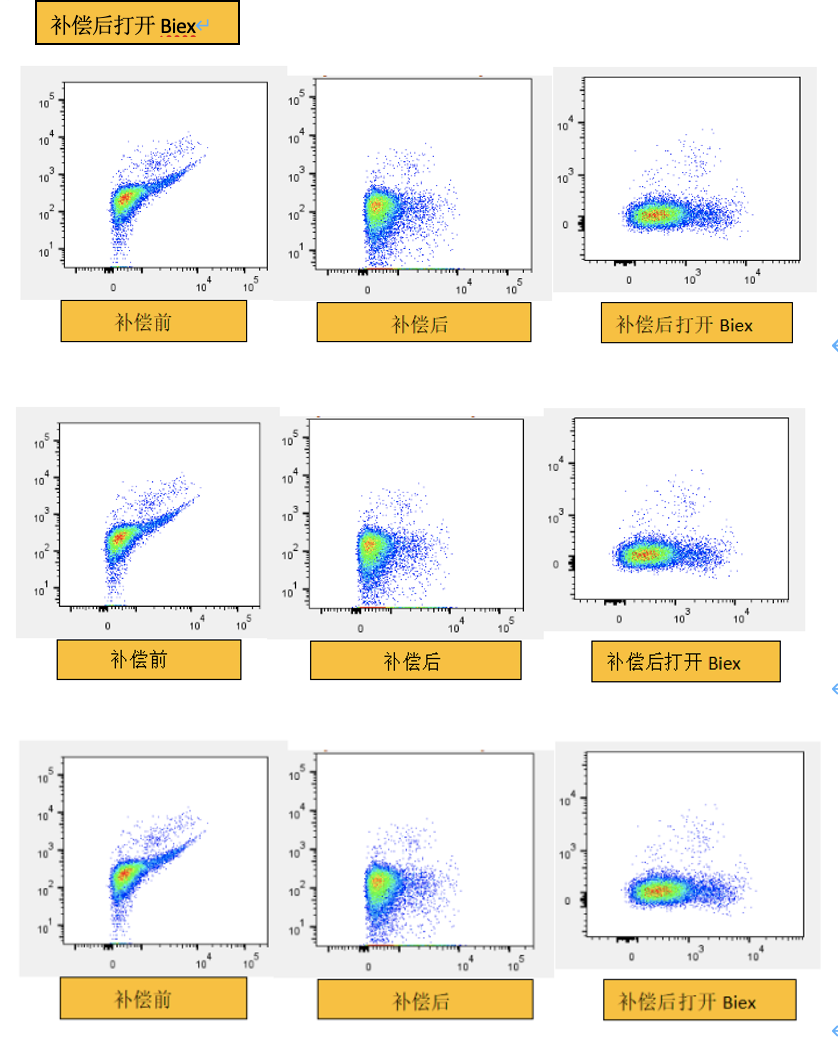
△点击放大图片
其实这与细胞群的离散度有关。“离散度”指的是阳性细胞群荧光通道内的离散情况。一般阳性信号越强,细胞群实际的离散度越大。因此调动补偿后感觉细胞的离散度变大是因为一般的荧光信号都是对数形式显示,而补偿的调整是线性的过程。将对数显示的信号进行线性补偿调整后,视觉上会觉得整个细胞群被拉伸,阳性群的面积增大。离散度与使用样本类型,仪器状态,电压值都相关。
那在实验中应该怎么避免造成这种误差呢?
(1)尽量选择不同激光器激发的荧光素,可以最大限度的避免补偿。

△点击放大图片
(2)同一激光器下尽量避开选择光谱严重的重叠的荧光素,比如BV605和bv650,APC 和AF700。
(3)补偿值理论上不会高于100%,如果超过可查看某些复合染料是否在染色过程中发生了部分断裂,并确认通道的电压是否在合适的范围。
(4)补偿值如果出现负值且低于-1时,有可能是某些通道“过补偿”造成的。
正确设置单染管并精准分析,我们的实验结果才会惊艳,本期的罗工秘笈到这里也告一段落了,如果大家有其他的心得体会,也欢迎各位老师在留言区进行分享哦~
4、什么是真正的阳性信号(点击返回目录)
你的阳性真的是阳性吗?
流式图里大家是靠什么去判断阳性的尼?不要告诉我你是这种心态圈门的!
对于流式分析数据,大家一定要严谨,严谨再严谨啊!
罗工为了大家流式实验的严谨性是操碎了心,特地针对提升数据严谨性出了2期分享流式实验方案对照设置。
首先,将所有的对照方式整理到大家手上:
Controls

△点击放大图片
关于 Instrument QC,主要是根据流式细胞仪具体仪器配置的不同而选择不同的质控微球,更多是平台老师来进行日常维护工作,以下是相关产品,例如:
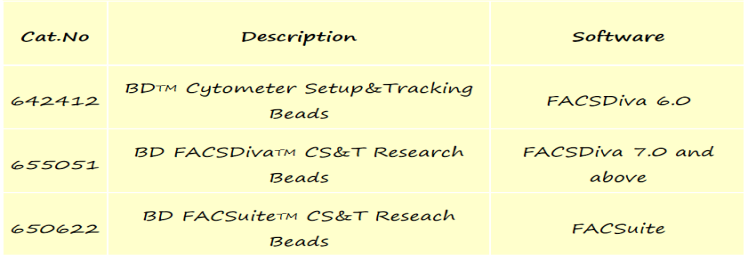
△点击放大图片
其次,关于Parameter controls,目前主要是两种主流设计方式,一种是,用我们的样本来设计单染对照;另外一种是,利用通用的补偿微球来设计;下面介绍一下各自的 优缺点:
细胞:
优点:真实的反映细胞的背景和指标表达情况;能适用于所有荧光
缺点:个别表达量低的指标,无法保证细胞有明显分群,无法利用它来进行补偿调节。
注意事项:
补偿对照管中使用的荧光染料应与实验中使用的试剂完全相同;
阳性和阴性群体为同一类型细胞以确保自发荧光必须相等;
补偿对照管里的阳性群体越亮越好;
收集足够数量样本信息以计算得到准确的SOVs值。
补偿微球:
优点:使用简单,不需要使用样本,对大多数荧光素,分群比细胞更加清晰
缺点:补偿微球是细胞的替代品,并不是细胞的完美匹配,与细胞存在微小的差异,这些区别和样本以及实验有关。

△点击放大图片
接下来,最最关键的部分是Gating controls:Isotype and FMO
Isotypes:主要是从细胞自发荧光、FC受体和其他非特异性染色的角度来排除细胞的非特异性染色;与此同时,其中最关键的是如何来选择同型对照:
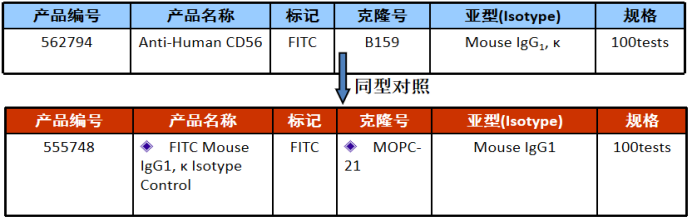
△点击放大图片
尤其是同型对照的抗体用量,我们一定要根据抗体和同型对照抗体的浓度,来进行换算,这个各位老师一定要记得哦!
如何利用空白和Isotypes来进行样本圈门:

△点击放大图片
5、什么是真正的阳性信号2(点击返回目录)
荧光减一(FMO,Fluorescence minus one)对照
如果只用到两种颜色的话,这个对照可以用单阳性对照代替,如果三种以上颜色的话,就需要再设置 FMO 对照来评估其他荧光染料的干扰和补偿本底,帮助正确设置阳性门荧光减一(FMO)对照,建立多色方案时是非常重要的,因为它们将帮助你确定感兴趣的门应该在哪里设置,尤其是在表达水平很低需要从较大百分比的阴性群体中识别阳性时,FMO特别重要。当获取多色数据时会有荧光散布的问题,特别是亮的荧光素在补偿和交叉激光激发之后特别明显。 FMO对照是用实验设计里的所有荧光减去一个荧光后染色的细胞样本, FMO矩阵的例子如下表所示:
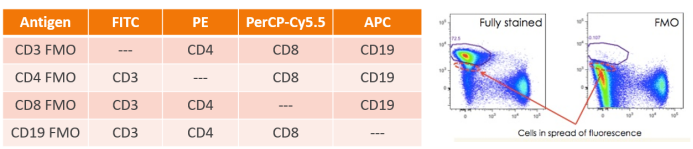
△点击放大图片
如果按空白对照组设定界线之后得到的细胞比例和 FMO 设定的值有差异。以FMO为准,因为空白对照仅仅是设定阴性界线,但非阴性并不等于就是阳性,所以还需 FMO 来设定阳性界线。
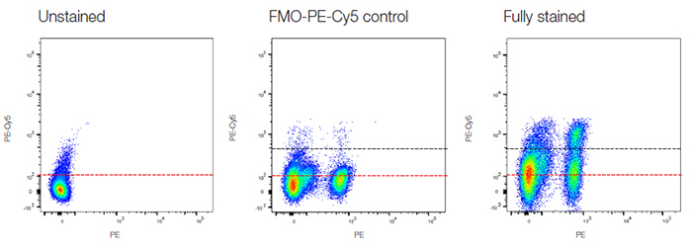
△点击放大图片
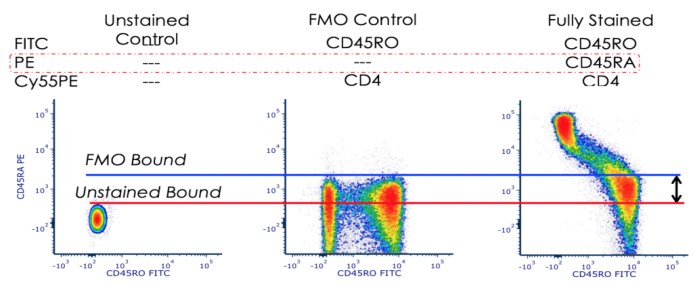
△点击放大图片
生物学对照
生物学对照对于所有染色都是重要的,但对于具有更高背景荧光的细胞内染色更重要。生物学对照包括已知的阴性样品和已知的阳性样品。可以理解为文献中的Control或者是Vehicle组。如细胞内染色实验涉及固定和透膜,这些步骤会影响抗原检测,自发荧光,荧光素亮度和细胞形态,生物学对照显得更为重要。
未给药-低浓给药-高浓度给药

△点击放大图片
刺激和未刺激对照

△点击放大图片
当然大家要根据自己的实验情况选择适合自己实验方案的生物学对照,就不在这里一一举例了。
2期内容和大家分享了单染对照、isotype 对照、FMO对照和生物学对照,大家都学会了吗?这些是基本的圈门对照,帮助我们更严谨的判断阳性群体,大家都学会了吗?





