- 1、教你3步做出更好的流式结果图
- 2、Flowjo之周期数据知多少
- 3、Flowjo批量导出数据竟如此简单!
- 4、flowjo之数据前处理
- 5、怎么长期保证流式数据的一致性及不同流式仪器的数据一致性?
1、教你3步做出更好的流式结果图(点击返回目录)
虽然罗工之前做过如何得到更好流式结果图的文章,但还是经常碰到有老师过来提问:为啥我的流式实验结果和文章里的不一样?罗工你有空能不能帮我看一下或者调一下呢?然后。。。哇塞,怎么又变得和文章里一样了,这样看好看多了!
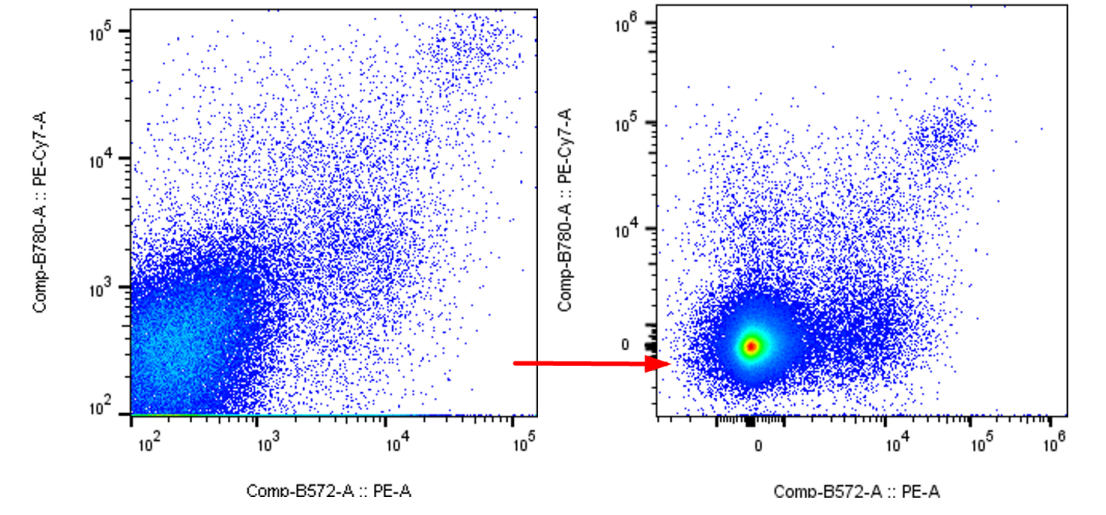
△点击放大图片
为啥左边的图可以秒变右边那种样子的呢?是罗工会变魔术么?不是,今天就教大家简单3步,用flowjo做出和很多文章一样美观的流式结果图。
△点击放大图片
首先我们打开flowjo,把你的实验文件拖动进去,双击打开分析工作台,调节好荧光补偿,然后选择待展示的2个通道的流式结果图:
△点击放大图片
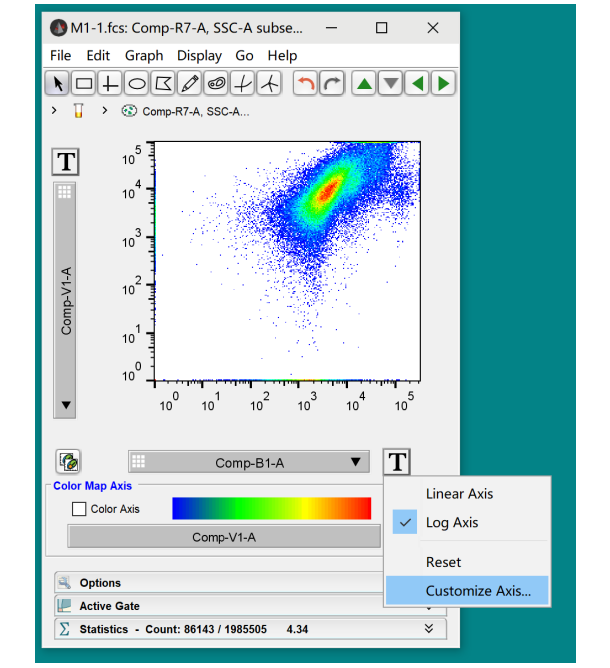
例如,我选择了V1/B1这2个通道的散点图展示,此时图像呈现了阴性和阳性压线,双阳性等各种问题,如何解决呢?我们选择通道旁边的大写的字母T,点开后选择“Customize Axis”这个选项,此时就会展现当前坐标轴的编辑界面:
接下来我们三步走:
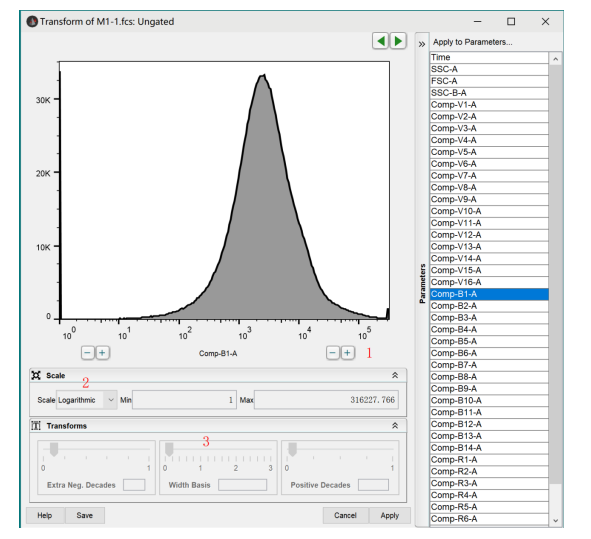
第一步,我们选择点击1处的+号,消除阳性压线的情况,让阳性结果全部出来:
△点击放大图片
第二步,选择Scale选项,切换坐标轴类型,当有阴性压边时,优先选择biex双指数轴(需要注意,部分流式细胞仪的轴不支持选择biex轴,如美天旎公司,guava这两台仪器,有着自己独特的坐标轴,另外BD calibur等老型号仪器也不支持biex轴显示)
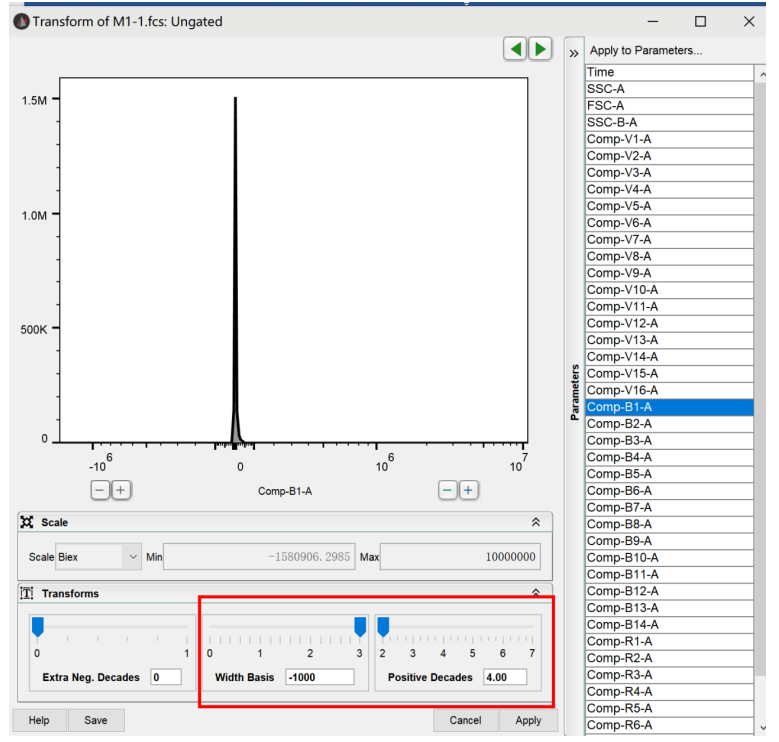
△点击放大图片
切换为biex后,下方width basis和Positive Decades选项被激活,进入第三步:
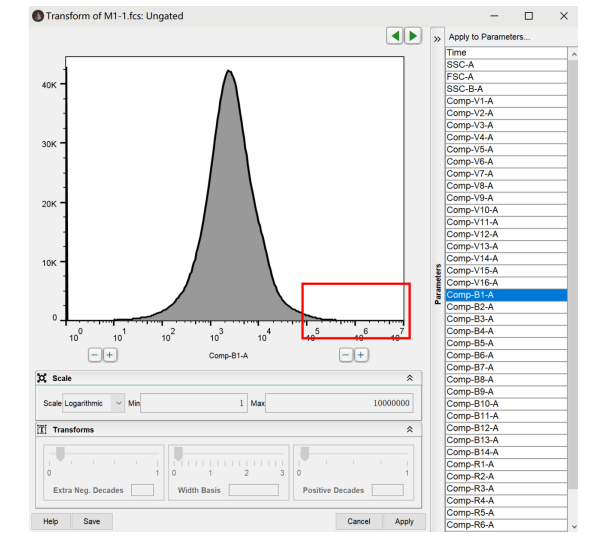
第三步,调节width basis和Positive Decades,调节结果以消除阴性群压边的现象并尽量减少阴性区域的空白值为佳:
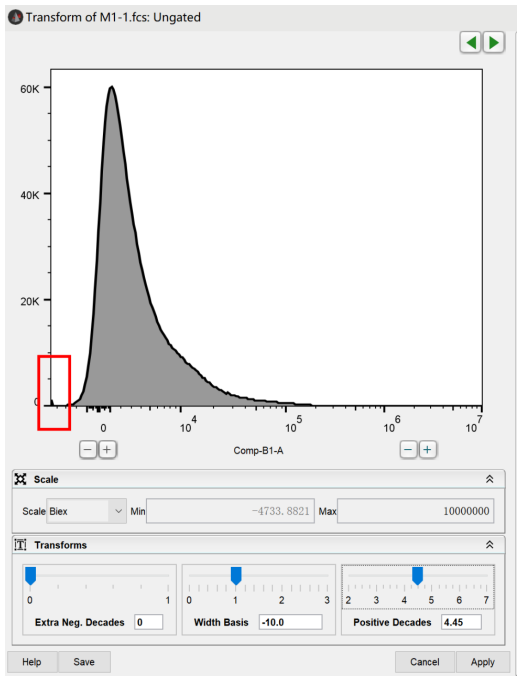
△点击放大图片
此时当前坐标轴的调节就基本完成了,然后我们依旧按照这个方法去调节另一个待展示的坐标轴,全部完成后,你的图像的阳性压线,阴性压线,双阳性上移等一系列问题都会成功消除:

△点击放大图片
怎么样,简单三步,我们的图像就能够脱胎换骨了,大家可以参考如上步骤,打开flowjo自己去做尝试,让我们的流式结果展示更加美观有效。当然有任何问题也可以随时留言寻求罗工帮助哈~
2、Flowjo之周期数据知多少(点击返回目录)
小橙子:罗工您好,我又来咨询流式问题啦。是这样的,我刚刚做了周期实验,数据也导出来了,怎么用flowjo分析这个周期数据啊?
罗工:小橙子你好呀,上次的实验优化之后结果怎么样啊?下面就来和你聊一下用flowjo如何分析周期数据。
小橙子:上次优化后结果很好,这不又来请教问题啦。
罗工:用flowjo分析周期数据,其实也不是特别难,正常的流程就是我们要把数据拖入flowjo分析数据模块,进行圈目的细胞。如下图。
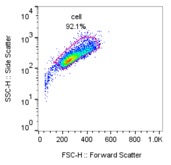
△点击放大图片
接着去除黏连体,根据经验所得,在去除黏连体的时候最好用通道的A和W,这样拟合出来的周期曲线会好很多。如下图
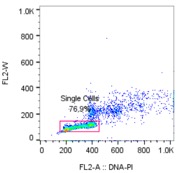
△点击放大图片
最后点击拟合周期小图标就可以拟合出来周期曲线啦,如下图
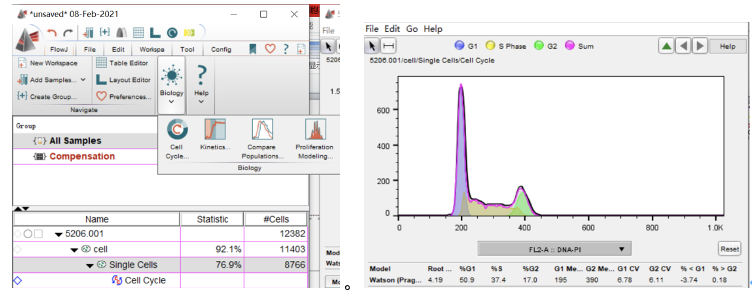
△点击放大图片
小橙子:谢谢罗工,我自己刚才按照你这个流程拟合出来了周期曲线,但是我如何进行解读呢?
罗工:拟合周期曲线之后,下面会有对应的数据,如下
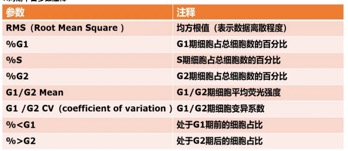
△点击放大图片
如图所示,理论上模型曲线和样本曲线拟合越一致越好。周期拟合结果的好坏还可以通过RMS值进行判定。RMS值越小表明拟合结果越好。RMS没有确定的范围,是一个相对值,比如图拟合结果对应的RMS值为2.86,结果较好。拟合较差时,可以尝试更改拟合模型。
还有就是CV值也就是变异系数,CV值主要受仪器灵敏度、样本制备和染色过程的影响(比如参数设定和固定时间)。CV值越小,峰型越窄、越尖锐。CV值设定在5左右比较理想,一般大于10则对结果不认可。一般采用G0/G1期CV值用于判定结果的精度(分辨率)。CV值限定也有两种方法:①理论上,G1CV=G2CV或者G2CV=G1CV,可以根据这一原则对CV值进行限定。②手动输入固定的CV值,一般建议参考整组样本中拟合最佳样本的CV值进行设定,同一组样本的CV值变化很小。如图
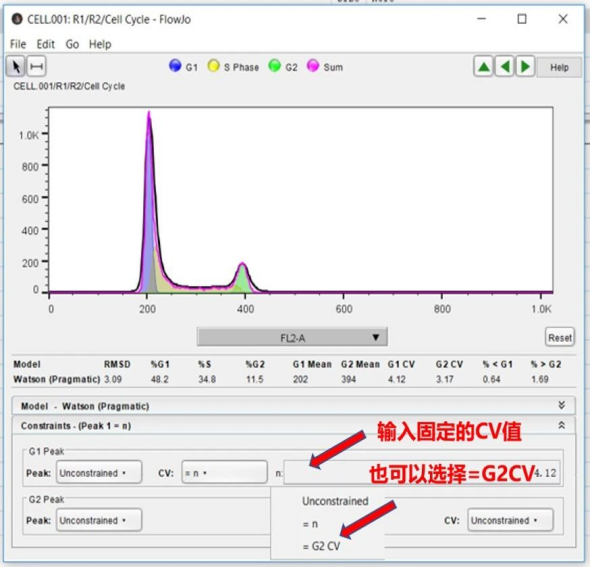
△点击放大图片
那么一整个flowjo分析周期数据的流程就这些。希望这次的咨询对你也有帮助哈。
小橙子:谢谢罗工,很详细。有什么不懂的再来请教哦,再次感谢。
3、Flowjo批量导出数据竟如此简单!(点击返回目录)
本期罗工秘笈给大家详解一下如何将Flowjo中分析的数据进行批量导出,方便进行二次加工。
Flowjo是分析流式数据的第三方专业软件,通常除了Gating subset之外,我们还需要用到它的作图和统计百分比的功能。

△点击放大图片
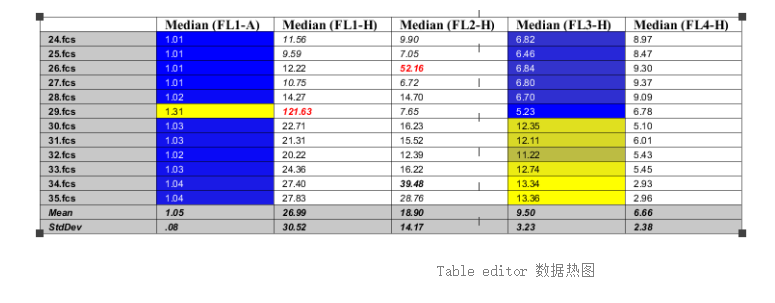
△点击放大图片
也就是Layout editor(图形制作) 和Table editor(数据统计)功能。而今天,我们着重要讲解的是Table editor(数据统计)功能

△点击放大图片
该功能旨在帮助用户把批量圈门的原始数据导出成excel文件或可视化的结果,方便做二次分析和展示使用。
△点击放大图片
△点击放大图片
首先打开flowjo软件,导入原始数据并且进行初步的门分析
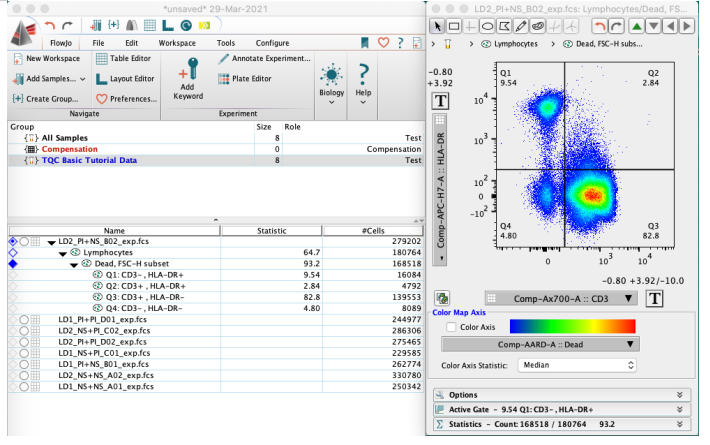
△点击放大图片
将分析的框架批量覆盖所有样本,批量圈门。
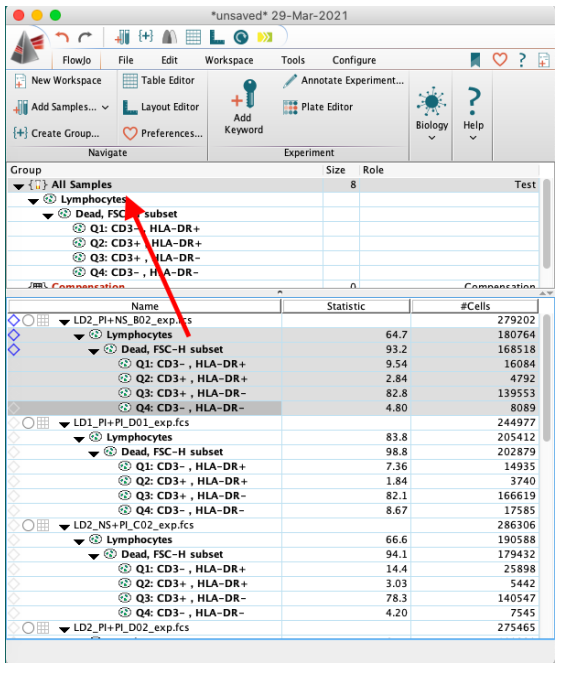
△点击放大图片
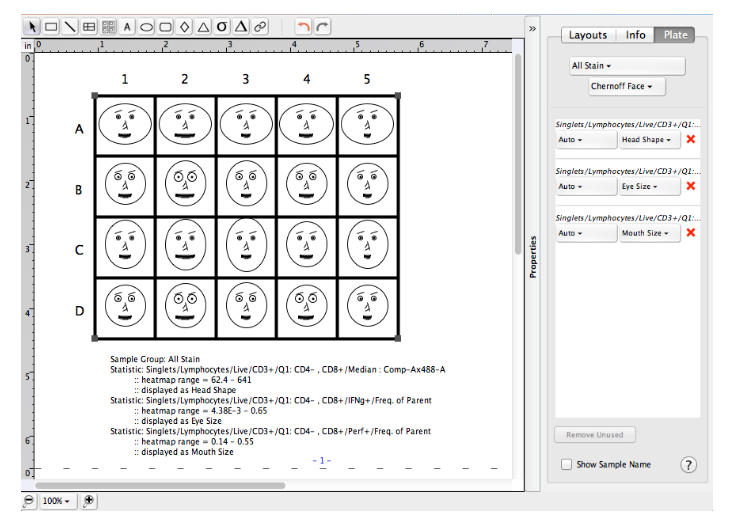
打开Table editor(数据统计)模块,将任意样本的门逻辑拖入Table editor框架中
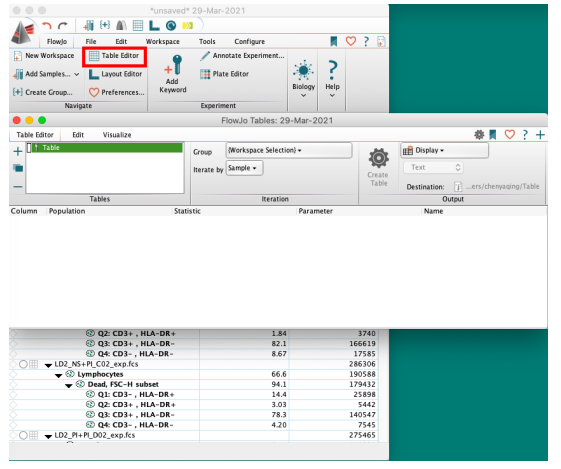
△点击放大图片
在通道中标注一下圈门的命名(可选项)
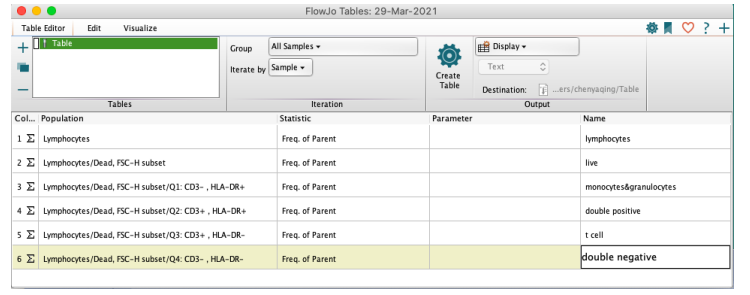
△点击放大图片
如有需要可添加heat map效果(该效果仅体现在html中,excel无法导出此热图效果)
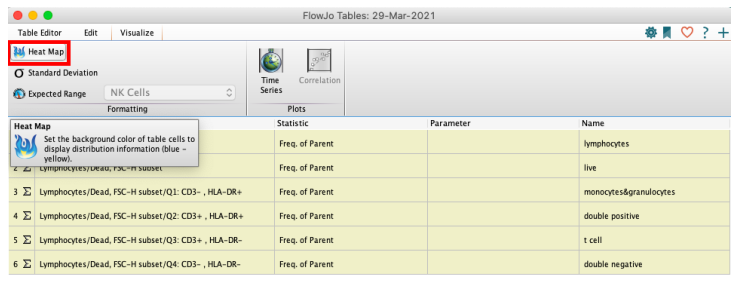
△点击放大图片
在导出选项中选择导出文件,选择excel即可

△点击放大图片
点击桌面上生成的xlsx文件,即可看到在该表中,表头是命名的细胞亚群,而首列是不同样本,最终得到的就是不同样本下,不同细胞亚群的的细胞亚群。

△点击放大图片
小Tips:默认导出的是百分比,如要添加的是mean/MFI值的话,也可以拉入table editor中哦!
4、flowjo之数据前处理(点击返回目录)
数据前处理——你以为的”good events”到底是不是good events?
在介绍内容之前想要先问大家几个问题?
1、是否开始跑样之后,迅速开始收样?
2、在开始收样之后你们是否在仪器上又多次调整了流速?
3、在开始收样之后,发现数据不对劲是否会把样品管拔下再插上?
什么?这些情况都出现过?
那你可就要小心了,你的数据可能 not good!
在2016年,Fletez- Brant科学家就做过研究,研究表明,哪怕你仪器的质控做得合格,还是会有0-13%的数据是不太好的,这跟我们的操作相关,也跟仪器的状态和性质相关。
那如何判断仪器的状态如何?又如何去除不好的数据?
首先,我们拿到数据之后,先要对我们的数据质量进行检测。
△点击放大图片
导入数据之后,先双击点开数据前的○,会跳出来一个窗口。
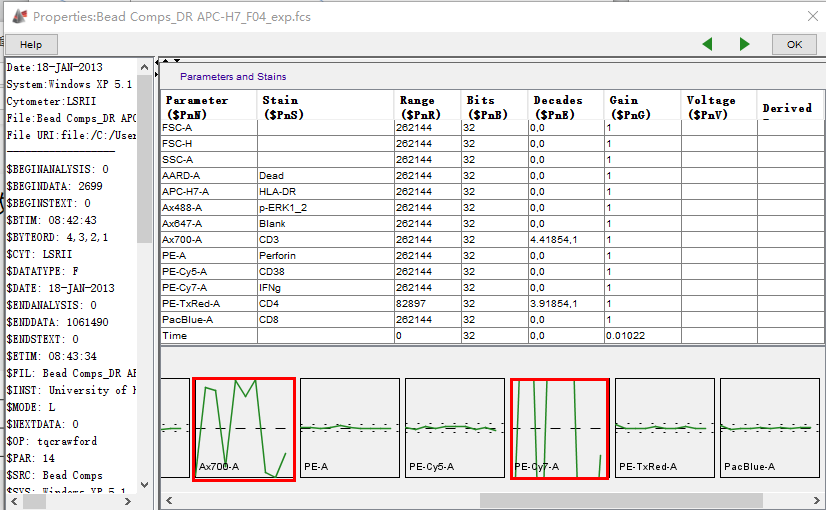
△点击放大图片

△点击放大图片
每个通道的状态会显示成单独一个小方格,在虚线内轻微波动时,表示各个通道较为稳定,得到的数据也不会有太大偏差;而波动较大时,一方面得到数据的可信度会降低,另一方面仪器通道的稳定性有待标准。

△点击放大图片
只要把鼠标放在○上,会提示数据的质量,如果显示OK,则表示可以通过,如果显示为红色,则表示数据本身已经出现了了较大的质量问题,不太建议继续分析使用。
检查完数据质量之后,这个时候,“sample quality is OK”是代表数据合格,但是这个时候不好的数据还是存在的,如何把这些数据去除掉呢?
需要用到我们的一个插件功能FLOWAI

△点击放大图片
选中样本,点击插件中的flowA等待分析好即可。这时候会出现一个BadEvents和一个GoodEventsI。
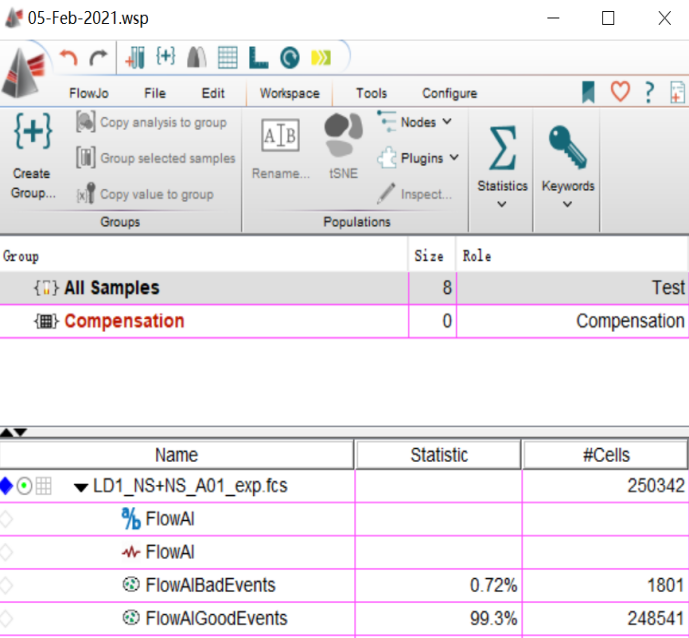
△点击放大图片
我们只需要用good events进行后面的分析即可。在双参数散点图上看原始数据和GoodEventsI其实是不明显的,但是我们可以通到看Time门更直观地观察到,它们的区别。下图是BadEvents占不同比例的结果。
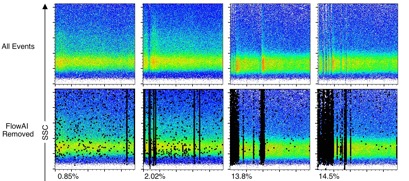
△点击放大图片
在第三组图中,很明显的可以观察到,造成如此大的数据质量问题的原因,大概率是因为在收样过程中调整了流速导致液流不稳定的结果;而第四组图中,更大可能是因为,刚跑样,还未等待液流稳定就开始收样,导致前期大片数据需要被去除。
所以在上机的过程中,我们应当,先跑样调整细胞圈门,再调整流速确认收样速率,最后再开始收样,而且过程中千万不要插拔样品管。
时间固然重要,但是也不要贪图省事哦!
我:罗工,我看了上期的秘籍,知道了FlowAI插件可以帮我剔除每个样本中不好的数据,老板现在让我分析样本间的差异,可我上机时收集的样本细胞量都不一样怎么破?
罗工:FlowJo中的Downsample插件就可以帮你把不同样本中的细胞降到一个数量级呀!
我:真的吗?快教教我怎么做
罗工:第一步:打开FlowJo,然后点击workspace,找到Plugins,选择安装好的Downsample插件。(Tips:一定要先点击样本再点击Downsample,否则插件呈现灰色,无法运行奥)
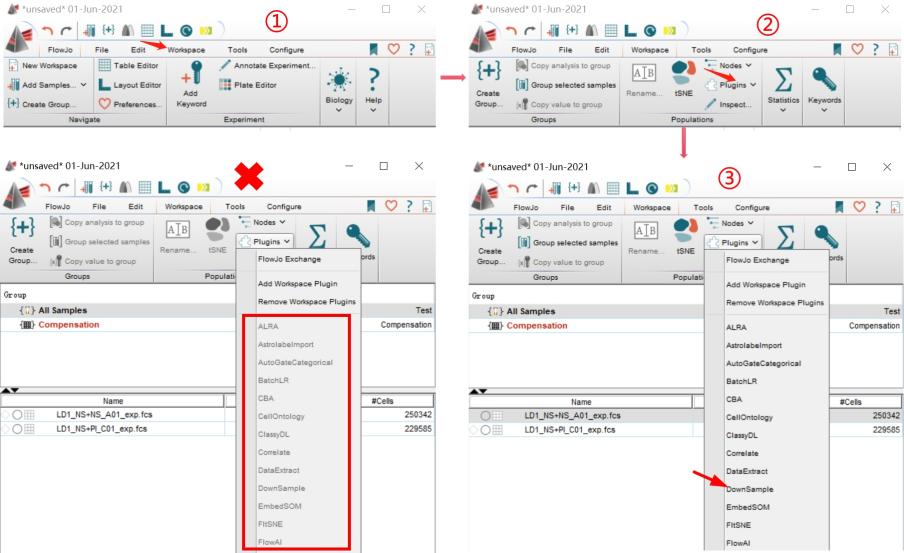
△点击放大图片
我:罗工,为什么我的Plugins点开,却没有任何插件呢?
罗工:那是你还没有安装插件,复制此链接在网页打开:
https://www.flowjo.com/exchange/#/
,把你需要的插件下载到FlowJo安装包下的Plugins文件夹下,然后打开FlowJo,点击❤,找到Diagnostics,把插件的路径复制到对话框中即可。(Tips:切记路径中不可以出现中文奥)
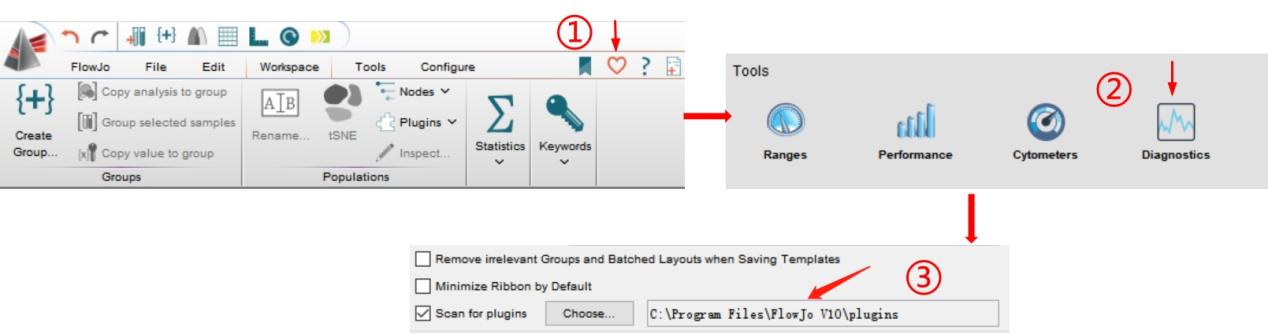
△点击放大图片
我:好的罗工,马上去安排插件的安装
罗工:第二步:点击Downsample插件,在弹出的对话框中点击Yes,选择一个保存的位置,浏览所有样本的细胞量,在箭头所指的对话框中填入细胞量最少(down的水平值)的数字。(Tips:极端数据可去除,否则影响整体分析)
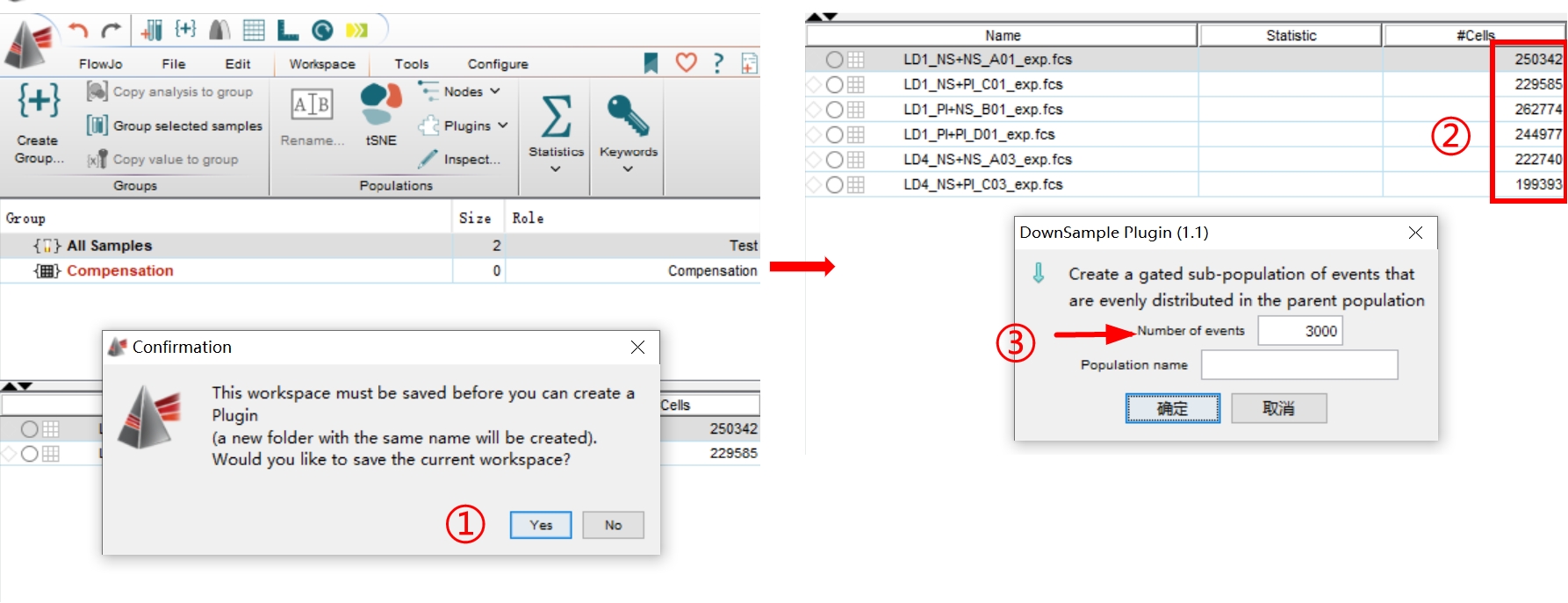
△点击放大图片
我:我可以理解成大部分样本收了5w个,有一个样本收了1w个,就可以把这个数据去掉对吧?
罗工:是的。为了运算快,我down在了1w个细胞量,将绿色剪头Downsample运算插件拖入All Samples中,可一键批处理所有样本的Downsample运算。(Tips:运行完,检查所有样本的细胞量是否down在一个水平,如有异者,重新针对此样本进行Downsample)
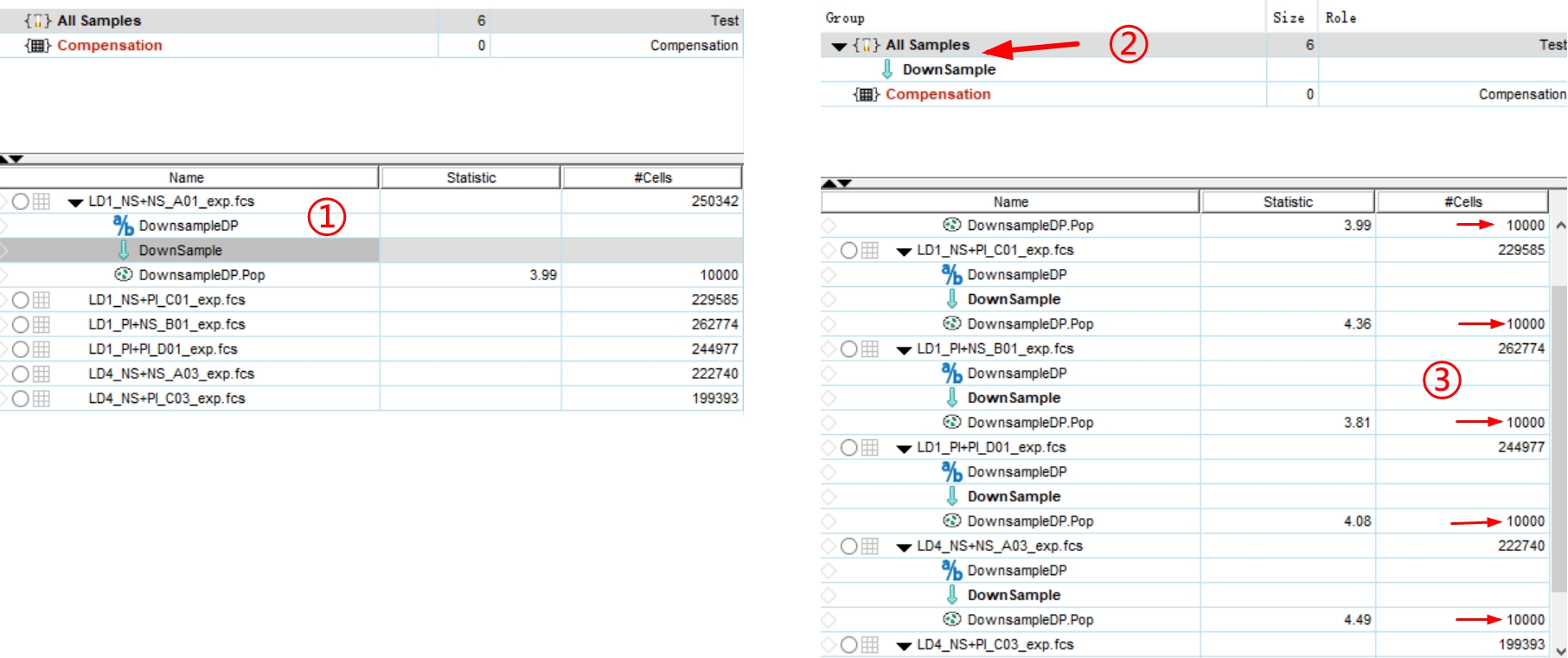
△点击放大图片
我:好的罗工,做完作业进行检查是培养了十几年的好习惯了
罗工:第三步:随机选中某个样本down完的数据,右击选择Select Equivalent Nodes,就可以把所有样本down完的数据进行选中,然后点击File-Export/Concatenate-Export/Concatenate Populations
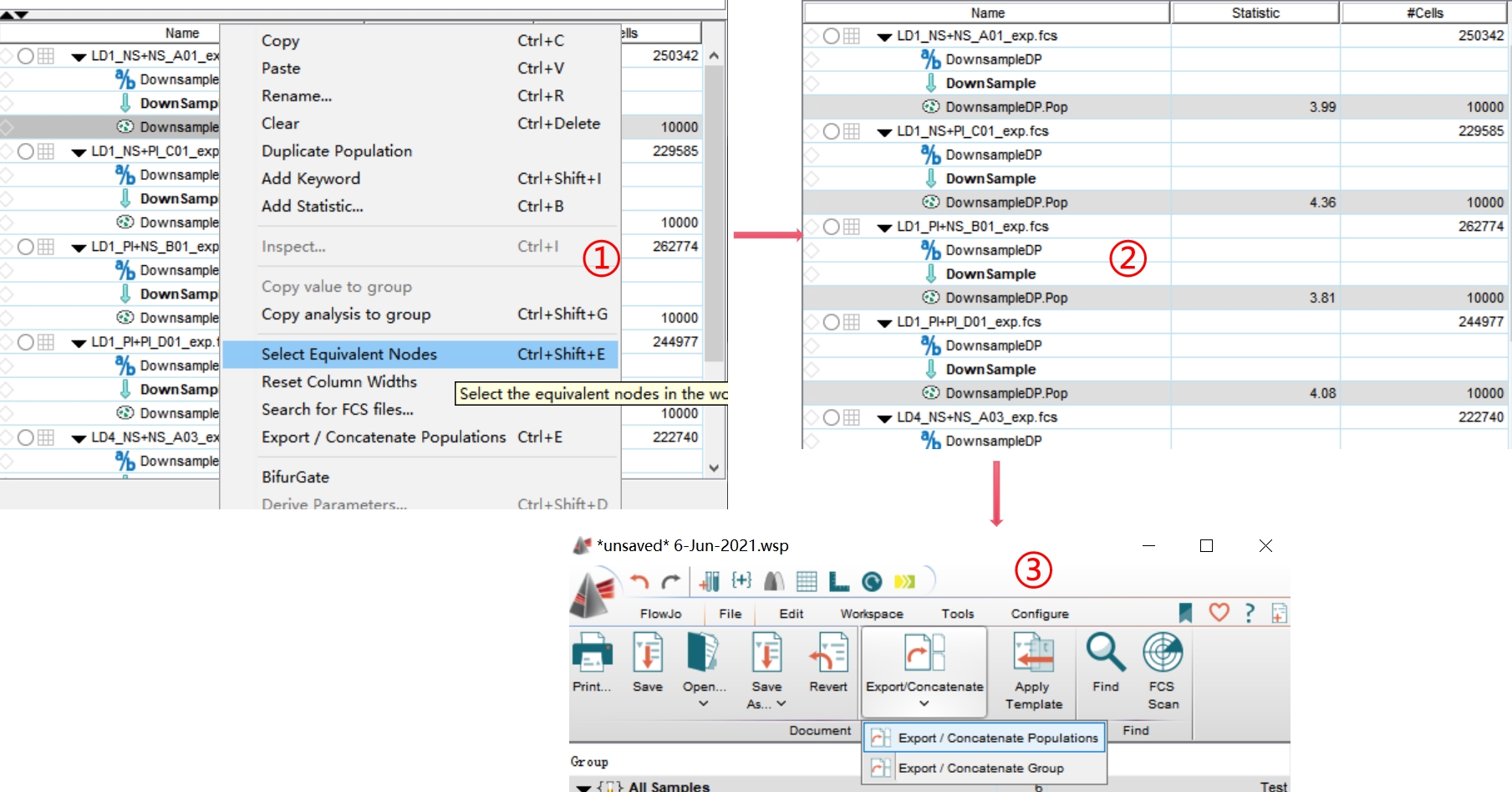
△点击放大图片
我:哇塞,选择同一逻辑的快捷键也太方便了,不用按住ctrl,挨个进行选择......
罗工:最后一步:在弹出的对话框中选择Concatenate,点击Advanced Options,可对整合的文件进行命名(前缀Prefix和后缀suffix),点击右下角Concatenate,整合结束选择文件保存位置(建议保存当前workspace即可),在原始数据下方会生成一个新的fcs数据,就是我们整合完的数据,接下来就可以进行tSNE分析了。
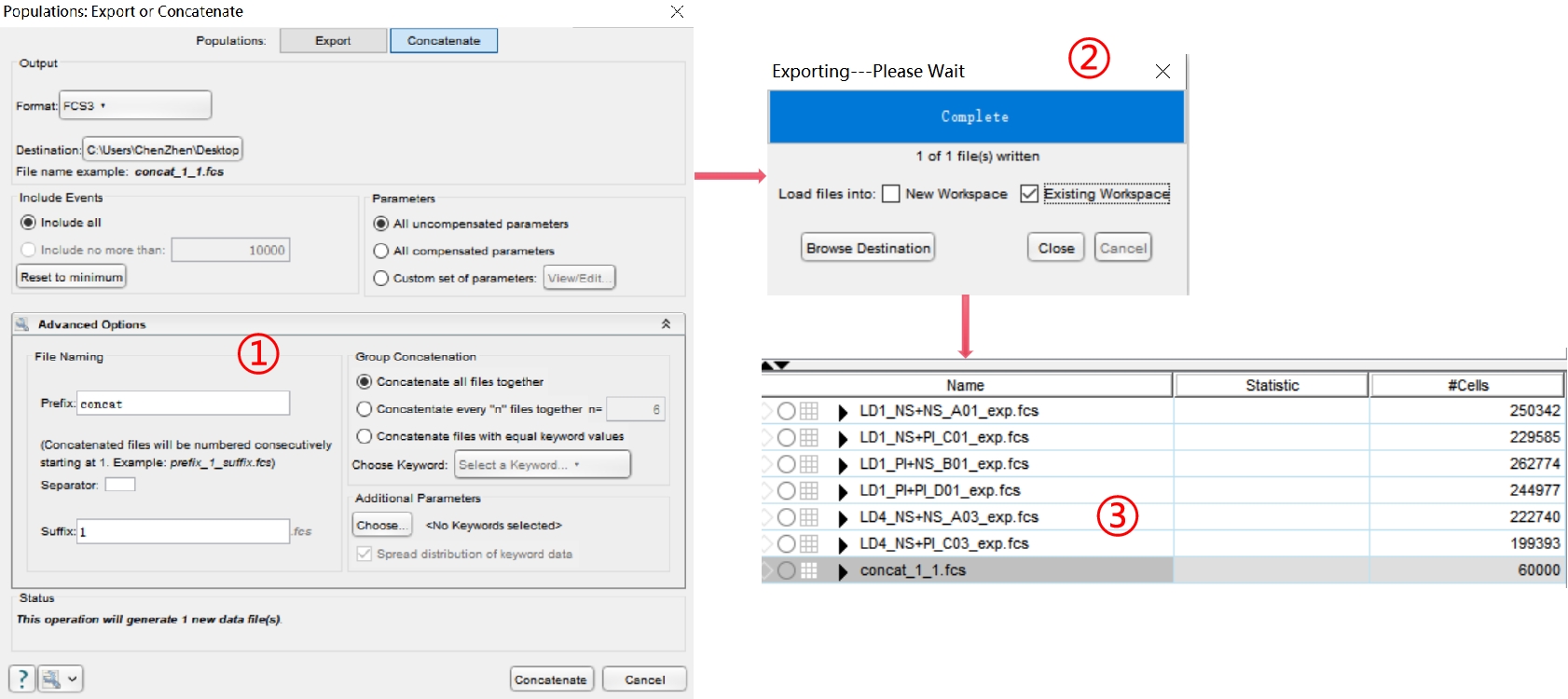
△点击放大图片
我:谢谢罗工,这个插件拯救了我的样本间细胞量差异大的问题
罗工:我们针对Downsample插件的使用录制了教学视频,可以参考B站:https://www.bilibili.com/video/BV1Si4y1j7LB/进行学习奥,大家学会了可以和我们分享下使用心得~
5、怎么长期保证流式数据的一致性及不同流式仪器的数据一致性?(点击返回目录)
Q: 罗工,我用师兄的模板咋跑出来的图和师兄的不一样呀?
A: 这个问题需要考虑的因素很多,样本类型是否一致,染色时抗体浓度,师兄的模板建立后仪器是否维修过、是否质控在控等。
Q: 哦哦,原来如此,那我现在样本是改变了,是需要重新建立模板,但是我的样品收样时间较长,会不会以后检测结果也会出现偏差?有没什么好办法让我的图保持一致?
A: 是有的哦。首先我们一定要在样本制备上是一致稳定的,详细内容可参考【罗工流式秘籍13】,特别要提醒:多色一定要做细胞计数、抗体滴定,过多的抗体,又没有充分的洗涤,会增加背景信号,即使同一天检测,样本偏差也会特别大。然后建立合适的各通道电压,即模板。怎么长期保证结果的一致性呢?在模板的电压条件下采集质控小球的数据,圈出最弱信号小球和最强信号小球,记录统计表中MFI值,长期保留画门。以后实验都先跑质控小球,对比首次数据,调整电压使MFI值与首次的值相等。

△点击放大图片
8 Peak小球,固定圈门各通道低信号峰和高信号峰得各自MFI
Q: 罗工,这有点难,有仪器帮助我们快速实现吗?
A: 可以选择BD 带Diva软件的流式仪如Canto、Fortessa、Celesta等,可以通过CS&T质控和Application Settings的功能自动帮我们校准。其他机型的仪器,目前没有此功能,需要手动,但也不需要担心,如果我们的仪器是质控在控的状态,微小的差异都是在流式统计可控的范围,对于不分析MFI值的差异,只统计%的差异的实验,只要仪器在控即可,不需要每天校准电压。
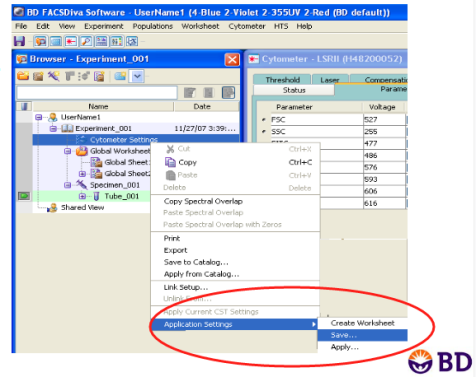
△点击放大图片
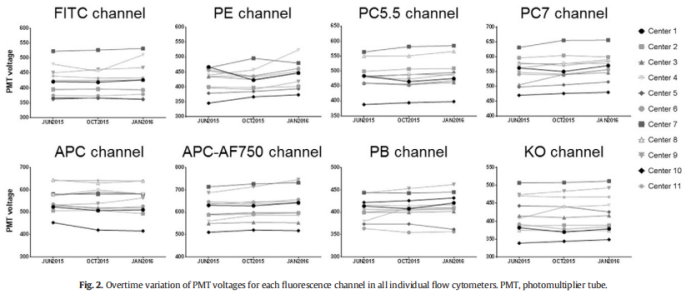
△点击放大图片
3个时间点,11个平台,各通道达到预期MFI的电压值变化
Q: 罗工,可是我发现我不同组的样本差异也很大诶。
A: 不同刺激或固定破膜等处理的样本,可以取blank管建立不同的电压设置,以各组blank在各个通道的MFI值相同为标准。
Q: 罗工,那不同流式仪上是否也可以做出相似的流式图?
A: 对的,但不同流式仪的拟合信号值范围有所区别,需要转换,可以以一台仪器为标准转换到另一台仪器上,但不同仪器的分辨率、溢漏情况不同,多平台测试低表达群体的统计影响是较大的。

△点击放大图片
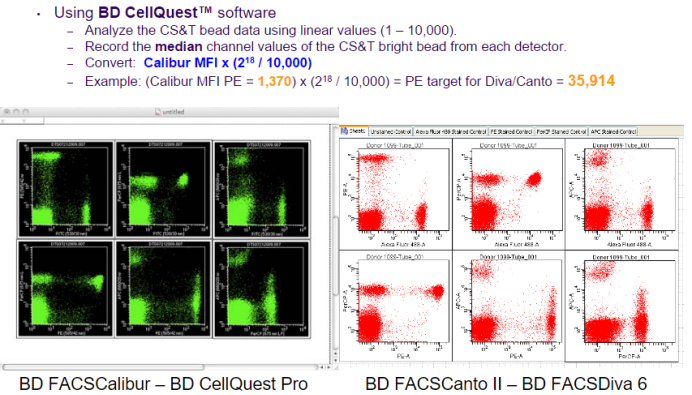
△点击放大图片
引用:
Multi-center harmonization of flow cytometers in the context of the European “PRECISESADS” project,Autoimmunity Reviews 15 (2016) 1038–1045.
Using BD FACSDiva CS&T to evaluate cytometer performance,create custom assay settings and implement cross-instrument and cross-site standardization of assays.





