- 1、用Flowjo进行图片批量导出,真香!!!
- 2、话说flowjo上没有补偿矩阵还能调补偿么?
- 3、上机时如何去除粘连体
- 4、避免圈了个寂寞--流式聚类分析flowsom深度教学
- 5、仪器也需要被关怀
- 6、流式数据分析后的保存方法知几何?
1、用Flowjo进行图片批量导出,真香!!!(点击返回目录)
师弟:罗工,最近用Flowjo分析的数据一把一把的,我的头发也是一把一把的掉。
罗工:哈哈这不是科研狗的日常?
师弟:你是不会知道哇,上次周二听你讲课数据分析还是学习了的,但是这数据多了之后导出流式数据有点麻烦啊。
罗工:导出数据有妙招啊!可以一次批量导出所有数据。
师弟:哦?竟然有此法宝,快说与我听听啊。
罗工:我这就给你演示下,首先在界面找到这个小尺子的标志。
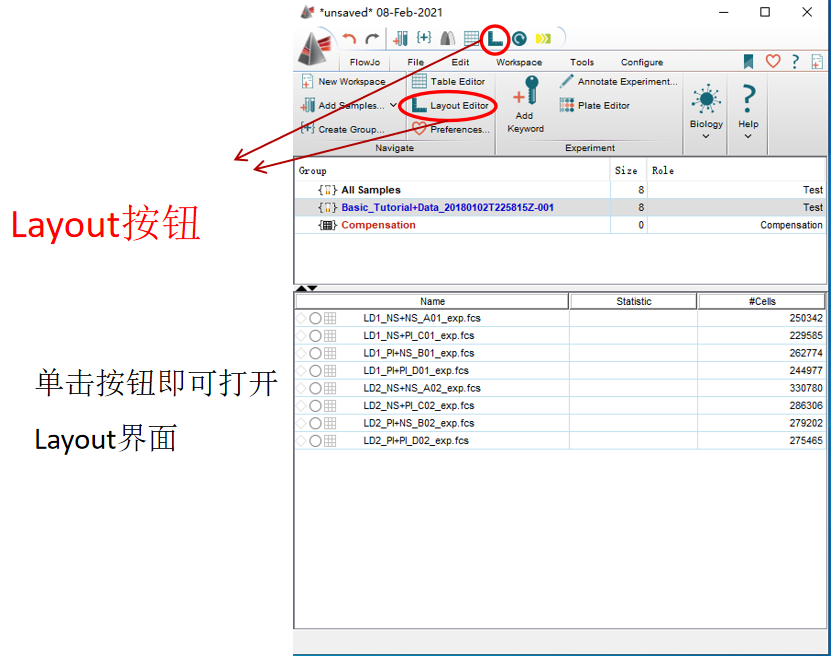
△点击放大图片
罗工:打开layout界面之后,将需要导出的数据拖拽到界面中。
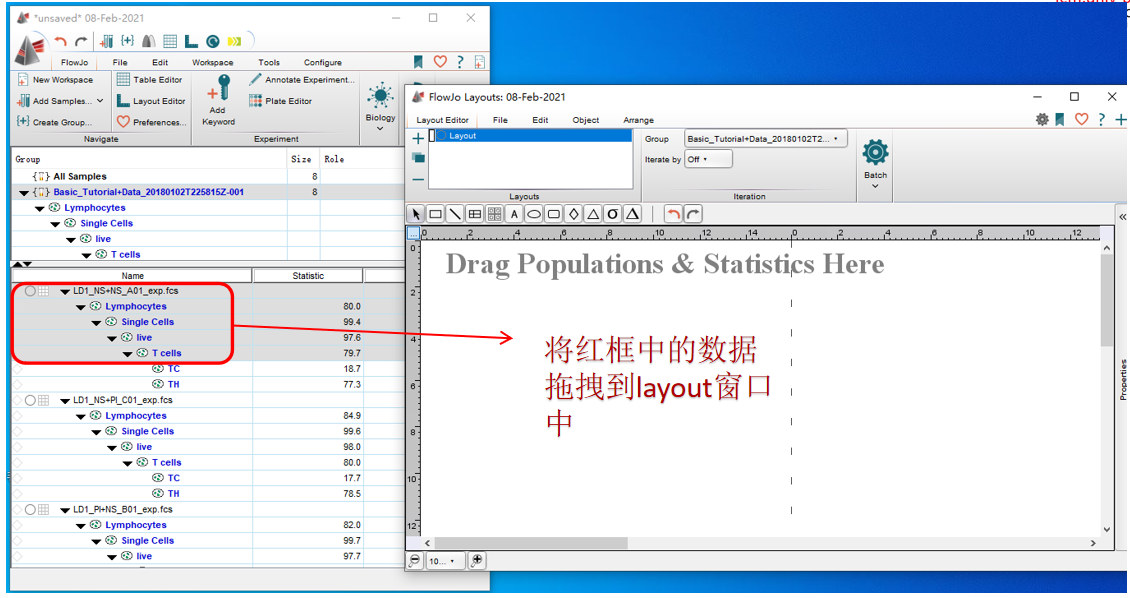
△点击放大图片
师弟:可是这样数据图不会排列的很乱么?
罗工:别急呀,我这正要说这这个问题呢,在界面中有个可以排版的功能~看下图。
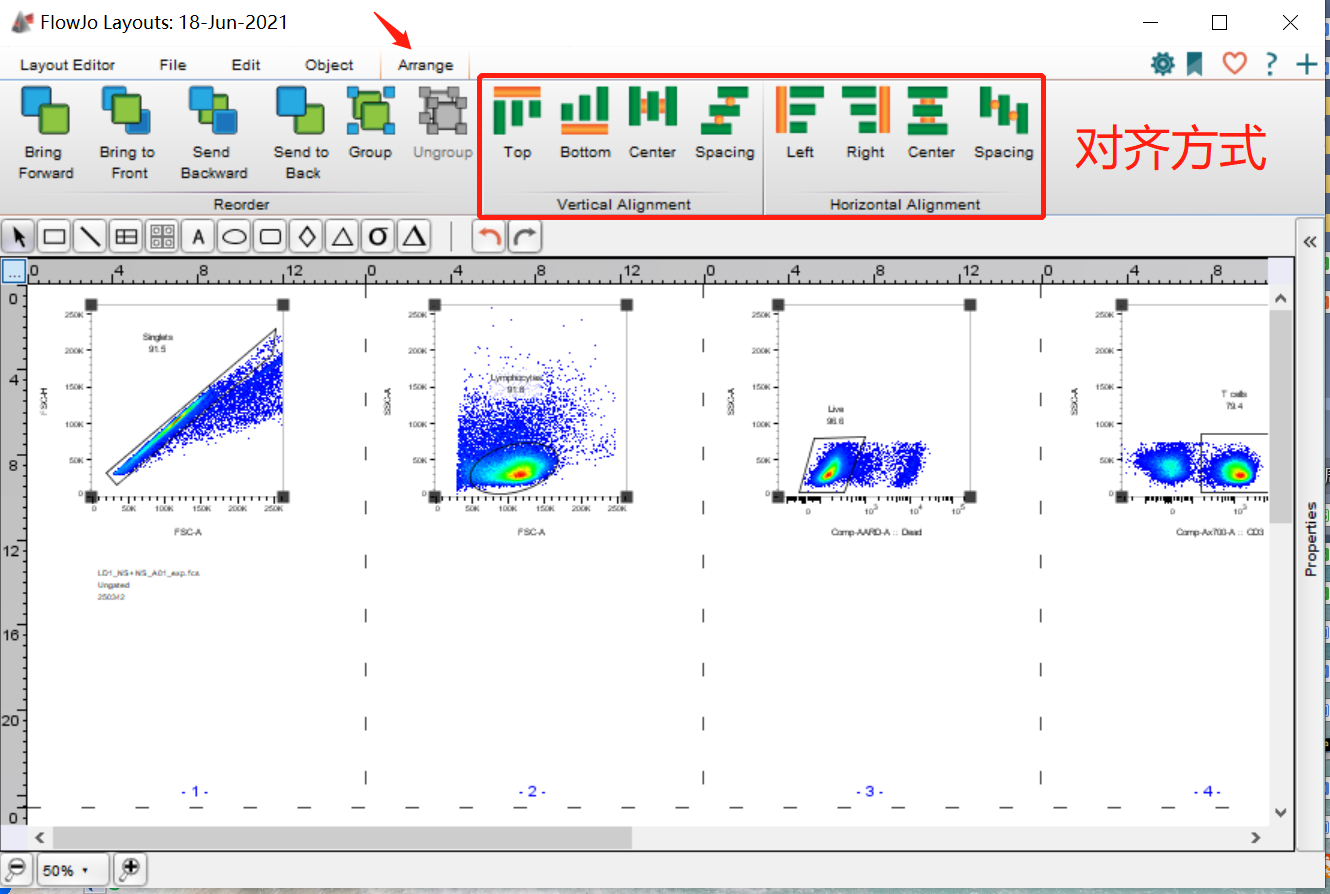
△点击放大图片
罗工:除了可以排版对齐,还可以设置排版尺寸,调好之后就可以进行批量处理了(create batch)。

△点击放大图片
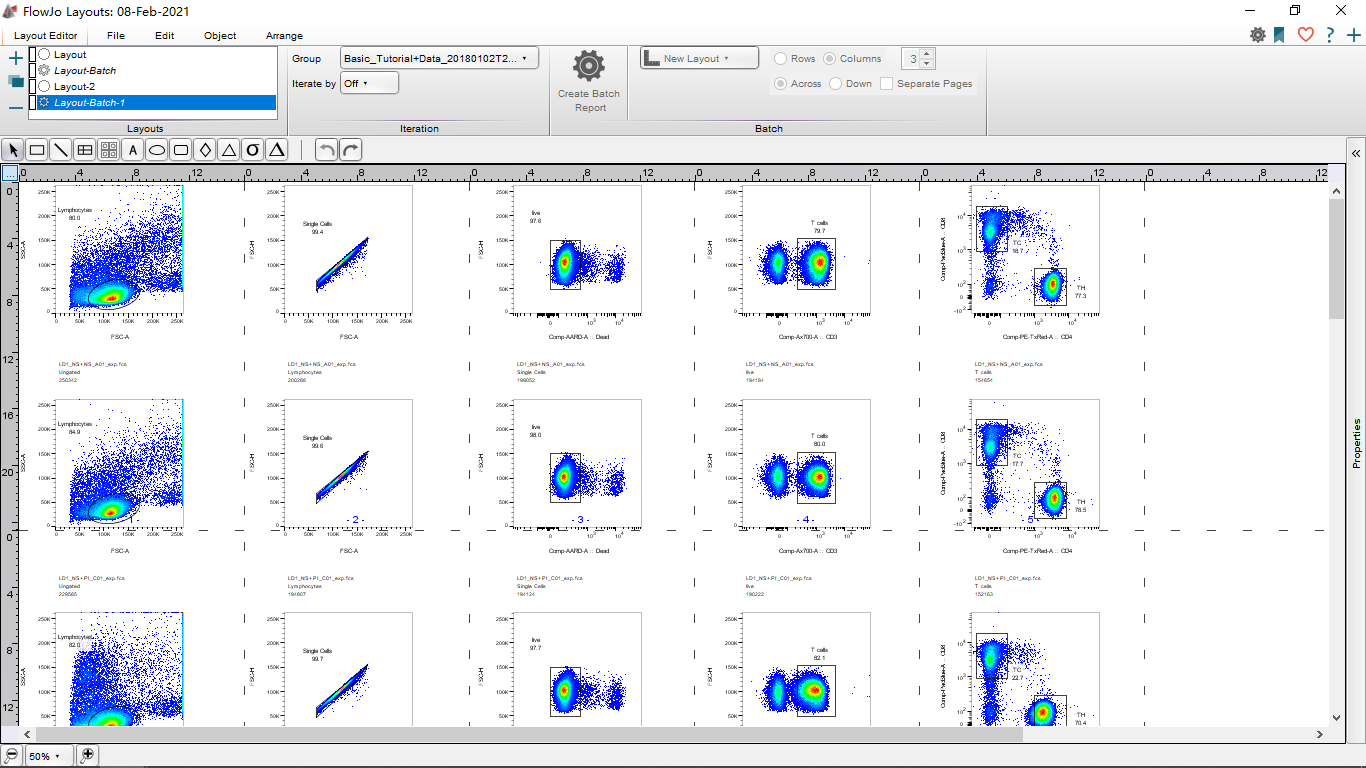
△点击放大图片
师弟:这样处理的确是事半功倍啊。
罗工:bingo!最后我们导出需要的文件类型就可以了。
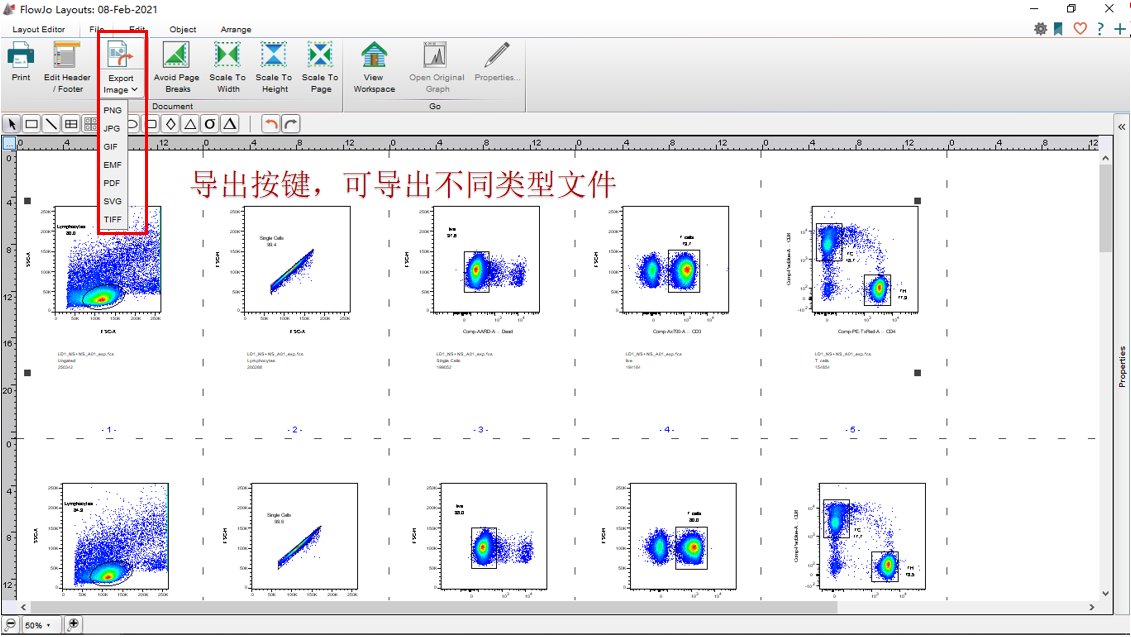
△点击放大图片
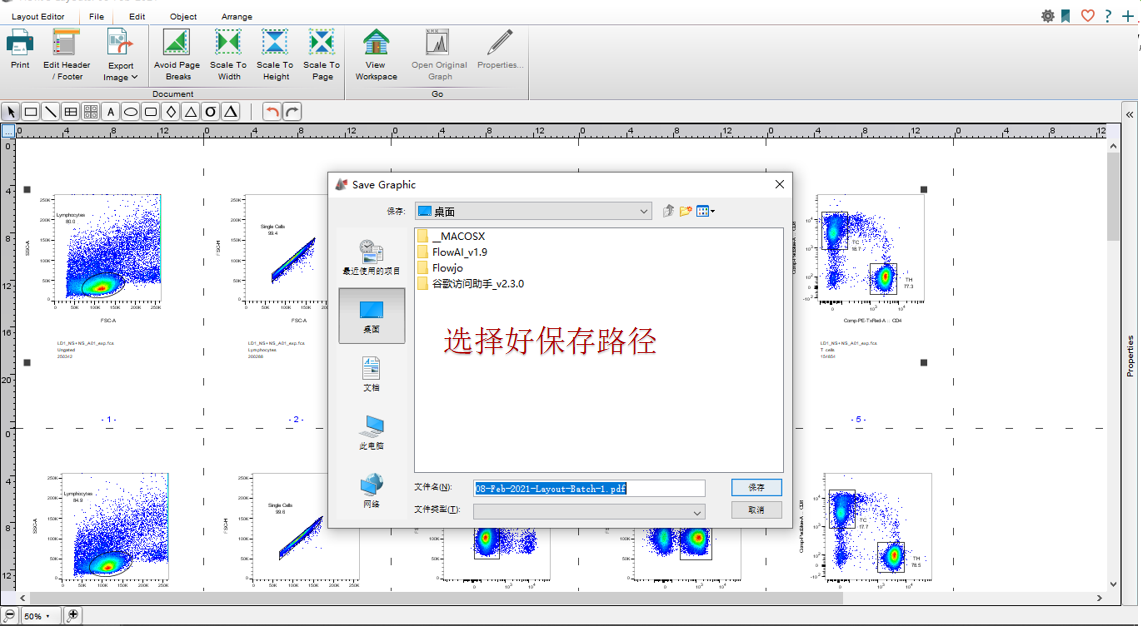
△点击放大图片
师弟:不亏是罗工。
2、话说flowjo上没有补偿矩阵还能调补偿么?(点击返回目录)
小伙伴们在面对自己繁多的通道调节补偿,运用flowjo 里自动调补一键解决补偿问题,是不是深得你心?
确实自动调补偿很方便,再不济也可以手动调,但是,有一天有位小伙伴给我留言说自己数据前的数据没有九宫格,是个空的方框 ,也没有任何补偿矩阵可以调节,大概是这个样子的
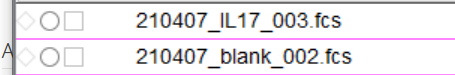
△点击放大图片
What?补偿矩阵呢?
怎么不是这样的

△点击放大图片
既然有疑问,罗工就算熬夜三天(并没)也是要找到解决方法的,look!
STEP1:打开flowjo , 将样本拖入flowjo,点开前面的空白格,出现空白的补偿矩阵。
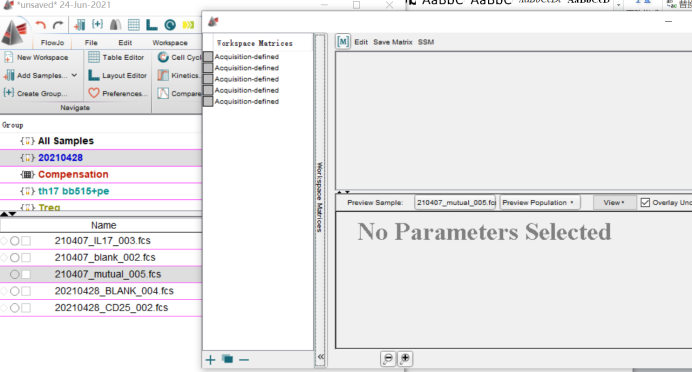
△点击放大图片
STEP2:进入空白补偿界面,选中最左下角的“+”---选择New Identity Matrix。
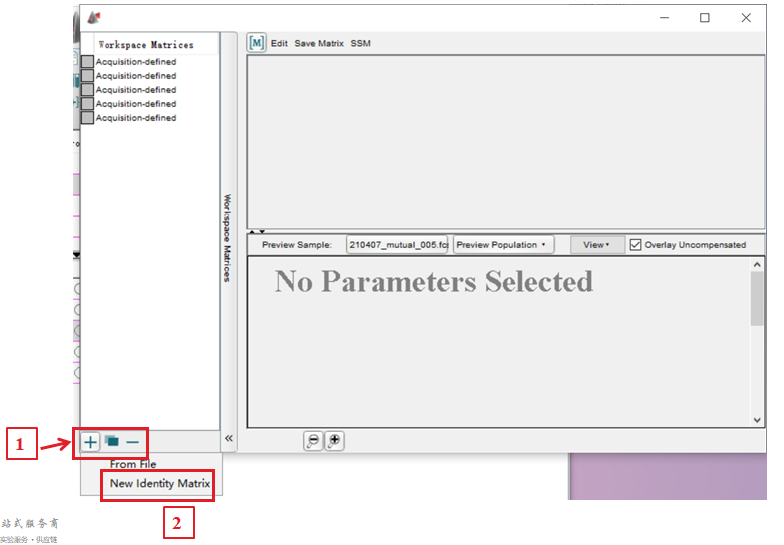
△点击放大图片
STEP3:弹出选择通道界面-选择你要调节补偿的通道。

△点击放大图片
STEP4:出现需要调节的通道界面,调节对应矩阵的补偿数字。

△点击放大图片
STEP5:补偿调节完成后,选择Save Marix---Flowjo Matrix File—选择文件的保存路径。

△点击放大图片

△点击放大图片
STEP 6:保存完成后再桌面找到保存的补偿数据,然后把数据拖入需要调节补偿的样本前的空白格中,操作如下图所示,前面的空白格变成有颜色的九宫格即补偿应用完毕。

△点击放大图片
STEP 7:打开数据界面,选择带补偿的通道即可。
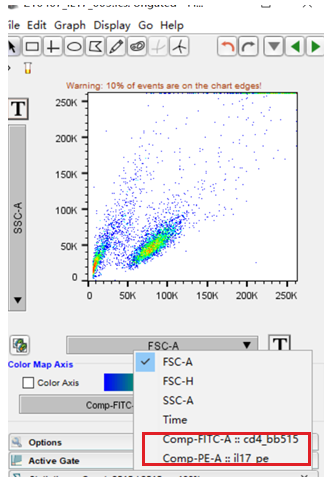
△点击放大图片
好了小伙伴们,添加空白补偿的方法学会了吗?本期的罗工秘籍,就和大家说到这里啦!更多流式小妙招持续更新中,记得持续关注呦!
3、上机时如何去除粘连体(点击返回目录)
在常规多参数流式中,单细胞经过流式仪激光检测区所产生的荧光信号被PMT接收,形成电信号脉冲,如下图所示:

△点击放大图片
每个电信号脉冲都有面积(A)高度(H)宽度(W),所以我们在流式细胞仪上可以看到每个通道都有FSC-A/H/W和SSC-A/H/W
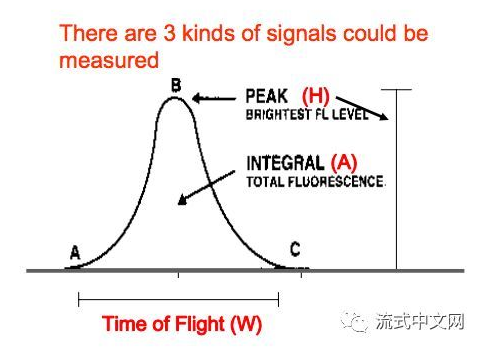
△点击放大图片
但是我们流式细胞仪采集或细胞分选单细胞数据时,可能会存在双细胞或多细胞复合物“污染”,这样的“污染”也就是我们俗称的粘连体,其通过激光检测口时,检测装置仍然认为它是一个信号。所以如果没有在分析时设门排除掉粘连体,那么就可能对结果造成误读。
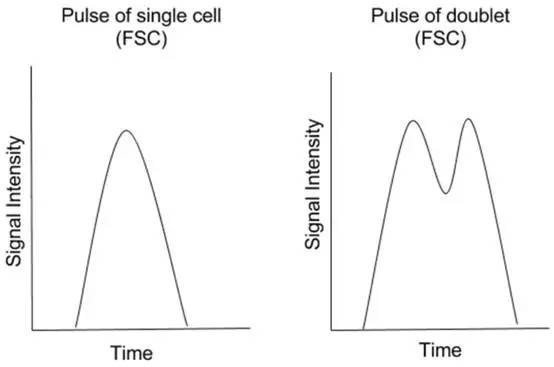
△点击放大图片
那我们怎么排除粘黏细胞呢?
双粘连体的脉冲基本上是两个单粒子脉冲的合并,通常脉冲高度相等,但是双粘连体的脉冲面积和宽度将大于单个粒子脉冲的面积和宽度,所以我们可以利用单个粒子和双粘连体信号的脉冲参数之间的差异来将两者彼此区分开。
根据这个变化,一般考虑以下两种方法来排除粘连体
1、A和W
由于双粘连体的脉冲宽度大于单个粒子脉冲的宽度,基本达到两倍的关系,所以我们也会使用FSC-A与FSC-w来去除黏连细胞;
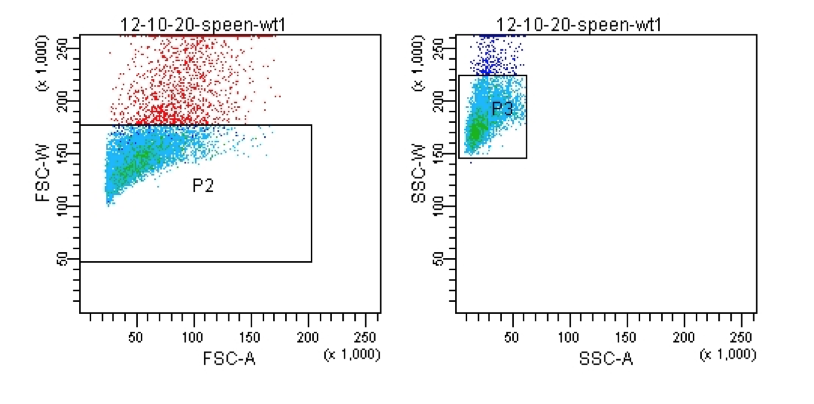
△点击放大图片
并且细胞周期实验时,用A和W去黏连会更彻底,一般推荐使用FL2-A和FL2-W。
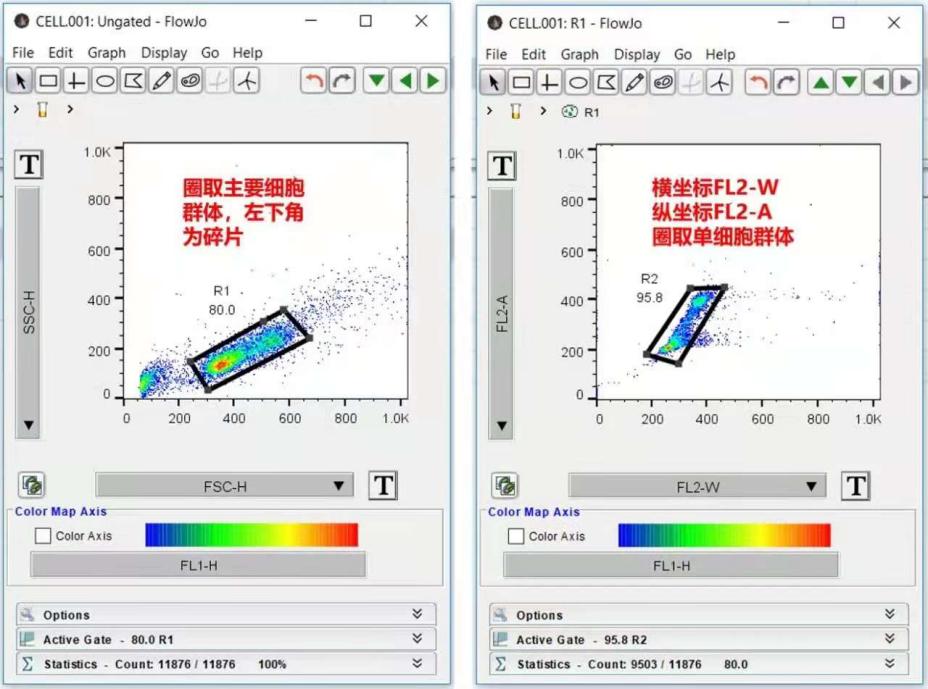
△点击放大图片
2、A和H
如前所述,正常二倍体和4倍体通过激光检测口时,H和A是成正比增大的,两者之间应该是呈45度角分布;而粘连体通过时,H不变,A增大,因此可通过FSC-A,FSC-H排除双粘连体。

△点击放大图片
但在实际结果中,A和H很少呈现45度角分布,总是小于45度,这是为什么呢?
一般说来,流式仪的激光束大多只有8um大小,而细胞很多都是大于8um的,他们通过激光束的时候就像下图所示:
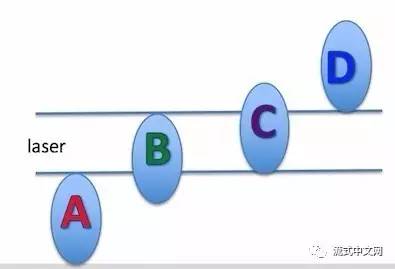
△点击放大图片
那这样在通过激光束,收集的电信号脉冲是什么样的呢?

△点击放大图片
如上图,这种电信号脉冲就无法反映真正的细胞大小,但A不一样,因为细胞是整个通过的,所以A永远能反映细胞完整大小,所以就出现了FSC-A>FSC-H的现象。
针对这种情况,我们可以通过在BD的仪器上(Diva软件)调节FSC-A缩放因子(FSC Area Scaling)改变。将该因子调小,就可以使两者接近1:1,在两者散点图上基本位于45度角上。

△点击放大图片
以上方法,任选其一,你就可完美排除掉粘连体,避免粘连造成的非特异性染色或假阳性影响。
时间短暂,本周的罗工秘籍到这里也就告一段落了。更多流式小妙招持续更新中,记得持续关注哟!
4、避免圈了个寂寞--流式聚类分析flowsom深度教学(点击返回目录)
熟悉流式的小伙伴都知道,流式细胞术实验本身倒是不难,但是难在数据分析上,不止一次有老师和罗工说:“罗工我怎么觉得流式的这个分析主观性很强啊,你看,我这圈门,稍微移动一下位置,或者说我换个圈法,是不是结果就不一样了?”
的确,我们在进行流式细胞术的数据分析时,圈门的方式和逻辑体现了我们对数据把控的准确性,以及对客观数据的理解性。所以罗工一直建议大家,在数据分析前一定要自己去搞清楚指标和指标的关系,再来按照一定的逻辑进行圈门才会获得比较客观严谨的结果。
首先我们要知道,通常展示的结果大部分的时候都只是流式结果的一小部分,比如我们对一个细胞进行双染,流式的结果信息就有4个,即这群细胞双染的双阳群1个,双阴群1个,单阳群2个;那3染呢?即三阳1个,三阴1个,双阳3个,单阳3个,共计8个;总的来说流式获得的亚群数其实就是2的n次方了,n=抗体数

△点击放大图片
如此一来,其实我们一个18色的染色panel,展示出的结果可能如下:
△点击放大图片
但是实际上信息量应该是多少呢?2的18次方=262144 Plots,所以很多时候我们只是把我们想展示的结果展示出来,如同主观的盲人摸象。
想要让主观的盲人摸象变得那么客观一些,我们能做的就是严谨的按照逻辑思路去进行数据的圈门分析,这样结果才会让人信服,例如前不久看到的流式中文网分享的一篇人外周血亚群分析的结果,其逻辑思路之严谨,让人拜服:
OMIP 077:14色方案区分所有主要的人白细胞亚群:
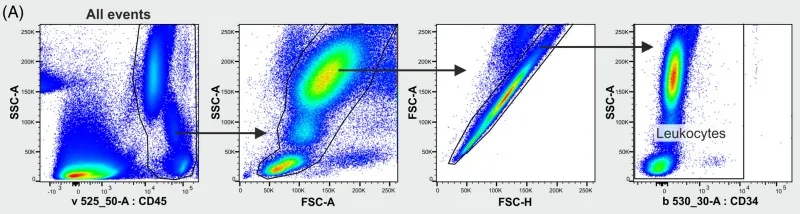
△点击放大图片
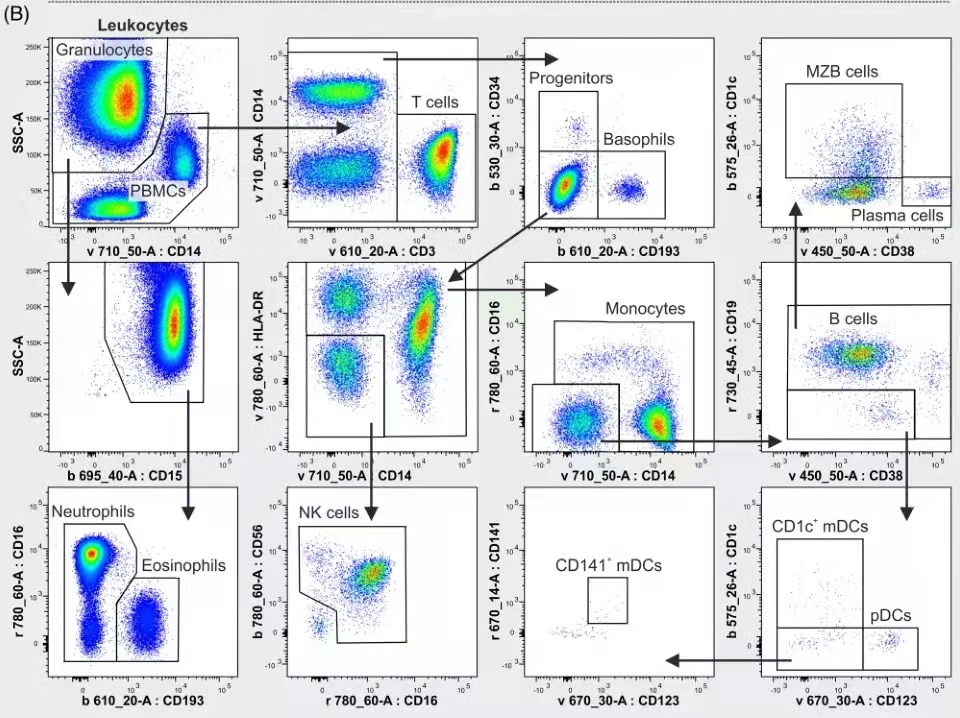
△点击放大图片
这时有的老师小伙伴可能就要说了,罗工,我是小白,要我分析的如同上面文章一样,表示:
其实,我们也可以利用flowjo这个软件的一些插件来辅助我们的数据分析,例如FLowsom这个插件,这是一款聚类分析的插件,利用这款插件,我们可以比较客观的对我们的数据进行全自动化的聚类,分群,从而得到一些亚群,为我们进行后续的数据分析圈门提供一定的思路和参考,甚至可以后续进行T-sne分析结合,直接作为我们最终的流式结果呈现出来。
首先,这款插件需要提前安装并运行R语言,具体的安装方式和R语言运行方式见如下链接:
https://www.flowjo.com/exchange/#/plugin/profile?id=7
当安装好后,在我们flowjo软件的Plugins下就能找到这个插件:

△点击放大图片
我们在分析圈门时,对自己拿不定注意的样本先行进行一些提纯排除,例如圈门排除掉碎片,粘连体,或者是圈取CD45+,然后在提纯门内直接运行flowsom即可:
△点击放大图片
运行后会弹出flowsom的界面如下:

△点击放大图片
其中比较重要的3个选项要特别和大家说明:
1. 选择待分析的通道,一般都是全选,但是如果gate过的门可以不选,比如在CD45+里分析,就可以这里不选CD45的通道;
2. 选择系统分析的群的数量,默认是8群,但最好提前自己预估一下,看看自己的指标能分多少群出来,原理是还是可以分2的n次方群;我一般会在自己的预估群后多加3-5个群,例如分析免疫淋巴6项的TBNK,CD4/CD8,预估一般就是6群,但是通常会加到10群,这样得到的结果更准确;
3. 生产的图像,这里可以选择的很多,我们默认树状图给大家展示,大家也可以自行去试试。
我们还是以一个TBNK单核的染色为案例来进行分析:
选择主体细胞后进行flowsom,选择聚类为10群:

△点击放大图片
计算后系统得到了pop0-pop9 一共10群,这里要说的pop0就等于是全阴性群哈,也就是正式的阳性群一共是9群,但是我们看到9群里有的细胞是非常少的,所以可能就不是我们想要的目的细胞了。
我们把flowsom的结果拖动到layout中查看,结果如下:
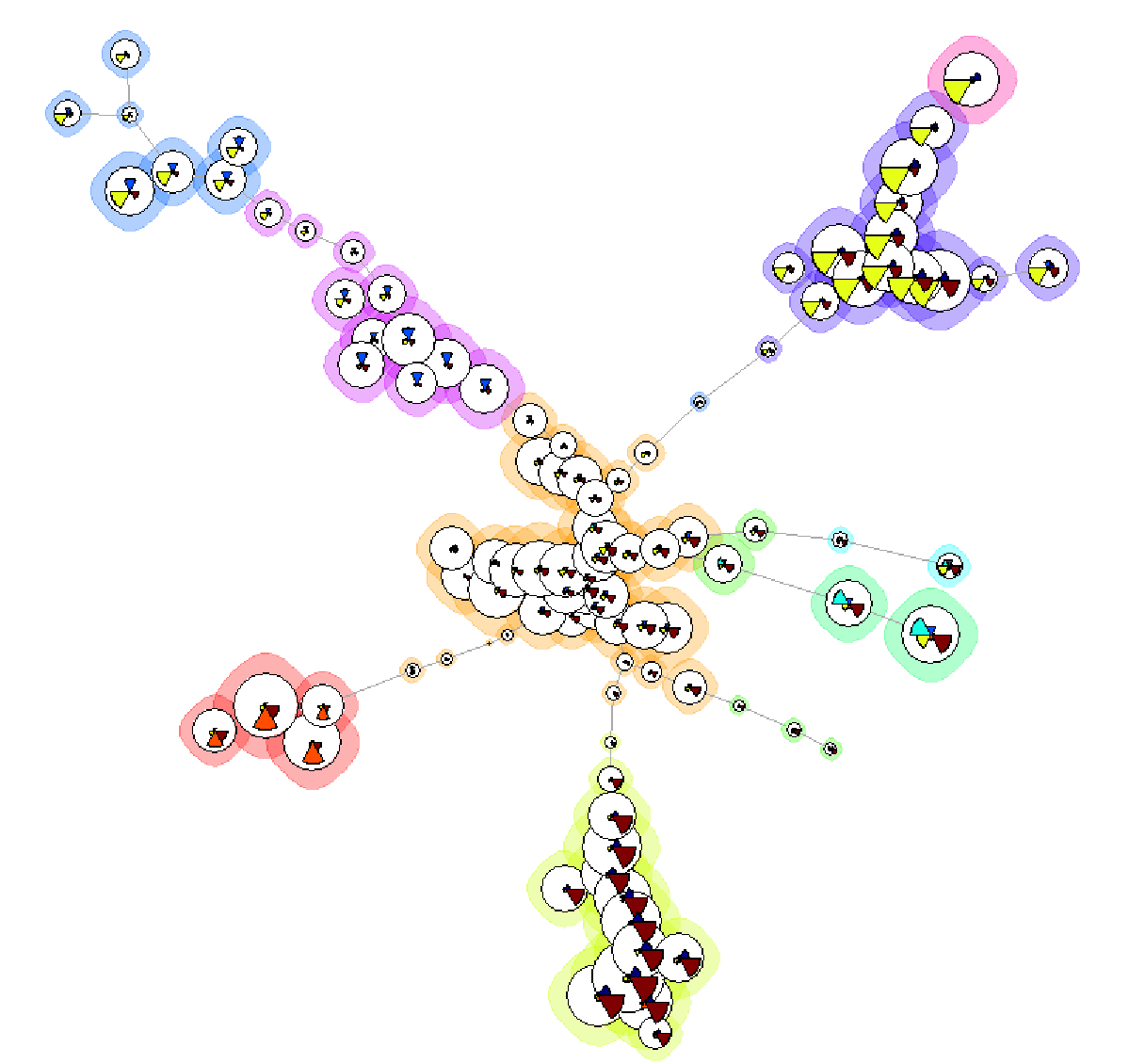
△点击放大图片
排除掉pop.0,也就是中间的细胞群后,剩余的细胞群大体是分成了如下圈红的6群:

△点击放大图片
也就是我们值得分析的总的来说就是这6群细胞,进一步把每个pop打开后观察,得到这6群细胞其实就是CD4T,CD8T,NK,NKT,B cell,mono cell,刚刚好6群,不多不少。
实际上我们后续还可以借助一些其他的插件来可视化分析这些亚群的抗原表达情况,从而更好的分析实验结果:

△点击放大图片
例如cluster这个插件,就可以很好的看到我们得到的亚群抗原表的情况了,从而明确知道是哪些亚群,进一步为后续的主观分析或者结合T-sne进行降维分析打下基础。
总的来说,flowsom就是一款可以自动进行分析来获得比客观细胞亚群的插件,可以利用flowsom来进行稀少or不易观察细胞亚群的发现,也可以用它来辅助圈门,避免圈门不当造成的数据不准确,怎么样,这周的罗工秘籍,你学废了吗?
5、仪器也需要被关怀(点击返回目录)
很多时候我们做实验都是都是星夜兼程,机器也总是陪伴我们;疲惫的状态会让我们难以集中注意力专注做事,需要好好休息来调整状态,那机器呢?当我们相同样本几乎一样处理的数据在同一套电压补偿下位置偏差很大时或者细胞状态还行上机却有非常多的背景噪音,那说明我们“疲倦”的机器也需要好好“休息”来调整状态啦。

(不稳定的机器)
△点击放大图片
(很脏的机器)
△点击放大图片
就像一辆高速奔驰的汽车,得确保每个零件部位都正常的运转,流式仪也是这样精密的机器,需要我们关注到他的每个零件;
从液流系统说起,比较常见的的问题就是液流管路清洁不彻底和鞘液过滤芯脏了导致堵住,我们先说滤芯,作为外界液体进入机器的第一道闸门是要定期检查它的状态的,当出现背景信号增多、荧光信号的灵敏度下降,以及持续性的管路堵塞时,就得检查滤芯和相连的管路的状态并酌情替换了;这一步呢,建议按照仪器的使用频率决定。
当我们使用比较多的核酸染料(如PI等)做周期检测或者细胞活力鉴定时,如果清洁的不够彻底或者做质控时发现荧光信号的敏感度下降时,我们就得考虑如何彻底的来清洁仪器的液流管道了;最简单的可以运行机器自带的清洗程序来清洗,正常机器自带的Clean液会填充整个液流系统并清洗。很多情况下清洗程序都能很大程度的改善管道不清洁的问题。有些型号的机型上样针有快拆结构,我们也可以拆下来做超声来一并排除上样口清洁不当导致的堵塞问题;
但PI如果残留了,那就不是好清洁的,除了跑Clean液外还值得使用的小窍门就包括:
1. 跑次氯酸钠溶液1. 跑次氯酸钠溶液
先用1%的次氯酸钠溶液浸泡上样针后高速跑5min,然后换回超纯水旁位跑3min,再正位高速跑8min;(旁位即将支撑架打到一边,正位即将支撑架复位,总体跑水的时间必须长长过跑次氯酸钠溶液)
2. DNA结合消除
PI非常容易与DNA相结合,也可以用放置了很长时间的外周血样本来做清洁;因为长时间放置细胞基本都已经破碎,DNA就释放了出来,就可以利用这些DNA来结合掉残留的PI染料啦;
除了硬件上的维护,我们也可以借助机器软件的CS&T功能:仪器性能状态自动监控可据每日仪器状态自动调整实验的电压设置,PMT 灵敏度及仪器在工作中可能产生其它的一些变化,提高仪器设置的精确性,降低不一致设置造成的检测误差,保证不同时间实验数据的一致性。同时可以追踪仪器性能,帮助用户了解仪器性能,以及在使用过程中的仪器状态的变化;通常这个步骤分为两步:Baseline的设置和检查Performance基线的校准有助于我们评估仪器当前各种性能参数,而performance就能更好的降低不一致设置造成的误差来达到提高机器设置的精确性。
篇幅有限便不介绍具体质控的操作细则啦,可以关注我们的公众号和B站号更直观的看教学视频;当然,最核心的要点还是养成好的上机习惯和定时定期的做好仪器的日常维护。
5、流式数据分析后的保存方法知几何?(点击返回目录)
很多老师在使用flowjo这款软件时,碰到的不止是分析的问题,对于数据的保存也存在一定的困惑,今天就专门来给大家讲讲flowjo的数据保存。
首先很多时候我们会碰到一种情况:
当flowjo打开之前分析好的数据的时候,发现情况不对了,怎么好不容易分析的数据不见了呢?
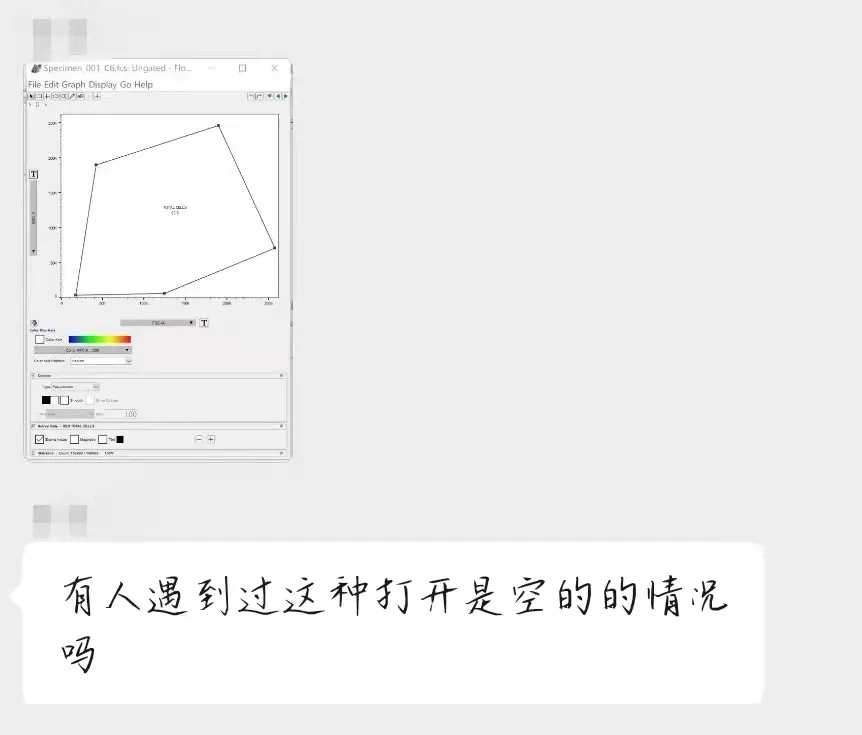
△点击放大图片
flowjo的默认保存格式为wsp格式。注意,这是一种纯模板文件,也就是不包含你流式的原始数据的,所以,一旦数据的保存路径发生改变,或者是你单独只拷贝了wsp到一台新电脑上,你就会发现你打开wsp之后,就是一个空的圈门,没有任何细胞群了。
如何应对wsp的文件移动后数据丢失的情况呢?
很简单,第一步:打开wsp文件,你会发现这里出现一个红叉叉,就是提示flowjo软件无法关联FCS数据。
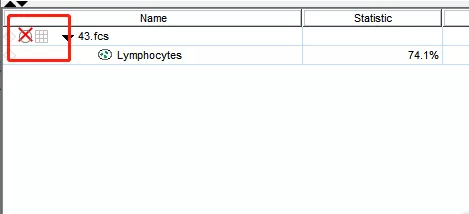
△点击放大图片
第二步:关联数据
方式一:直接找到源文件拖拽进去即可
方式二:右键数据名
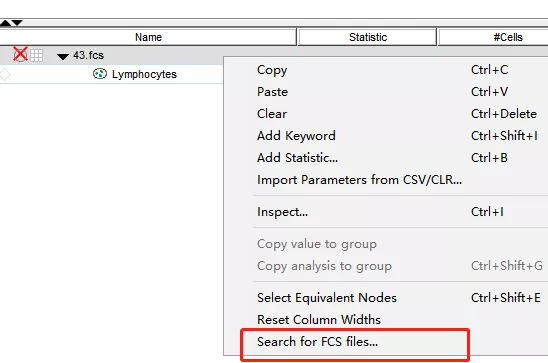
△点击放大图片
选择Search for FCS files...,根据提示找到移动位置后的FCS文件,打开关联即可。
第三步:数据找回,继续分析,问题成功解决。
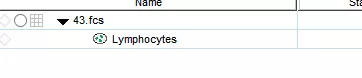
△点击放大图片
当然,在电脑内存允许的情况下,我们可以把flowjo分析好的数据保存为带有原始数据的格式文件,即Acs格式文件,如图:
WSP只能保存逻辑条件,而这种格式可以将数据以及逻辑整体一起保存下来,不管后续原始数据怎么移动位置,都不受影响,但是这种格式往往保存后的文件也比较大,大家可以根据实际情况进行选择。
再一个就是我们分析好的数据如何导出为图像呢?我们一般会在layout模块中编辑我们的流式结果图像,同样的,layout也支持我们将图像导出,具体导出的界面在如下处:

△点击放大图片
需要注意的是虽然layout中可以导出多种格式的图像输出,但是对于我们来说如果要保证文件的高质量,还是优先TIFF格式 或者是Pdf格式。另外pdf格式也需要注意页码的问题,如果不注意可能会导致同一张图被分割为2页的情况出现:
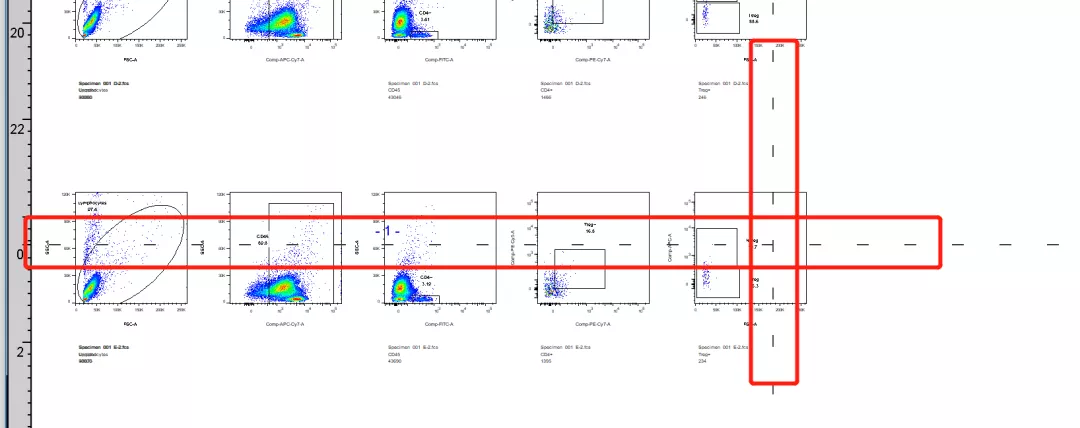
△点击放大图片
如上虚线即为页码分界,一定要注意。
最后,对于流式的数据统计分析,我们也一般有2种导出方式,第一就是直接在flowjo主界面中选择另存为execl:
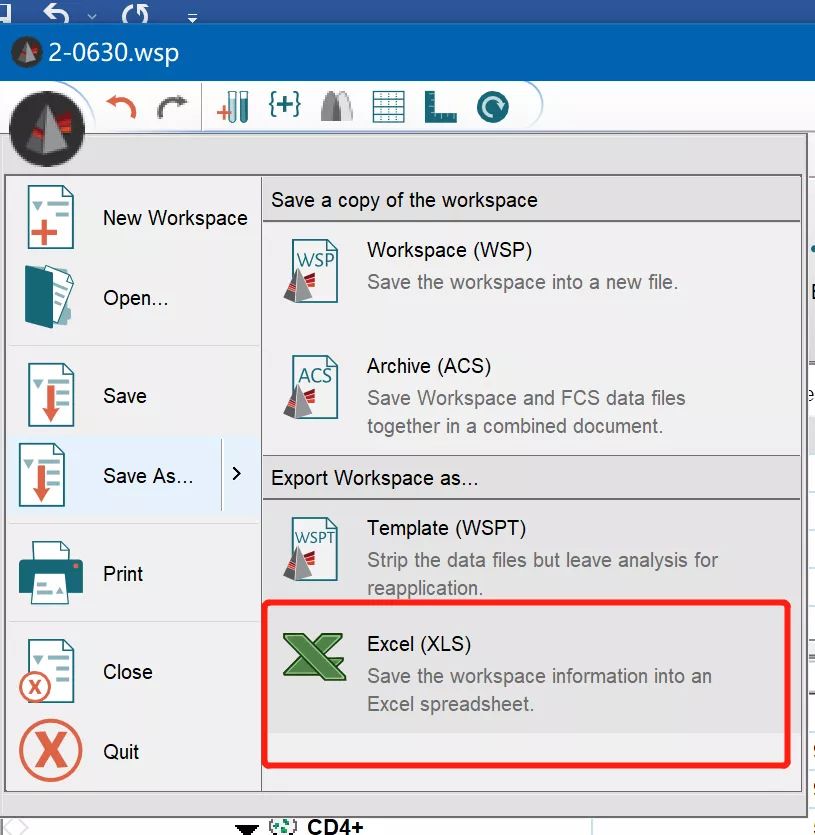
△点击放大图片
此时所有的逻辑关系和比例情况都会导出。
如我们只想导出一部分特定亚群,可以选择使用flowjo的table editor:

△点击放大图片
拖入想要分析的逻辑关系后,点击create table导出,也可以获得最终的数据分析列表如下:
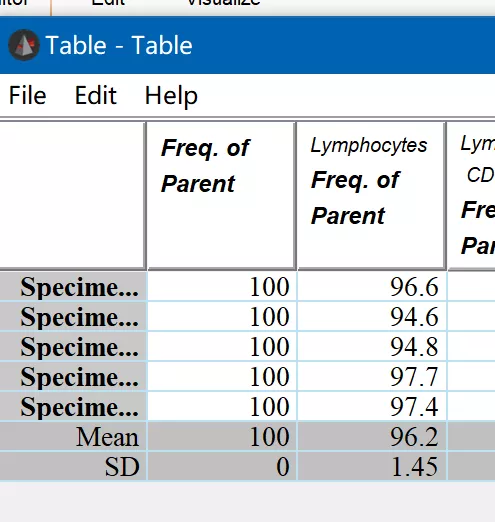
△点击放大图片
如上,3类数据保存方式,可以让我们使用flowjo的时候更加好的得到想要的高质量数据,并且避免数据丢失,数据质量不高等情况情况出现,希望能够帮助到大家。