- 1、如何用Flowjo同时展示图表,便于汇报整理
- 2、流式大数据t-SNE和UMAP的结果图看不懂?不会用?
- 3、新版FlowJo Portal登录和免费申请试用介绍
- 4、为什么流式图中的阴性群后面还有个阴性群的拖尾?
- 5、Flowjo——Backgating功能的巧用
1、如何用Flowjo同时展示图表,便于汇报整理(点击返回目录)
前面我们已经介绍了Flowjo里面Layout Editor(图片编辑)和Table Editor(数据编辑)的功能:
【罗工流式秘籍33】宝,你看今天的图;什么图?flowjo批量导出的流式图
【罗工流式秘籍38】流式图“七十二变”-graph definition
有的老师想利用Flowjo的结果导出功能,直接进行实验汇报和制作实验报告。那么就要知道如何在Flowjo中将进行这两个强大的功能进行快速结合,本期小编就给有类似需求的老师进行了整理,如下两种方式均可实现:
方法一:使用Layout Editor里自带的数据统计表格功能
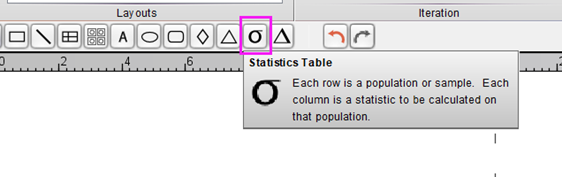
△点击放大图片
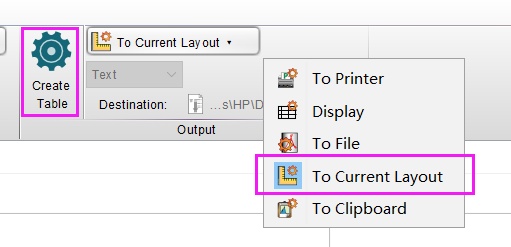
1.在编辑好图片后,点击这个统计功能,在Layout界面里,选中表格想摆放的位置,单击确认;
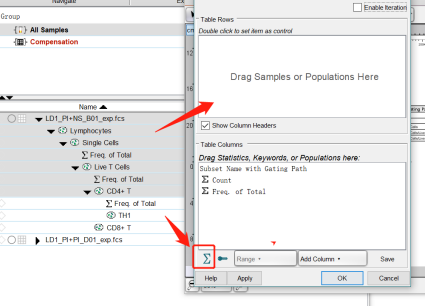
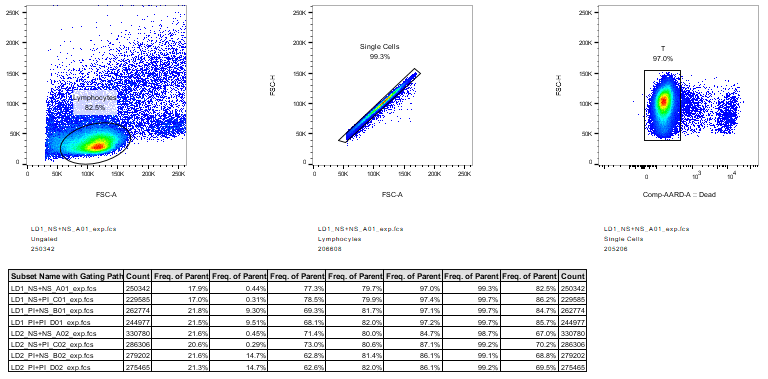
2.从主界面中,将想要展示的样本及圈门数据拉进弹出的Statisic Table界面,点击OK即可,还可以在下方调整表格想展示的数据或者计算函数;
3.选中其中一栏长按,还能拖动调整样本排布顺序。

△点击放大图片
△点击放大图片
△点击放大图片
方法二:使用Table Editor里的保存位置选择功能
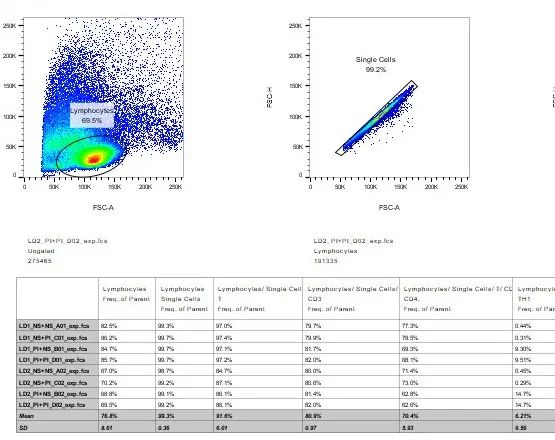
1.按照之前的教学软文,将待展示的逻辑门,拉进Table Editor的界面中,进行编辑和修饰;
2.确认编辑完后,调整一下保存位置,再点击批处理即可。
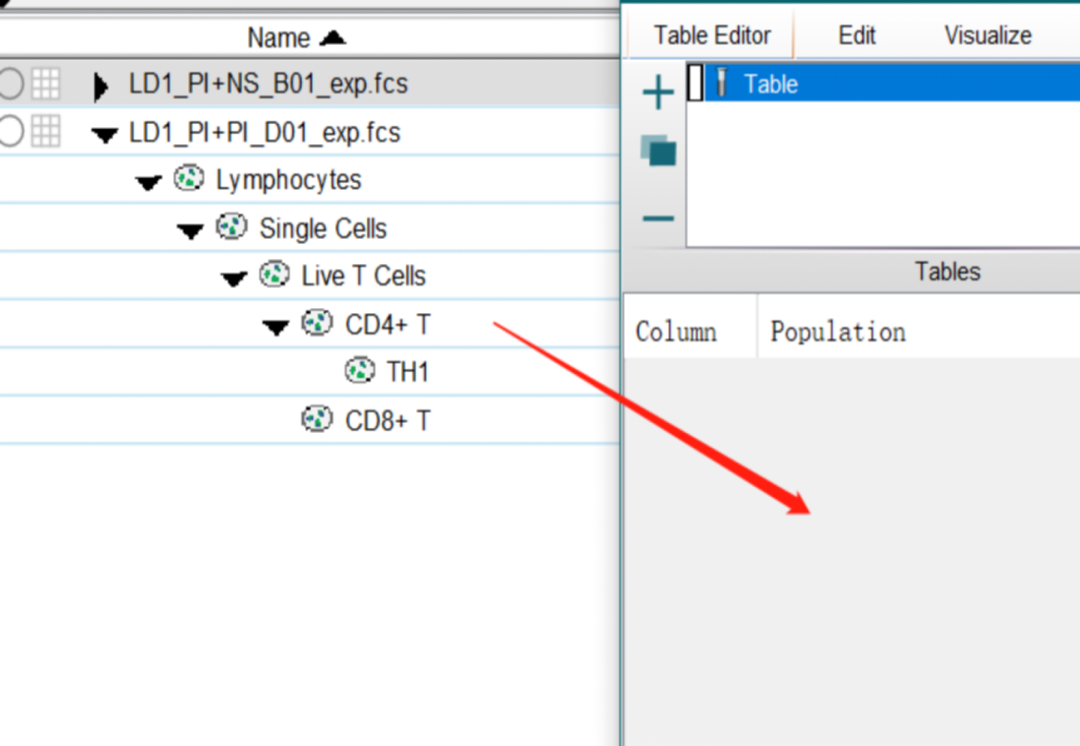
△点击放大图片
△点击放大图片
△点击放大图片
PS:需要注意的是,这两种方法导出的表格都是不能调整字体和字号的喔!
2、流式大数据t-SNE和UMAP的结果图看不懂?不会用?(点击返回目录)
导言
在如今的大数据时代,大家不难发现,某宝某音通过海量的手机日常浏览数据,从中进行分析运算,有针对性发现我们的爱好与需求,勾引大家买买买。
而流式染色技术也早已进入多色时代,随着染色指标的增加,我们获得的结果信息也是成指数级别的增长。如何全方位的快速的挖掘和展示自己结果中的有价值信息,就是依赖流式的大数据分析,常规用的大数据算法就是t-SNE和UMAP。
那么大数据分析会给我们看似普通的流式数据带来哪些优势呢?下面就给大家聊一聊。
很多老师表示大数据分析的技术很高端,结果图也很好看,高分文章也基本都在用,但就是看不懂,或不知道自己如何去寻找自己结果中的隐藏信息,其实并不难哈。
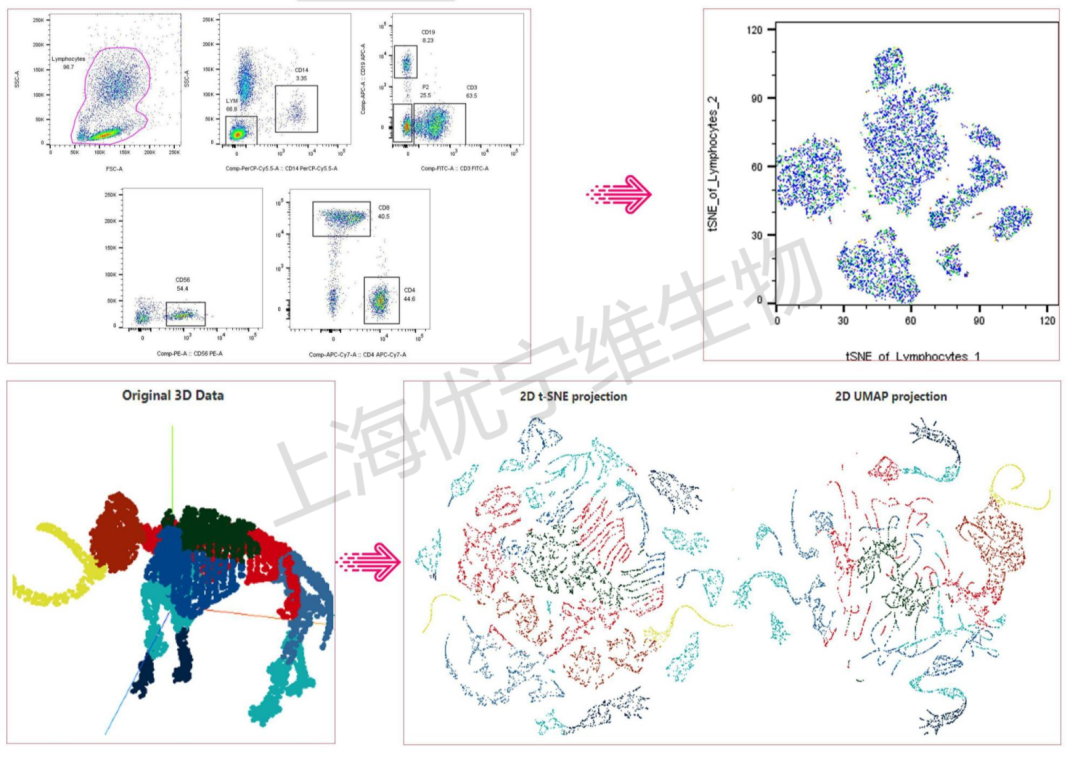
我们常规的一个多免疫亚群的分析结果,是通过逐级圈门圈出来目的细胞分群的,当使用t-SNE/UMAP等大数据分析之后呢,结果图就变为直接平铺二维模式展示所有的群落。
△点击放大图片
图上主要获得两个基础信息:
①群落的大小代表这群细胞占总细胞的百分比的多少;
②细胞和细胞之间,群落和群落之间,是有可能存在一定的关联性的。往往挨得越近的群落,所含有的抗原表位也是越接近的。
那我们怎么去用T-sne图展示结果呢?这里介绍3个常见用法:
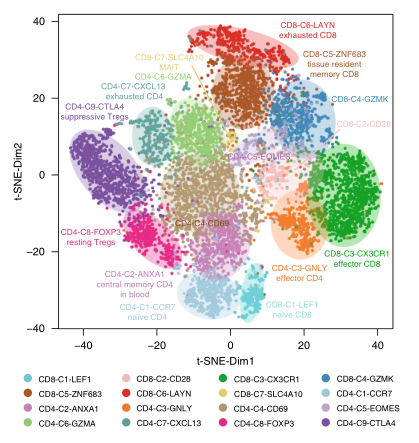
①单个样本,多个指标的展示,一张T-sne图说明各细胞群体表达的多少及彼此的关系。
△点击放大图片
②多个样本单指标,或者单门内的降维分析图对比,寻找样本间差异。
案例一:如下图,实现了比对每一个病人自己PBMC和外周血2种不同检测样本类型中的CD161和MR1-Tet之间的表达关系分析。两者关系越接近的时候,它的T-sne图更融合。差异大的时候,T-sne图呢,则是越分开的。
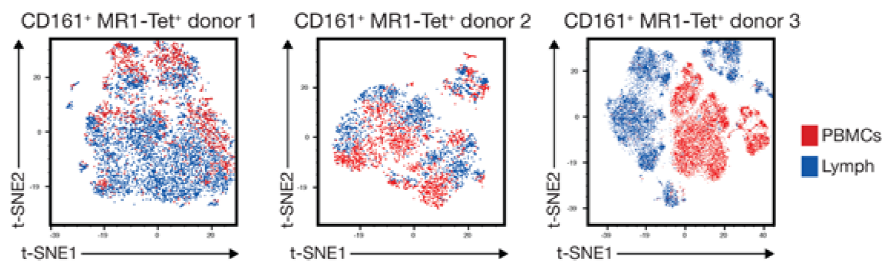
△点击放大图片
案例二:如下图,不同病程的病人表达间的差异,就可以通过将不同病程的病人的检测数据整合到一起后,用T-sne图展示,这样差异也会更明显。BD和MC样本图形近似,AM和AS组图形近似,细胞占比及组成会更近似。
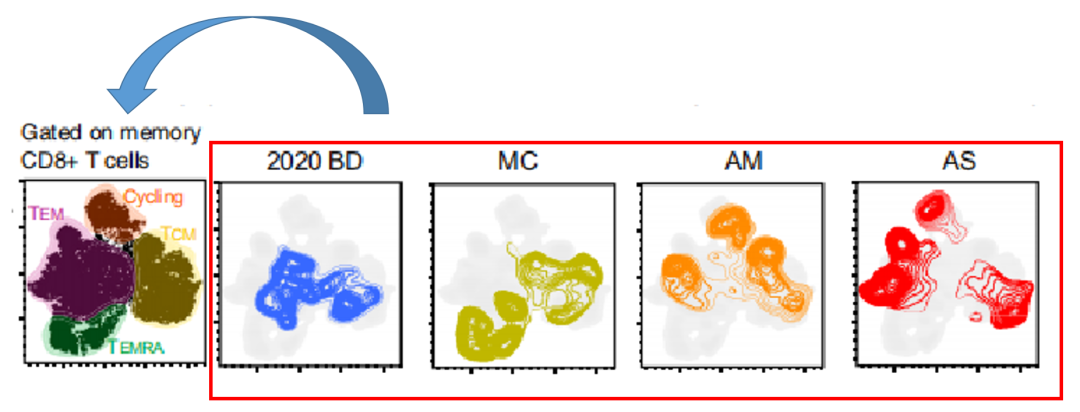
△点击放大图片
③多样本多指标的分析
刚刚这个T-sne图,就可以看出不同样本之间,它们的聚类间距离有近有远,这说明它这里可能包含了一些相似和显著不同的biomarker,所以我们可以在这个基础上,再去分析,看到底是哪些指标,出现了相似性,或者离群值。如下图显示,AM和AS组,就高表达PD-1/CD38/KI67/HLA-DR。
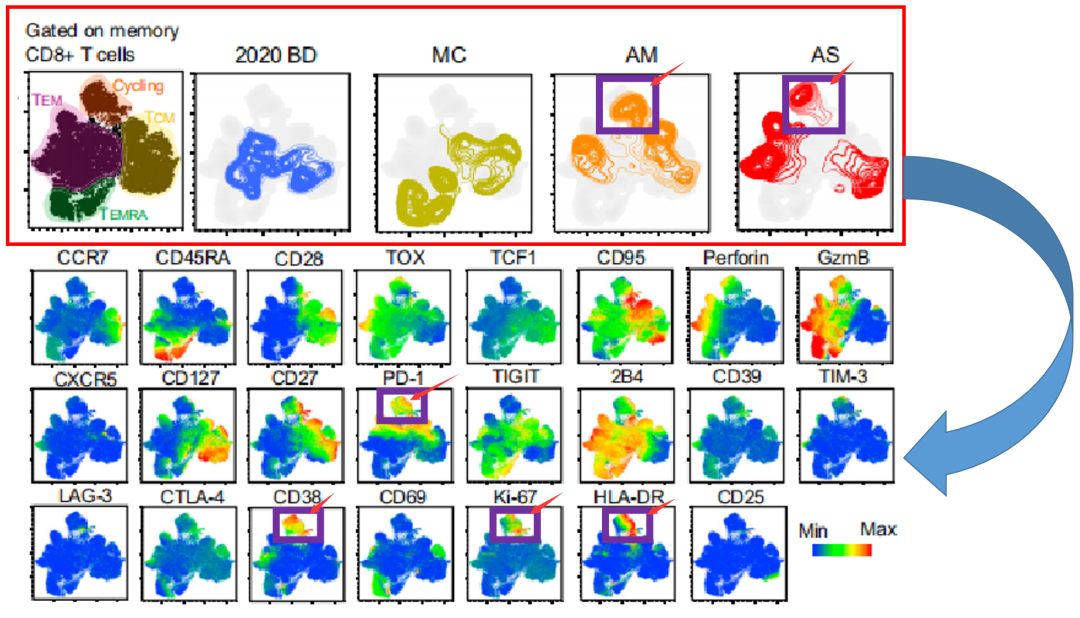
△点击放大图片
大数据图,会比用传统的柱状分析图展示结果更好更直观,它能够更好的在文章中增加我们每张图片的信息量,从而更容易获得杂志审稿人的青睐哦~
你知道怎么理解和运用流式大数据分析了么?
3、新版FlowJo Portal登录和免费申请试用介绍(点击返回目录)
问:罗工,听说BD出了新版的FlowJo,好像可以1个账号4台电脑使用呢,这是真的吗?
答:是真的哦,新版的FlowJo,构建了一个新的FlowJo Portal的线上管理平台,它使用账号+密码形式登录,1个账号可最多激活4台不同电脑,并兼容windows及Mac版本,摆脱了传统序列号绑定电脑的方式,可以让大家随时随地分析数据。
问:哇,厉害!我们课题组非常需要,可以教教我们怎么注册登录嘛?
答:首先,进入FlowJo Portal中国官网注册账号:https://flowjo.bectondickinson.cn/
△点击放大图片
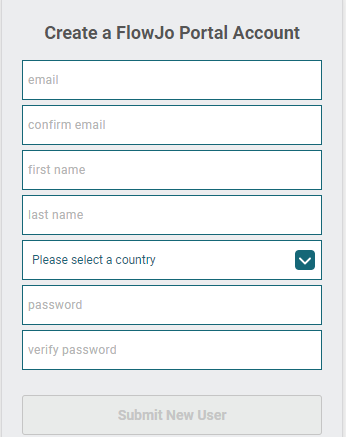
△点击放大图片
然后,你会收到主题为Welcome to FlowJo Portal!的邮件(见下图),表示账号注册成功。
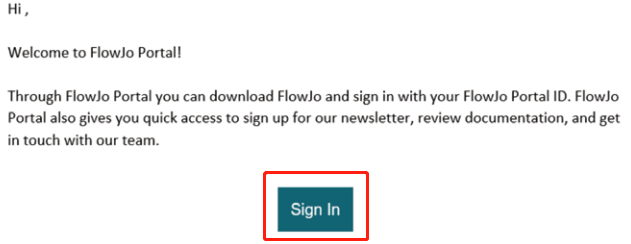
△点击放大图片
点击Sign In,将成功注册邮箱地址邮件提交给BD申请账号激活。
账号被激活后,注册邮箱将自动收到主题为:You have an invitation to FlowJo! 的邮件,请务必点击Accept Invitation按钮!表示账号完成激活。
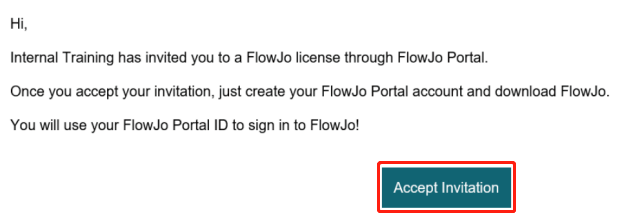
△点击放大图片
账号注册成功后即可登陆https://flowjo.bectondickinson.cn/ 进入门户主界面,如下所示:
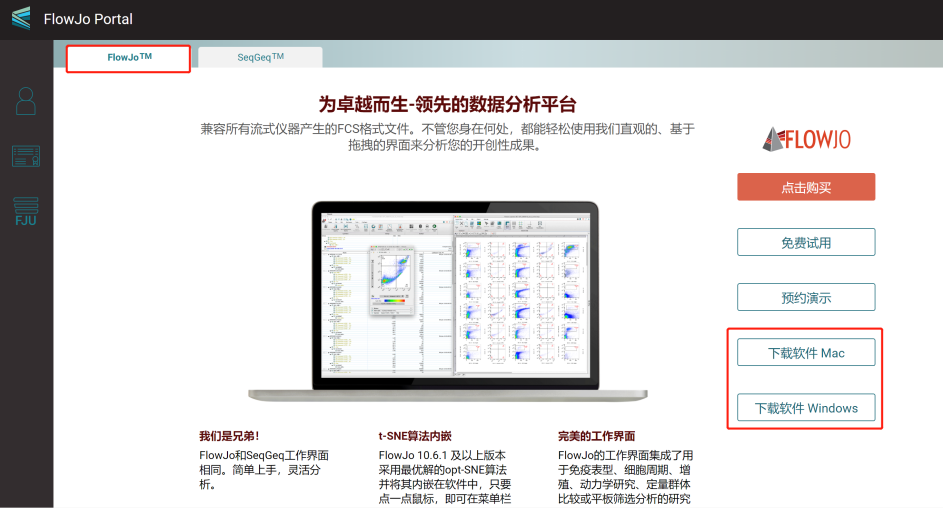
注意:一定要在中国门户下载CN版FlowJo软件。
安装好了FlowJo,接下来就教大家如何登录:
1. 第一次安装的小伙伴们参考下列方式
1) 一旦您安装了最新版本的FlowJo,请同意许可条款,选择Use your FlowJo Portal account(使用您的FlowJo Portal账户),然后点击完成。
输入您的FlowJo Portal ID和密码,准备好开始使用FlowJo!
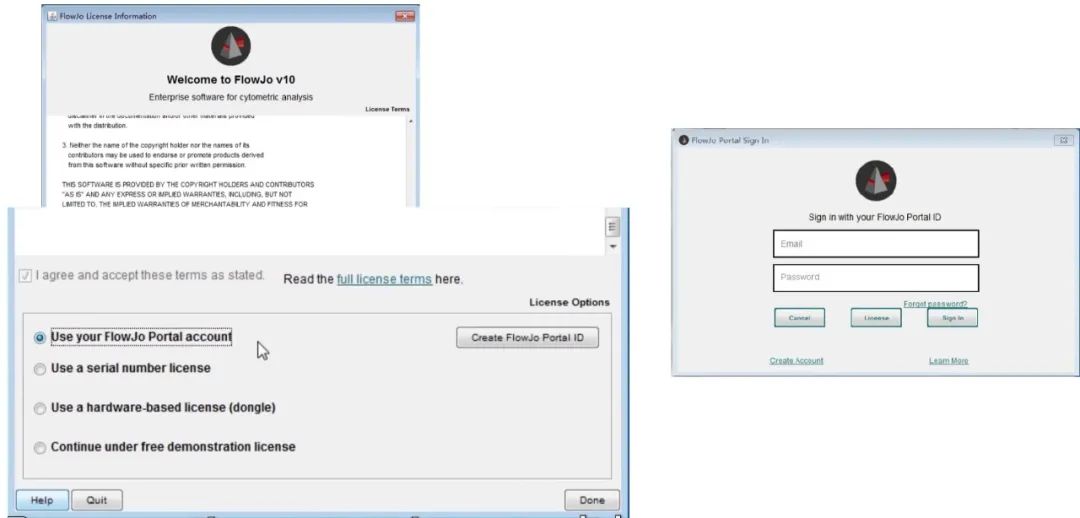
△点击放大图片
2. 已经安装了最新版本的FlowJo用户可以通过偏好设置登录FlowJo Portal!
1)在桌面上打开FlowJo,点击右上角的Preferences(偏好设置)按钮。
2)单击偏好设置窗口右上角的License(许可)按钮。
3)如果Serial Number(序列号)字段中存在序列号,请删除该序列号。
4)点击许可偏好设置右上角的FlowJo Portal Sign In(FlowJo Portal登录)按钮。
5)输入您的FlowJo Portal ID和密码,准备好开始使用FlowJo!
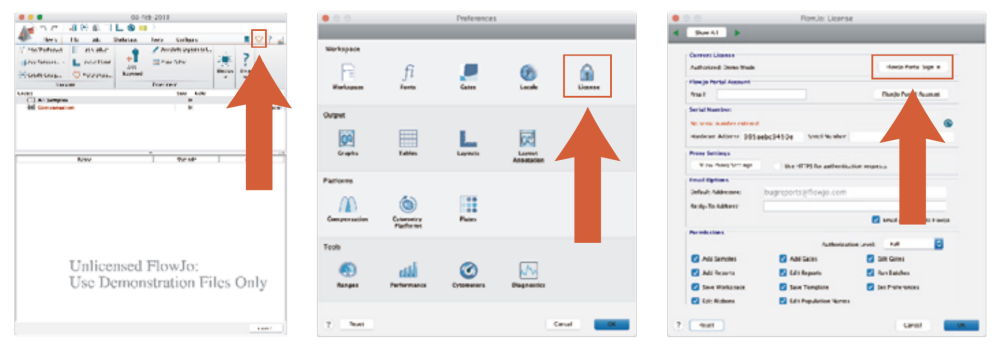
△点击放大图片
问:我们最近又急需分析一批数据,你们有没有可以申请试用呢?
答:当然,FlowJo是可以免费申请30天试用的,下面我就告诉大家如何去申请!
首先还是需要登陆https://flowjo.bectondickinson.cn/ 进入门户主界面,下载好Flowjo软件,并点击免费试用。
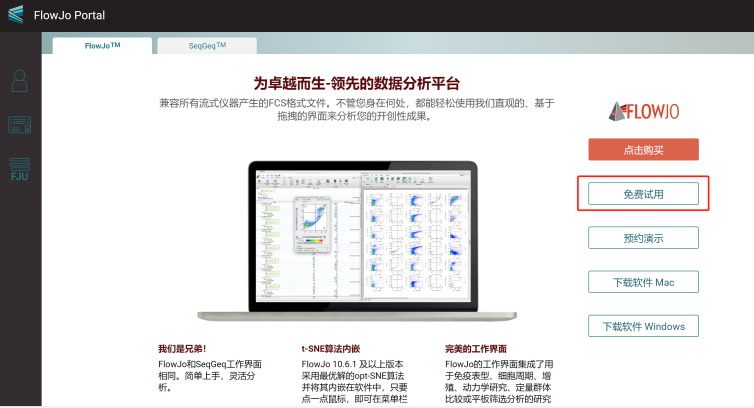
△点击放大图片
打开下载好的FlowJo软件,查找电脑HWA号:
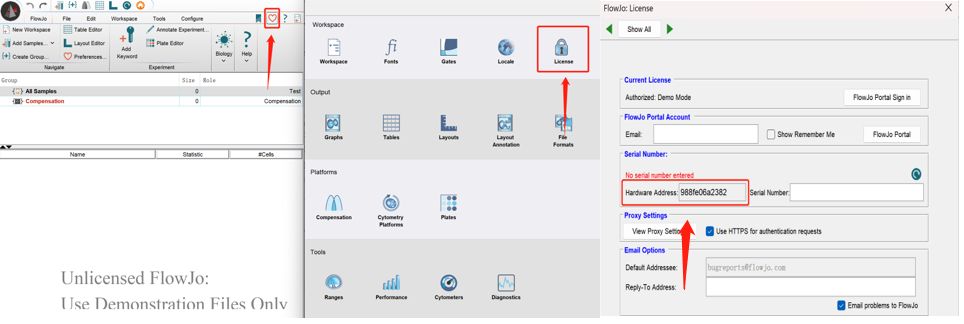
△点击放大图片
根据要求填写相关信息,并粘贴已复制的Hardware Address,提交,邮件获取正版序列号:
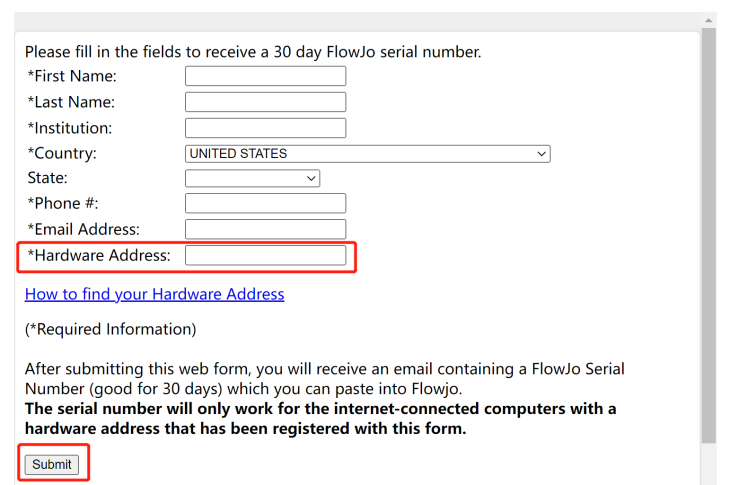
△点击放大图片
Serial Number会通过邮件的方式发送,将它填入下图位置,等待界面出现“Drag Samples Here”,重启,便可使用啦!
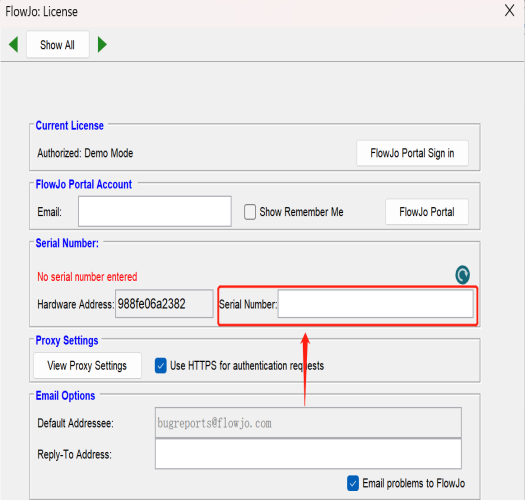
△点击放大图片
△点击放大图片
下面附加下B站解说视频链接:
4、为什么流式图中的阴性群后面还有个阴性群的拖尾?(点击返回目录)
Q:罗工,我最近分析数据遇上了点困惑,特来求教
Q:您看我下面两个样本的结果图,完全一样的模板和圈门逻辑,上面这个样本的图片挺好看的吧,可是到了下面那个样本,位于0点的阴性群,后面多出了一个阴性群的拖尾,不知道这是什么情况:

△点击放大图片
罗工:你这个一看就是补偿没调好!
罗工:你打开下面这个样本的原始图片,纵坐标轴挨个染色通道切换着看一下,肯定是有哪个通道对当前这个PE通道的补偿值调节过度了。
Q:我调整了,截图您再帮我看下

△点击放大图片
罗工:下排中间的那个图,纵轴明显向负轴偏移。
罗工:这说明,当前纵轴的荧光,即PE-CY7通道,到横轴的PE通道的补偿调节的过度了,需要把当前补偿的数值调小,让图片回正。
Q:真的诶,我把这个数值调小了之后,图片就回复正常了,谢谢罗工。

△点击放大图片
△点击放大图片
Q:不过,罗工,你看我最开始的图,为啥没调好补偿有的样本的数据却还挺好看?
罗工:你看你的PE-CY7染得是IFN-γ,这不是每个样本中都表达很高的,你可以去回看下原始数据,错误补偿时,看不到阴性拖尾的那些,肯定都是IFN-γ表达不高,或者压根没表达的样本,所以看着不明显。
罗工:所以说,我们检查补偿的时候,多切换几个样本看下,会更容易发现问题。
Q:OO,原来如此!
5、Flowjo——Backgating功能的巧用(点击返回目录)
Q:罗工罗工,帮我看看这个组织样本的流式结果图,跟血液和脾脏的图差好多啊,弥散的一大片,我在FSC/SSC的图上不知道到底应该圈哪儿好了,都圈上么?

△点击放大图片
Q:我记得之前看咱的讲座视频,是要在圈主群体的时候,尽量不圈左下角的细胞碎片和仪器的信噪音来的,可是我不知道应该从哪里界定,而且我也试了下,后续圈门的百分比,还是受我这个图圈门位置的一定影响的,不敢乱圈。
Q:而且你看图上还提示我11%的细胞跑出边缘了,我是不是上机的时候FSC/SSC电压设置的也不合适啊?
罗工:这个根据我的经验来看呢,其实左下角的碎片信号和严重的死细胞和黏连细胞从这个图上能看出些细胞形态的,大致分在这个位置
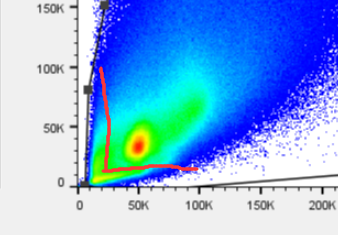
△点击放大图片
罗工:要是说严格的,有依据点的话,给你介绍个Layout图片编辑器中的一个小工具。
罗工:咱分析的不是组织样本里的免疫细胞么,刚你也说后续圈门逻辑啥的都圈好门了,那你把CD45+死活-的那群门内的细胞图打开,并拖动到Layout里,右键点击图片,选中里面的“Backgating”
Q:这样对么?
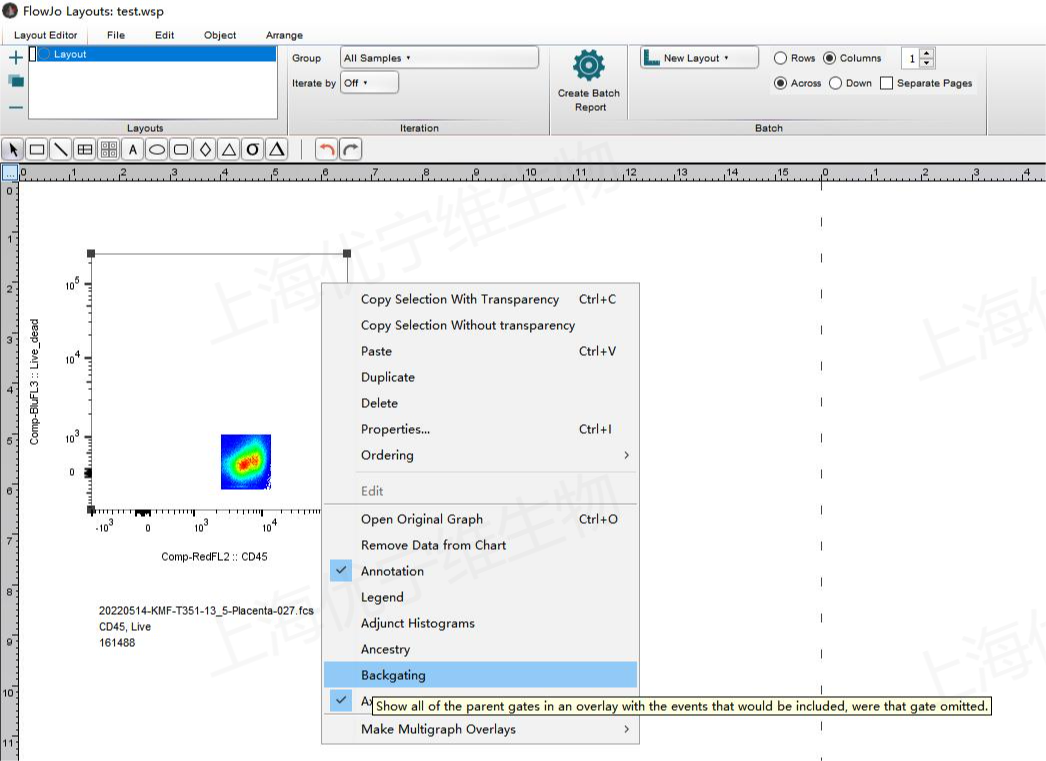
△点击放大图片
罗工:对的
图片Q:哦哦,弹出了一个这样的前面圈门的流程界面,这个我要怎么看呢?
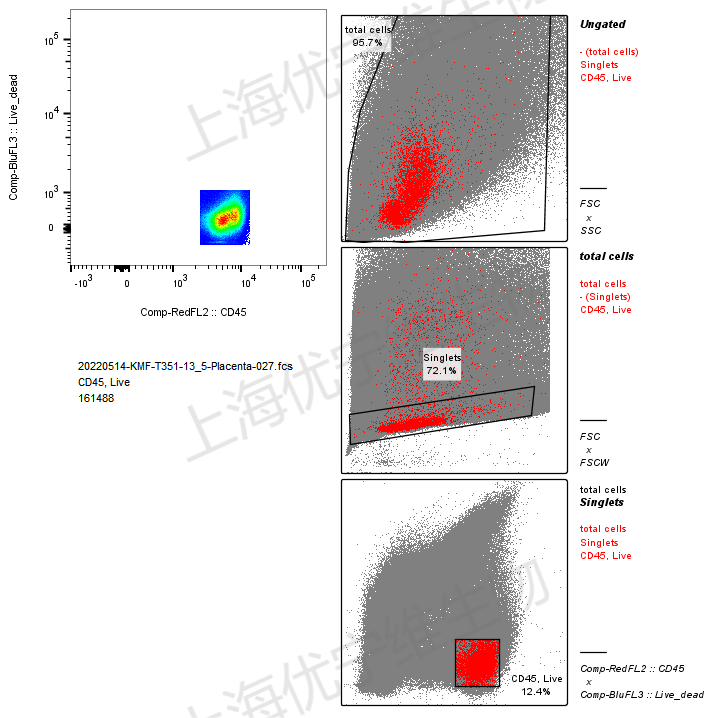
△点击放大图片
罗工:你看,里面红色的就代表你当前,所圈的这个门内的细胞的所在位置了,从这个图你再回看你的第一张FSC/SSC的图,就能看出来,左边费目的细胞,差不多就在刚才我大致截图给你的那个分割位置。
罗工:然后压线跑出边界的细胞,也都不是咱的免疫细胞,跑出去就跑出去了,不影响目的细胞百分比的显示,你电压设置的没啥问题,不用重新调哈。
Q:好的好的,我明白该怎么搞了,感谢罗工~





