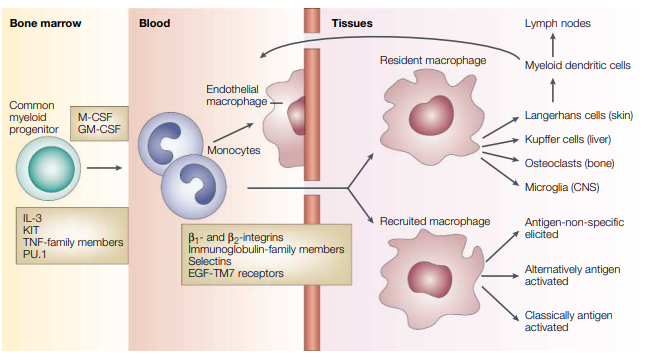
巨噬细胞是造血系统中最具可塑性的细胞,存在于所有组织中,并显示出巨大的功能多样性。它们在发育、体内平衡、组织修复和免疫中发挥作用。目前,巨噬细胞已经成为许多人类疾病的重要治疗靶点,所以认识到巨噬细胞的多样性是至关重要的。
组织驻留巨噬细胞是在大多数器官中发现的一个多样化的细胞家族,如大脑小胶质细胞、肝脏Kupffer细胞和肺泡巨噬细胞。对于各脏器中的巨噬细胞的研究,人的样本很难获取,因此小鼠模型就是最佳的研究对象。在小鼠各脏器中巨噬细胞的异质性,导致在做免疫相关的流式研究时,选择的标志物或染色结果图会出现差异。
下面给大家介绍一些小鼠不同研究样本中的巨噬细胞标志物及图例。
△点击放大图片
1. 小鼠血液
在小鼠血液中,巨噬细胞也可以叫做Ly-6Clow单核细胞,含量较少,一般用CD11b+、F4/80+作为检测标志物。

△点击放大图片
2. 小鼠骨髓
巨噬细胞也一般用CD11b+、F4/80+作为检测标志物。

△点击放大图片
3. 小鼠肝脏组织
小鼠肝脏中有两类巨噬细胞,一类叫做kupffer细胞,用F4/80 hi CD11b low进行鉴定。另一类叫单核细胞衍生的巨噬细胞,用F4/80 low CD11b hi进行鉴定。

△点击放大图片
4. 小鼠肺组织
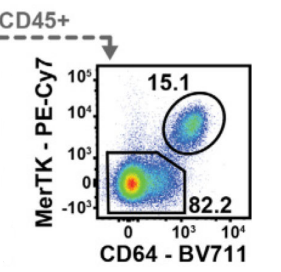
小鼠肺中也有两类巨噬细胞,分为肺泡巨噬细胞(Alveolar macrophages)和肺间质巨噬细胞(Interstitial macrophages),可以用CD64+MerTK+圈出肺巨噬细胞,再通过CD11b和CD11c区分肺泡和肺间质巨噬细胞,且有利于在一个panel中同时做巨噬和DC的区分(不做详细划分巨噬细胞类型,也可用CD11b和F4/80marker检测)。后面还可以增加,CD11C,CD206和MHCⅡ做进一步分型。
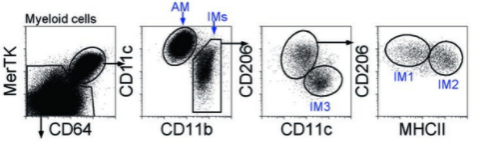
△点击放大图片
图例1
△点击放大图片

△点击放大图片
5. 小鼠中枢神经系统
小鼠中枢神经系统存在多种巨噬细胞,有小(神经)胶质细胞(CD11b+CD45lowF4/80+)和单核细胞衍生的巨噬细胞(CD11b+CD45hi)。
单核细胞衍生的巨噬细胞继续细分的话,包括:
血管周围巨噬细胞(CD11b+CD45hiF4/80+CD163+CD206+)
脑膜巨噬细胞(CD11b+CD45hiF4/80+CD163-CD206+)
脉络从巨噬细胞(CD11b+CD45hiCD163-MHCIIhi)

△点击放大图片
6. 小鼠脾脏组织
巨噬细胞也一般用CD11blow、F4/80+作为检测标志物,也可用CD11blow、CD64+作为检测标志物,还特征性表达MerTK,CD68。脾脏里的巨噬细胞细分的话,还可以分为红髓和白髓巨噬细胞、边缘区巨噬细胞 (MZM) 和边缘区嗜金属巨噬细胞 (MMM),具有高度异质性。用酶消化法,而不是传统的机械研磨,可以显着改善这些巨噬细胞亚群的分离,特别是 MZM (CD11bhighF4/80med Tim4high
)和 MMM(CD11bhighF4/80medTim4med)

△点击放大图片

△点击放大图片
7. 小鼠肠道组织
肠道组织里,很多老师都会研究DC细胞,但是DC细胞的标志物CD11C,MHCII在肠道巨噬细胞中也会有表达,老师们在检测和数据分析圈门时要注意哦。

△点击放大图片
8. 小鼠皮肤组织
除了CD11B,F4/80marker外,可添加EPCAM,CD64,CD24等标志物,用于对巨噬细胞进行更详细的划分。

△点击放大图片

△点击放大图片
9. 小鼠肾脏组织
肾脏中,单核细胞/巨噬细胞群定义为 CD11b+和Ly6Chigh、Ly6Cintermediate(int)或Ly6Clow。所有三个群体都以低水平存在于正常肾脏中。在炎症模型中,会随着炎症程度的改变,逐渐改变。
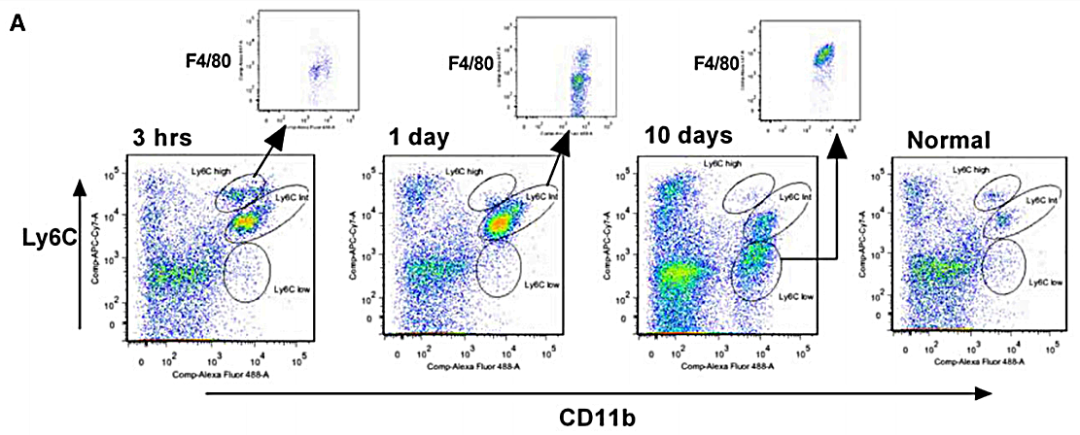
△点击放大图片
10. 小鼠睾丸组织

△点击放大图片
11. 脂肪组织
小鼠脂肪组织巨噬细胞同样可以用CD11b+、F4/80+作为标志物,但是F4/80mid群包含嗜酸性粒细胞 (Siglec-F+) 和中性粒细胞(GR1+),因此,圈门的时候要十分小心,只要圈下图中1门的位置,进一步可以通过CD11c+和CD301+/CD206+去区分M1和M2。

△点击放大图片
下表位对上述检测样本进行的汇总,便于供大家查阅:

△点击放大图片
上述内容涉及到的部分相关组织样本制备,可以查看如下文章:(可点击查看)
| 样本 | 文章 |
| 脾脏 | 【罗工流式宝典第1式】小鼠Treg细胞的鉴定、分离及体外抑制实验 |
| 肾脏,主动脉 | 【罗工流式宝典第2式】小鼠高血压模型(主动脉、肾脏组织)中Th细胞的鉴定 |
| 淋巴结 | 【罗工流式宝典第3式】小鼠淋巴结Th17细胞体外诱导分化及鉴定 |
| 骨髓 | 【罗工流式宝典第4式】小鼠骨髓来源树突细胞的获取,体外诱导及相关功能评价 |
| 皮肤 | 【罗工流式宝典第5式】从人和小鼠的皮肤组织制备单细胞悬液 |
更多组织:
https://www.univ-bio.com/worthington.html
下表为我司验证过的,小鼠的巨噬细胞检测常备现货的骨架panel,有需要的小伙伴们欢迎询价,打包选购更优惠哦!
| 指标 | 荧光素 | 货号 | 规格 | |
| Mouse macrophage | CD45 | FITC | 553079 | lOOug |
| Mouse macrophage | CDllb | Pcrcp-cy5.5 | 550993 | lOOug |
| Mouse macrophage | F4/80 | BV421 | 565411 | 50ug |
| Mouse macrophage | CD86 | PE-CY7 | 560582 | 50ug |
| Mouse macrophage | CD206 | AF647 | 565250 | 25ug |
| Fc block | Fc block | 553141 | lOOug |
参考文献:
[1] Wynn TA, Chawla A, Pollard JW. Macrophage biology in development, homeostasis and disease. Nature. 2013 Apr 25;496(7446):445-55. doi: 10.1038/nature12034.
[2] Ying W , Cheruku P S , Bazer F W , et al. Investigation of Macrophage Polarization Using Bone Marrow Derived Macrophages[J]. Journal of Visualized Experiments Jove, 2013(76).
[3] Davies LC, Jenkins SJ, Allen JE, Taylor PR. Tissue-resident macrophages. Nat Immunol. 2013 Oct;14(10):986-95. doi: 10.1038/ni.2705.
[4] Gordon S. Alternative activation of macrophages. Nat Rev Immunol. 2003 Jan;3(1):23-35. doi: 10.1038/nri978.
[5] Waddell A, Ahrens R, Steinbrecher K, et al. Colonic eosinophilic inflammation in experimental colitis is mediated by Ly6C(hi) CCR2(+) inflammatory monocyte/macrophage-derived CCL11. J Immunol. 2011;186(10):5993-6003. doi:10.4049/jimmunol.1003844
[6] Gibbings SL, Jakubzick CV. Isolation and Characterization of Mononuclear Phagocytes in the Mouse Lung and Lymph Nodes. Methods Mol Biol. 2018;1809:33-44. doi: 10.1007/978-1-4939-8570-8_3.
[7] Pedragosa J, Salas-Perdomo A, Gallizioli M, et al. CNS-border associated macrophages respond to acute ischemic stroke attracting granulocytes and promoting vascular leakage. Acta Neuropathol Commun. 2018 Aug 9;6(1):76. doi: 10.1186/s40478-018-0581-6.
[8] Cho KW, Morris DL, Lumeng CN. Flow cytometry analyses of adipose tissue macrophages. Methods Enzymol. 2014;537:297-314. doi: 10.1016/B978-0-12-411619-1.00016-1.
[9] Kakoschky B, Pleli T, Schmithals C, et al. Selective targeting of tumor associated macrophages in different tumor models. PLoS One. 2018 Feb 15;13(2):e0193015. doi: 10.1371/journal.pone.0193015.
[10] Clements Meghan,Gershenovich Michael,Chaber Christopher et al. Differential Ly6C Expression after Renal Ischemia-Reperfusion Identifies Unique Macrophage Populations.[J] .J Am Soc Nephrol, 2016, 27: 159-70.
[11] Cossarizza Andrea,Chang Hyun-Dong,Radbruch Andreas et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition).[J] .Eur J Immunol, 2019, 49: 1457-1973.
[12] Lokka Emmi,Lintukorpi Laura,Cisneros-Montalvo Sheyla et al. Generation, localization and functions of macrophages during the development of testis.[J] .Nat Commun, 2020, 11: 4375.
[13] Fujiyama S, Nakahashi-Oda C, Abe F, et al. Identification and isolation of splenic tissue-resident macrophage sub-populations by flow cytometry[J]. International immunology, 2019, 31(1): 51-56.