Annexin V染料是检测细胞凋亡时最常用的一种流式检测试剂,我们通常购买产品时所说的凋亡检测试剂盒里的主要成分也往往是它。本期专题针对Annexin V实验检测中涉及的实验原理,试剂的选择,染色流程,实验注意事项,上机设置,结果分析,及常见问题等进行系统性的总结,便于供各位老师更好的完成实验。
一、检测原理:
在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜的磷脂双分子层的内侧,在细胞发生凋亡的早期,就会出现PS由脂膜内侧翻向外侧的现象。Annexin V作为一种Ca2+依赖的磷脂结合蛋白,与PS有高度亲和力,可以与暴露在膜外侧的PS结合。因此Annexin V是检测细胞早期凋亡的灵敏指标。
由于晚期凋亡和其他原因死亡的细胞,膜的通透性会增加,因此Annexin V一般不单独使用,往往会结合死活染料帮助进一步区分,其中最常用为核酸染料PI,7-AAD等,胞内染色用的如BD品牌的FVS系列死活染料也可以用,只是出于价格问题,成套试剂盒一般不会选用而已。
二、试剂荧光搭配的选择:
试剂盒的荧光搭配主要需从待测样本所带自发荧光角度进行考虑:
1. 细胞无自发荧光:何种流式仪可检测的荧光搭配均可使用
2. 细胞有自发荧光:
①模型构建时病毒或质粒带荧光:阳性率<30%,光谱重叠的荧光素不可使用;阳性率>30%,应该泄漏严重的荧光通道建议不要使用,如
GFP 荧光,与 AF488/FITC重叠,与PE泄漏严重
mCherry荧光,与 PI/PE/PE-CF594重叠,与Percpcy5.5泄漏严重
RFP荧光,与Percpcy5.5重叠,与PI/PE/PE-CF594泄漏严重
其他常见自发荧光说明,可详见:
②外界处理因素是否带有荧光:
药物分子结构至本身多发红橙色荧光本(如Doxorubicin ),对PI、PE通道的检测造成严重干扰,浓度越高,影响越大,自发荧光需要自己预实验摸索。
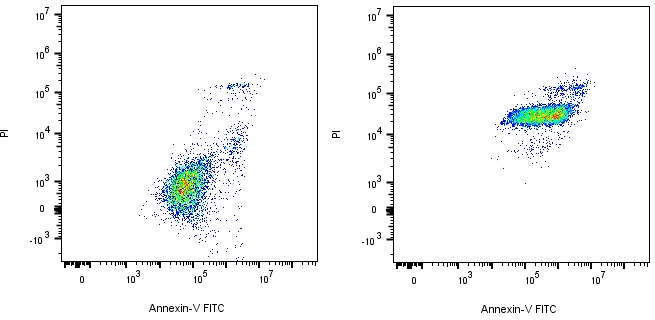
不加药 加药
△点击放大图片
三、染色流程:
1. 常规只染凋亡的流程:
①用预冷的PBS洗涤细胞2次,以1×106个细胞/ml的浓度将细胞重悬于含钙离子的缓冲液(1×Binding Buffer)中;
②将100 μl溶液转移至流式管中加入试剂盒说明书对应用量的Annexin V和核酸染料,轻摇混匀,避光室温孵15 min;
③向每个管中加入400 μl含钙离子的缓冲液重悬。在1 h内上机分析。
2. 与其他表染标志物联用:
①按常规多色流式步骤,完成FCR阻断+表面标记等前序系列步骤;
②用预冷的PBS洗涤两次;
③用1×Annexin V Binding Buffer洗涤一次;
④用100 μl 1×Annexin V Binding Buffer重悬细胞沉淀,调整细胞密度,加入Annexin V抗体和核酸染料,室温避光15 min;
⑤ 加入400 μl1×Annexin V Binding Buffer,尽快上机(1 h内)。
3. 与其他表面和胞内标志物联用:
①按常规多色流式步骤,完成染胺基类死活染料(如BD:FVS系列)+FCR阻断+表面标记等前序系列步骤;
②用预冷的PBS洗涤两次;
③用1×Annexin V Binding Buffer洗涤一次;
④用100 μl 1×Annexin V Binding Buffer重悬细胞,调整细胞密度,加入Annexin V抗体,室温避光15 min;
⑤用1×Annexin V Binding Buffer洗涤一次;
⑥按常规步骤,进行固定破膜+胞内染色+重悬上机等后续步骤。
四、实验注意事项:
1. 保证细胞活性:①PBS需要预冷,②避免用力吹打,③避免贴壁细胞胰酶消化时间过长;
2. 防止细胞黏连:处理成单细胞悬液之后,可适当添加Dnase(最高20 μg/mL);
3. Ca2+环境的维持:①使用Annexin V配套Binding Buffer,②尽量避免使用含EDTA的消化酶,或充分洗涤去除EDTA。
五、上机对照设置:
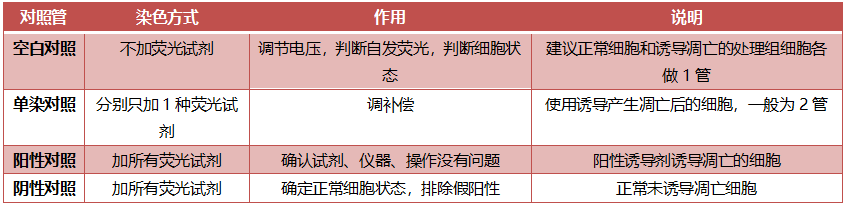
△点击放大图片
空白管和单染管在上机调好相关参数后,后续可以不用每次上及时都准备,阴阳性对照发并非必须,一般建议初次做实验,或试验出现问题寻找原因时使用。
六、结果分析:

△点击放大图片
因双阳性群体,无法区分晚期凋亡和其他原因导致的死亡如坏死等细胞,因此建议大家在做凋亡检测预实验时,尽量找到合理的刺激浓度或处理时间等,尽量让细胞位于早期凋亡的位置,投稿时会更具有说服力,不容易被审稿人diss。
七、常见问题:
Q1:Annexin V相关试剂盒能否检测人以外的其他细胞凋亡情况?
A1:可以,因为Annexin V 是与磷脂酰丝氨酸(PS)的结合,而PS基本不存在种属间差异。
Q2:流式测凋亡为何左上象限出奇的高?
A2:左上象限一般是由于处理方式不当(机械力过大),处理时间太久或刺激物质浓度过高导致的环境骤变引起的非凋亡途径的细胞死亡,需要优化处理的浓度和时间梯度,以及优化细胞培养和细胞消化的流程。
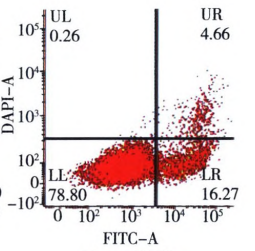
Q3:为什么检测不到凋亡阳性信号?
A3:

△点击放大图片
Q4:为什么凋亡结果与预期不符?
A4:处理时间过长,处理浓度过高,细胞初始活性差等原因导致的假阳性或假阴性结果。
Q5:DAPI是否能用于凋亡检测中作为核酸类死活染料,用于细胞的区分?
A5:可以的,有很多文献有相关结果可以证明,如下图。
△点击放大图片
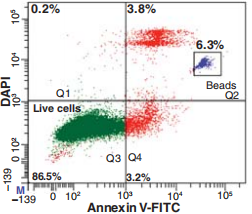
△点击放大图片
只是因为Dapi有一定的膜穿透能力,因此染色浓度需要摸索,以达到最好的分群效果,如下图。
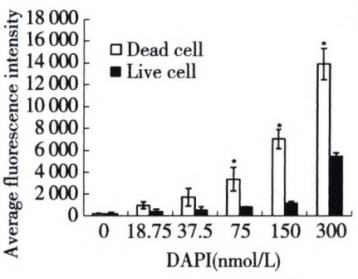
△点击放大图片
△点击放大图片
Q6:是否有其他的检测凋亡的方法?
A6:有的,AnnexinV检测法主要用于检测早期凋亡;中早期会出现细胞线粒体跨膜电位下降多 用JC-1等检测方法;中晚期会出现凋亡信号通路的活化,多检测Caspase3的活化水平;晚期会出现核内DNA的断裂多用Tunel方法进行检测。