此篇文章摘录于Methods in Molecular Biology 2032中的一篇,名为Multiparametric Flow Cytometry Analysis of Naive, Memory,and Effector T Cells(https://doi.org/10.1007/978-1-4939-9650-6_8)其作者是Ankit Saxena等。
自然杀伤细胞(NK)是与T细胞和B细胞同一家族的淋巴细胞,来自共同的祖细胞。它可以杀死病毒感染的和恶变的细胞,这个过程且无需对抗原进行任何作用。NK细胞以杀死病毒感染的细胞、检测和控制癌症早期症状而闻名。除了预防疾病外,胎盘中还发现了专门的NK细胞,在怀孕期间可能发挥重要作用。
在人类中,不同类型的NK细胞(NK细胞毒性、NK调节性和NK记忆性)分别根据它们具有的细胞毒性、调节谱和耐受性功能进行了描述。每种类型的NK细胞,都可以通过一组表面/细胞内NK细胞标记物以及分泌分子来进行区分。
在本文中,作者提供了使用流式细胞术分析NK细胞的详细方案,并简要介绍了其他技术。
(一) 材料和试剂耗材
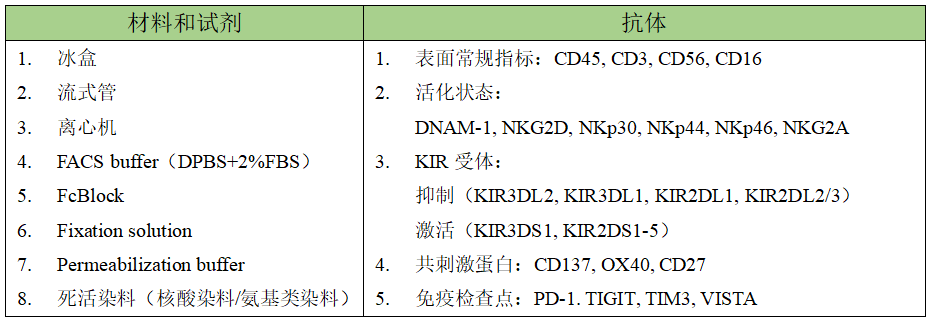
△点击放大图片
(二) 方法—流式细胞术
1. 准备样本,制备好单细胞悬液
1) 全血
2) 分离的PBMC
3) 冻存的PBMC
4) 活检部位
5) 新鲜的器官或肿瘤组织
2. 确认染色指标
1) 研究血液或组织中NK细胞,应根据研究兴趣和可用的流式细胞仪进行设计。为了简单地鉴定血液或组织中的人类NK细胞,CD45、CD3、CD56和CD16 这4种标记物被广泛使用,其余的标记物可参考表格抗体一栏。
2) 方案设计注意强弱搭配。
3. 根据实验需要准备空白管,单染管,全染管。
4. 用DPBS重悬样本,并进行计数。
5. 转移细胞到准备的流式管中,2×105 cells/管。
注意:若使用了核酸死活染料,直接跳到16步继续。
6. 加DPBS到1mL,重悬,700 g 离心 2min,去上清。
7. 重复步骤6。
8. 根据产品说明书要求,在样品中添加可固定的死活染料。
9. 根据说明书要求,孵育可固定死活染料。
10. 加1mL FACS buffer重悬,700 g 离心 2min,去上清。
11. 重复步骤10。
12. 加FcBlock,1×106 cells/2.5μg。
13. 根据说明书推荐用量以及样本数量混合表面抗体,补充FACS buffer,加到样本中,10-20μL/管。
14. 混匀,4℃避光孵育20min。
15. 重复步骤10。
16. 200 μL DPBS 重悬细胞。
17. 如果没有使用可固定的死细胞标记,则将核酸死活染料添加到所有细胞中,并在4℃避光孵育5min。
18. 保持细胞4℃,直到上机检测。
(若有胞内指标,继续往下实验)
19. 使用固定液重悬细胞样本。
20. 样本在固定液中4℃孵育30min或者根据破膜试剂盒说明书要求操作。
21. 准备破膜液(Perm buffer),加入1mL破膜液重悬细胞,700 g 离心 2min,去上清。
22. 重复两遍步骤20。
23. 根据说明书推荐用量以及样本数量混合胞内抗体,补充Perm buffer,加到样本中,10-20μL/管。
24. 混匀,冰上避光孵育40-60min。
25. 加入1mL Perm buffer重悬细胞,700 g 离心 2min,去上清。
26. 重复步骤24。
27. 200 μL DPBS 重悬细胞。
28. 保持细胞4℃,直到上机检测。
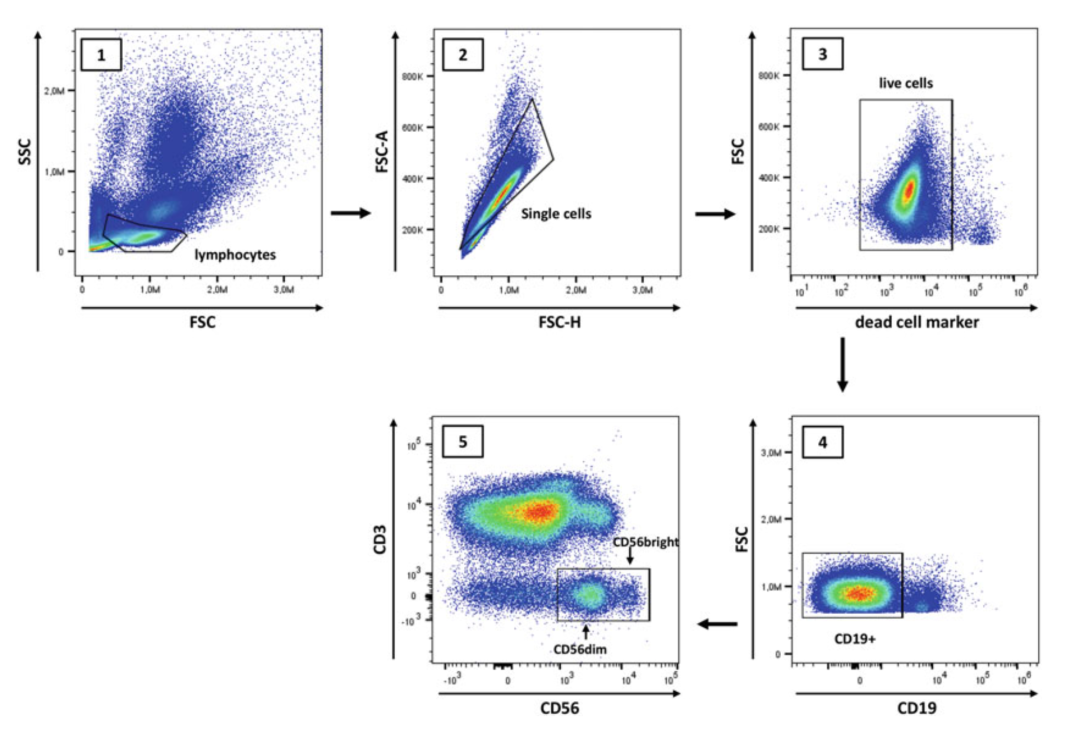
Fig 1.人PBMC中NK细胞的鉴定
△点击放大图片
(三) 其他方法学
1. 质谱流式(Mass Cytometry)
与流式细胞仪相比,质谱仪,也称为飞行时间细胞仪(CyTOF),它是一种新的平台,可以对免疫细胞亚群进行更深入的分析。理论上,质谱仪能够测量多达100种不同的稳定同位素标签,但这些标签的高纯度要求将其使用限制在40种左右的稀土金属。样品制备类似于流式细胞术。与流式细胞仪的采集不同,抗体不与荧光染料偶联,而是与重金属偶联。与结合NK细胞的抗体偶联的每种重金属将在精确的分子量下产生一个独特的峰。优点是不同重金属之间没有重叠,因此不需要执行补偿。100多种重金属可用于质谱分析,为深入分析NK细胞表型和亚群提供了机会。
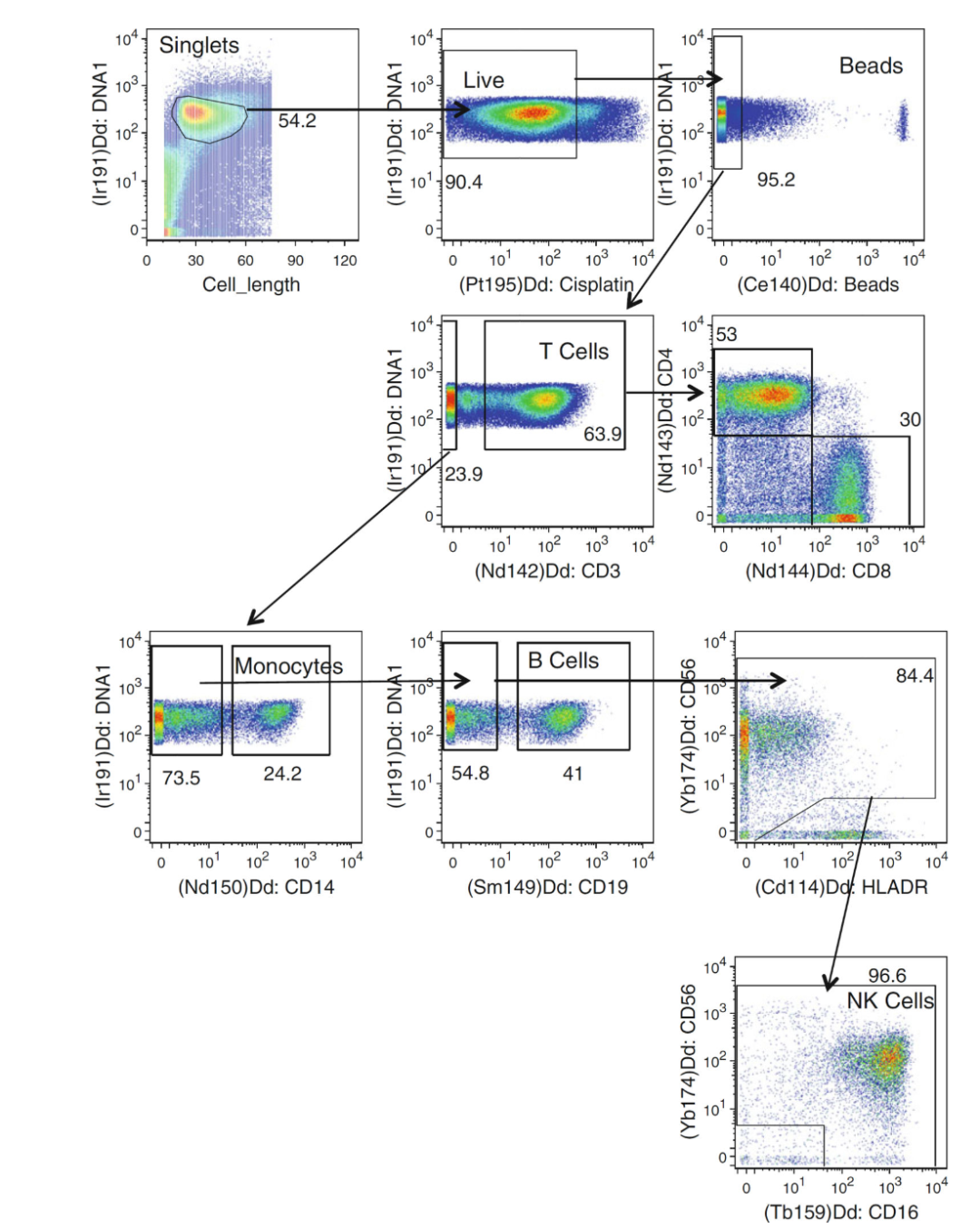
Fig 2.质谱流式识别NK细胞和其他细胞亚群的门控策略
△点击放大图片
2. 多重免疫组化
流式细胞术和CyTOF可以识别单细胞悬液中免疫细胞亚群,但无法获得有关空间分布的信息。然而免疫细胞的定位及其局部环境在肿瘤的不同区域(间质、瘤内和肿瘤边缘)确实不同,细胞定位的不足可能对预后有很大的影响。多重免疫组化能够提供这种缺失的信息,单个切片的连续染色展示肿瘤内的空间细胞类型分布,并得出细胞特异性蛋白表达的结论。
使用多重免疫组织化学进行更深入的分析已有确定的进展。成像质谱仪就是这样一种发展,将质谱仪与组织定位相结合。在该应用中,新鲜冷冻石蜡包埋组织或冷冻切片按照标准免疫荧光方案用质谱抗体染色。另一项发展是CODEX技术进行蛋白检测,以实现抗体标记的靶表位的复用。
3. 全基因组分析
组学技术通常被认为是基于基因组学的,它能提供NK细胞中起重要作用的分子全景图。为了使用不同水平的组学方法分析NK细胞,可以应用不同的技术,包括微阵列、RNA测序、单细胞RNA测序和MicroRNA测序。
(四) 注意事项
1. 全血可直接用于表面染色,染色抗体直接加入全血中,孵育后,用FACS buffer洗涤所有样品,然后进行红细胞裂解。该步骤是为了减少丢失或损坏表面蛋白的风险。特别是在研究趋化因子时,有研究发现一些趋化因子受体(即CXCR2)的表达在Ficoll密度离心后丢失。
2. 在新鲜血液样本需要使用Ficoll分离PBMC。健康供体的PBMC含有5%-15%的NK细胞。以新鲜的PBMC作为起始样本不仅可以对样本进行表型分析,还可以进行功能研究。但要注意分离PBMC可能改变细胞表面蛋白,特别是趋化因子受体。
3. 冷冻的PBMC也可用于NK细胞表型。如果冷冻的PBMC上的染色结果与新鲜PBMC上观察到的结果相似,也建议预先进行测试。因为冻融过程已被证明会改变和破坏细胞表面蛋白,如果可能,应尽量避免使用冷冻PBMC。
4. 使用胰蛋白酶可以从细针抽吸活检中获得单个细胞。样品消化后,细胞应通过70μm的细胞过滤器以去除组织块。如果样品中存在游离DNA,建议使用DNase进行额外处理。
5. 新鲜肿瘤或器官材料需要机械分离。首先应将样品切成小块,置于PBS中(含5% FBS、200U/ml青霉素和200U/ml链霉素);然后,通过80μm筛网进行过滤;此时还可以加入collagenase酶和 dispase酶进行酶消化;如果存在游离DNA,可以将DNase添加到酶混合物中。在最后一步中,样品应通过40μm细胞过滤器,以去除剩余的组织块。
6. 不同荧光染料的强度不同,低表达蛋白应该用与较亮荧光染料结合的抗体检测。此外,应考虑光谱重叠和机器设置。逐渐表达或变化的蛋白质应使用与其他荧光染料具有低光谱重叠的荧光染料检测,以减少补偿误差。
7. 如果包括细胞内染色,建议从较高的细胞数(300000–500000个细胞)开始。固定和渗透可减少细胞数量,这是由于洗涤步骤的增加造成细胞损失。
8. 应优化样品的固定方法。通常使用PFA溶液进行细胞固定,或使用商品化试剂盒进行细胞内和核内染色。
9. 甲醇和丙酮是渗透固定细胞的常用洗涤剂。洗涤剂的选择取决于应用(细胞内染色与核内染色)和蛋白质稳定性。或使用商品化试剂盒,可用于细胞内和核内染色,包括磷酸化蛋白染色。
10. 细胞内染色比细胞表面染色需要更长的孵育时间。
11. 固定样本可在采集前4℃下储存数小时。荧光染料的稳定性,特别是共轭荧光染料是固定样品储存的时间限制因素。
参考文献
1. Abel AM, Yang C, Thakar MS, Malarkannan S. Natural killer cells: development, maturation, and clinical utilization. Front Immunol. 2018;9:1869. doi:10.3389/fimmu.2018.01869
2. Ornatsky O, Bandura D, Baranov V, Nitz M, Winnik MA, Tanner S. Highly multiparametric analysis by mass cytometry. J Immunol Methods. 2010 Sep 30;361(1-2):1-20. doi: 10.1016/j.jim.2010.07.002.
3. Atkuri KR, Stevens JC, Neubert H. Mass cytometry: a highly multiplexed single-cell technology for advancing drug development. Drug Metab Dispos. 2015 Feb;43(2):227-33. doi: 10.1124/dmd.114.060798.
4. Kay AW, Strauss-Albee DM, Blish CA. Application of Mass Cytometry (CyTOF) for Functional and Phenotypic Analysis of Natural Killer Cells. Methods Mol Biol. 2016;1441:13-26. doi: 10.1007/978-1-4939-3684-7_2.
5. Chang Q, Ornatsky O, Hedley D. Staining of Frozen and Formalin-Fixed, Paraffin-Embedded Tissues with Metal-Labeled Antibodies for Imaging Mass Cytometry Analysis. Curr Protoc Cytom. 2017 Oct 2;82:12.47.1-12.47.8. doi: 10.1002/cpcy.29.
6. Goltsev Y, Samusik N, Kennedy-Darling J, Bhate S, Hale M, Vazquez G, Black S, Nolan GP. Deep Profiling of Mouse Splenic Architecture with CODEX Multiplexed Imaging. Cell. 2018 Aug 9;174(4):968-981.e15. doi: 10.1016/j.cell.2018.07.010.





