阵发性睡眠性血红蛋白尿(PNH)是一种罕见但经常使人虚弱的疾病,如果没有发现和治疗,可能会在5年内导致高达35%的患者死亡。如今,流式细胞术已经成为诊断和监测PNH及相关疾病患者的金标准,高灵敏度的流式细胞术可以识别PNH表型的存在,并能够量化红细胞RBC和白细胞wbc(中性粒细胞和单核细胞)中的PNH克隆大小。白细胞中PNH克隆的大小通常用于确定疾病的程度。由于新疗法通常会阻止红细胞的溶血,从而显著降低与这种疾病相关的发病率和死亡率。本文描述了最新出版的PNH检测指南中最新经过验证的高灵敏度流式细胞术方法。
简介及注意事项
GPI-AP缺陷检测在PNH和BMFS中的临床应用。
磷脂酰肌醇锚定蛋白(GPI-AP)缺陷的造血干细胞(HSC),发生在X染色体上的磷脂酰肌醇糖链互补A类基因(PIG-A)的体细胞突变后。突变的HSC能够逃脱免疫攻击,导致克隆性扩增,随后发生额外的遗传或表观遗传事件。促炎性骨髓环境(The proinflammatory bone marrow environment)的特点是细胞因子谱改变CD4+CD25+Fox3调节性T细胞减少,参与器官特异性自身免疫的CD4+辅助Th1细胞和效应Th17细胞扩张,CD8+细胞毒性T细胞扩张。这些疾病表现为克隆性造血、重叠的临床症状和发展为骨髓增生异常综合征(MDS)或急性髓系白血病(AML)的趋势:
罕见的遗传性骨髓衰竭综合征(IBMFS)与较常见的获得性骨髓衰竭综合征(ABMFS),例如再生障碍性贫血(AA)和发育不全骨髓增生异常综合征(h-MDS)之间的差别并不简单。为了成功地开发出高灵敏、准确和可重复性的检测方法,需要仔细选择和滴定抗体克隆/结合物以用于线性特异性门控(红细胞、中性粒细胞和单核细胞)和每个细胞系中的特异性GPI抗原检测。用流式细胞术检测PNH表型具有一定难度,因为检测目标为阴性群体。这对如何圈门和补偿有相当大的影响。
仪器和抗体推荐
一、仪器配置
在仪器配置方面需要一台至少能进行五色分析的流式细胞仪。
表1推荐用于高灵敏度PNH RBC检测的CD235a-FITC和CD59-PE结合物:

表2在Beckman Coulter细胞仪上高灵敏度检测PNH WBC的推荐克隆/结合物:
△点击放大图片
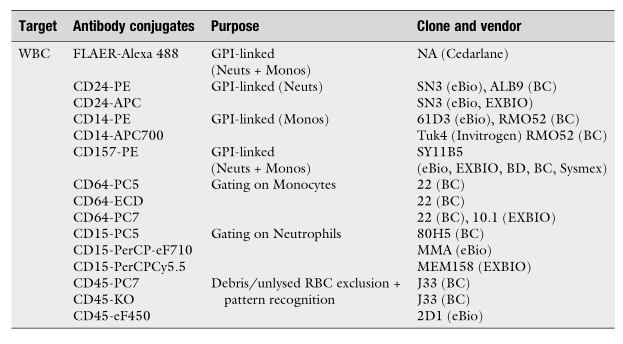
表3建议在BD细胞仪上高灵敏度检测PNH WBC的克隆/结合物:
△点击放大图片
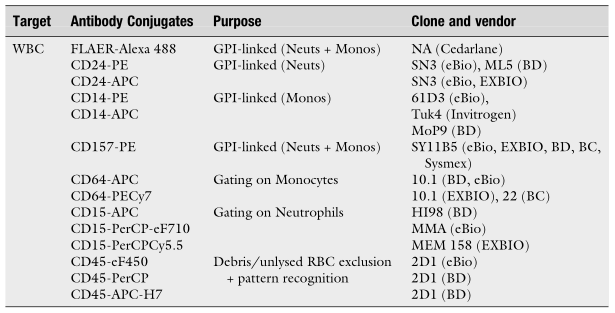
表4推荐用于跨平台三激光B-C Navios/BD Canto II高灵敏度PNH WBC 5色、6色和7色分析的克隆/结合物:
△点击放大图片
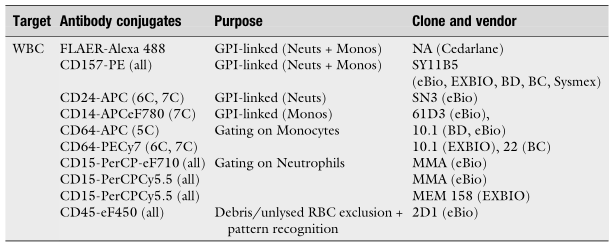
△点击放大图片
二、抗体组合推荐
1.适用于高灵敏度PNH RBC检测的抗体推荐
(a)门控抗体:CD235a用于区分红细胞与其他events(白细胞、血小板、碎片等),并且大量CD235a克隆/结合物的筛选表明,带负电荷的FITC结合物产生的聚集性明显低于它们的PE结合物。
(b) GPI连接的抗体:由于CD55无法清晰描述II型和III型PNH红细胞。因此,采用CD59PE偶联物(CD59PE conjugates)作为I型、II型和III型红细胞分离的最佳选择。
并且CD59PE偶联物是鉴定性能最好的CD59试剂。为避免产生假阴性,建议将选定的CD235aFITC和CD59PE试剂预先混合,并用干净的PBS稀释,以帮助准确地添加该检测试剂。
2. 适用于白细胞分析的抗体推荐
(a)门控抗体:
CD45:强烈建议在WBC染色混合物中加入PAN-CD45结合物。CD45在去除亚细胞碎片、血小板和未裂解的红细胞方面非常有效。
对于PNH中性粒细胞和单核细胞的高灵敏度检测,CD33不是最佳的选择。滴定结果表明CD15和CD64的结合物比CD33能更准确的区分中性粒细胞和单核细胞。同时,CD64可能在激活的中性粒细胞中表达上调,为单核细胞和中性粒细胞之间的分离提高难度。
GPI连接的试剂-中性粒细胞和单核细胞:必须根据WBC谱系分析两个GPI连接的结构。FLAER和CD24或FLAER和CD157为检测GPI缺陷中性粒细胞最佳的组合,而FLAER与CD14或CD157为检测GPI缺陷单核细胞最佳的组合。
方法和分析
红细胞推荐染色方案及结果分析
抗凝首选EDTA,但也可使用肝素(外周血样本应小于48h)。冷藏可以延长这些样品的稳定性。具体步骤为:
1. 用PBS按1:100将样品稀释。
2. 将100 μl稀释后的血样反向移液至试管底部,避免产生气溶胶以及在试管内部留下血迹。
3. 制备CD235aFITC/CD59PE抗体混合物注意,可以进行滴定得到最适抗体量。
4. 将抗体加到稀释后的血液样本中,低速旋涡混匀。注:对于“未成熟RBC (iRBC)”染色方案,此时还添加1 μl CD71-APC。
5. 在室温下在黑暗中孵育样品20分钟(已验证孵育可达60分钟)。
6. 用PBS离心洗涤两次,再用0.5-1.0 ml PBS重悬。
7. “架”样品(在硬塑料或金属试管架上拖几次),在细胞仪采集之前立即破坏染色/洗涤过程中产生的RBC聚集物。
8. 通常情况下新鲜样本效果最好,因为一些CD235a缀合物(CD235a conjugates)在洗涤不稳定。延迟也会导致一些RBC聚集物的重组。
9. 获得至少100,000个rbc。如果在Type III PNH RBC区域显示了两个或两个以上的events,则应该继续进行数据采集,直到获得100万个events。
仪器及圈门设置
无论是红细胞还是白细胞的分析,都有必要对流体进行监测并收集数据。
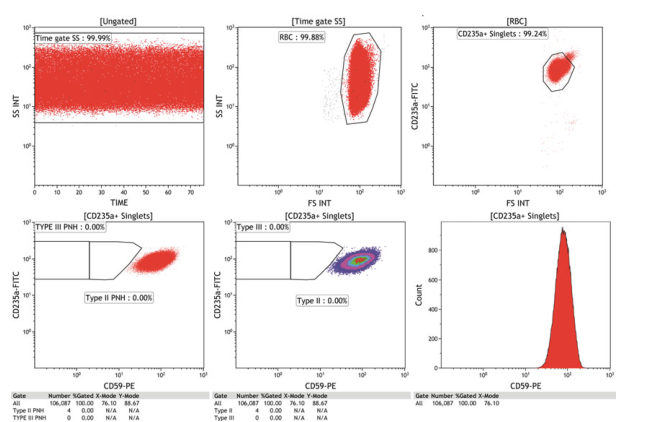
图1. 正常患者,无PNH红细胞克隆。样品用CD235a-FITC/CD59-PE染色。对于未成熟红细胞中PNH的评估则需要采用CD71,CD71-RBC法在WBC克隆数大于或等于5%的PNH病例中能够更好地勾画出III型、II型和正常未成熟红细胞。几乎所有病例的iRBC总克隆大小(II型+ II型)都与WBC克隆大小非常相似(无论是中性粒细胞系还是单核细胞系)。该试验保留了在其他BMFS病例中检测轻微PNH RBC克隆的能力,其中缺乏足够的网织红细胞(reticulocytes)不允许对后者进行评估。
△点击放大图片
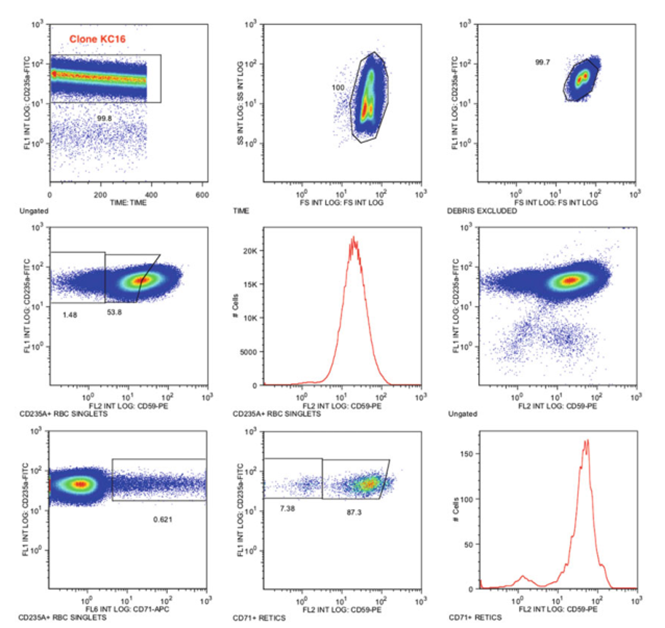
图2.PNH红细胞II型和PNH红细胞III型克隆患者。样品用CD235a-FITC/CD59-PE染色
△点击放大图片
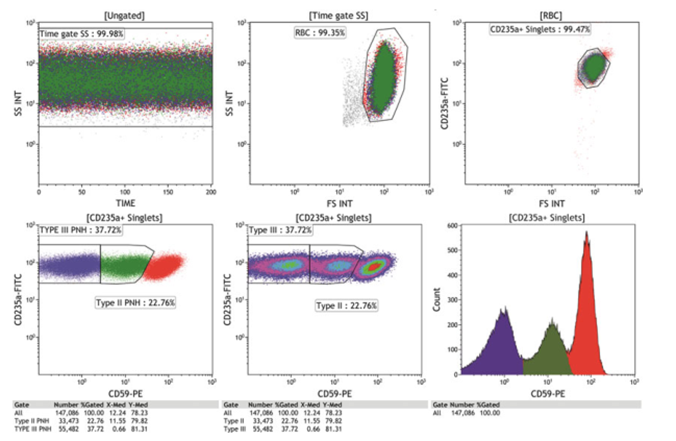
图3 含有94.2% PNH中性粒细胞和94.8% PNH单核细胞(数据未显示)的PNH样本用CD235aFITC/CD59-PE/CD71-APC染色
△点击放大图片
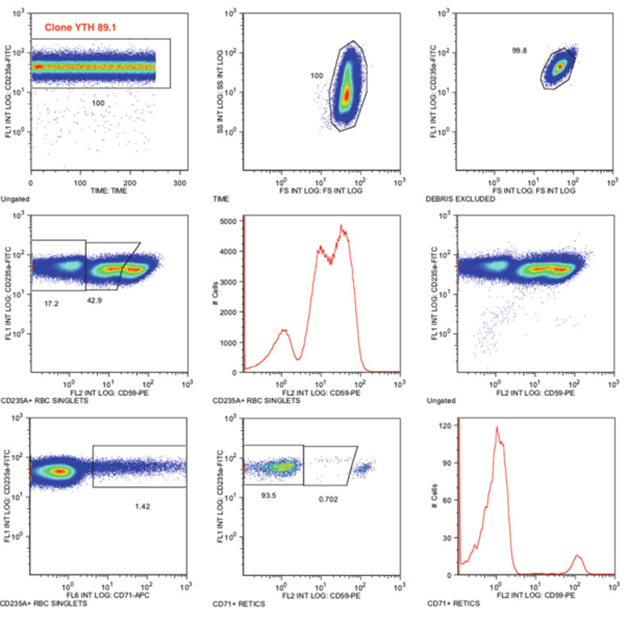
图 4 含97.3% PNH中性粒细胞和99.6% PNH单核细胞(数据未显示)的PNH样品用CD235aFITC/CD59-PE/CD71-APC染色
△点击放大图片
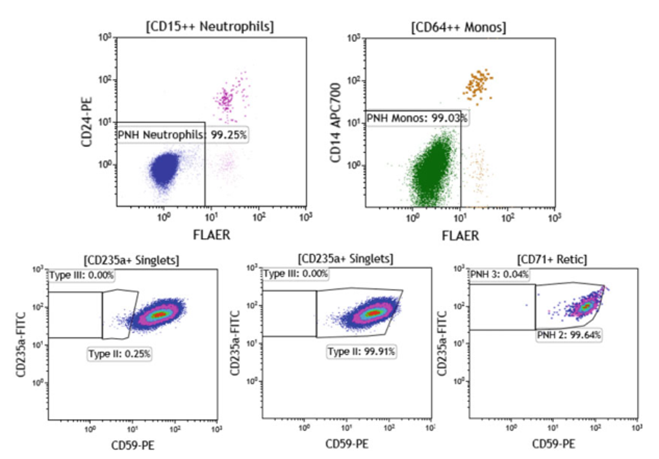
图5。含有99.25% PNH中性粒细胞(右上图)和99% PNH单核细胞(左上图)的PNH样本用CD235aFITC/CD59-PE/CD71-APC700染色。总的来说,这项研究表明(图3、4、5),在PNH患者中,PNH克隆较大,不可能从成熟的(CD235a+) RBC组分中获得准确的III型和II型克隆大小。
△点击放大图片
白细胞分析的样品制备和仪器设置
分析白细胞,首先将100 μl抗凝外周血用所选的试剂混合物染色,并进行RBC裂解步骤。无论使用何种裂解剂,在获取细胞之前,都需要用添加1%牛血清白蛋白的磷酸盐缓冲盐水清洗细胞。
圈门设置
采用了多步布尔门控(A multistep Boolean gating approach)方法来有效地门控中性粒细胞和单核细胞,可以适当地调节阈值,用于去除亚细胞碎片。
最初在中性粒细胞和单核细胞中检测PNH表型的高灵敏度方法是基于四色中性粒细胞管(FLAER、CD24、CD15和CD45)和反射性单核细胞管(FLAER、CD14、CD64和CD45)。具有5、6或更多PMT的新型流式细胞仪允许在单个试管中同时检测和定量中性粒细胞和单核细胞。目前根据既定的PNH指南推荐的白细胞计数面板包括基于FLAER/CD24/ cd14的计数面板和基于FLAER/ cd157的计数面板。
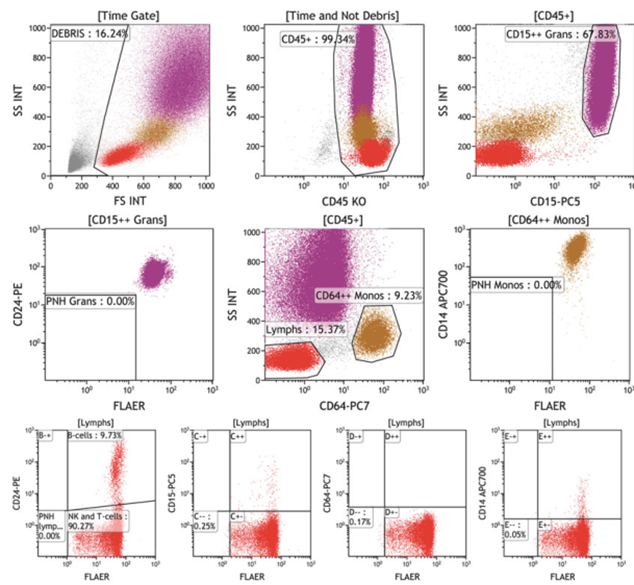
图6,基于FLAER /CD24/ cd14的WBC检测,中性粒细胞和单核细胞中无PNH克隆。样品用FLAER -Alexa 488/CD24-PE/CD15-PC5/CD64-PC7/CD14-APC700/CD45-KrO染色。
△点击放大图片
基于6色FLAER/CD24/ cd14的中性粒细胞和单核细胞单管检测:图6显示了navios特异性试剂集的双因素门控点图(bivariate gating dot plots)序列,该试剂集包括FLAER- Alexa 488、CD24- PE、CD15-PC5、CD64-PC7、CD14-APCA700和CD45-KO。在图6和图7中,中性粒细胞在CD45和CD15上被门控,基于GPI标记物FLAER和CD24的缺失,可以检测到PNH克隆。单核细胞在CD45和CD64上被门控,基于缺乏FLAER和CD14,可以检测到PNH克隆。
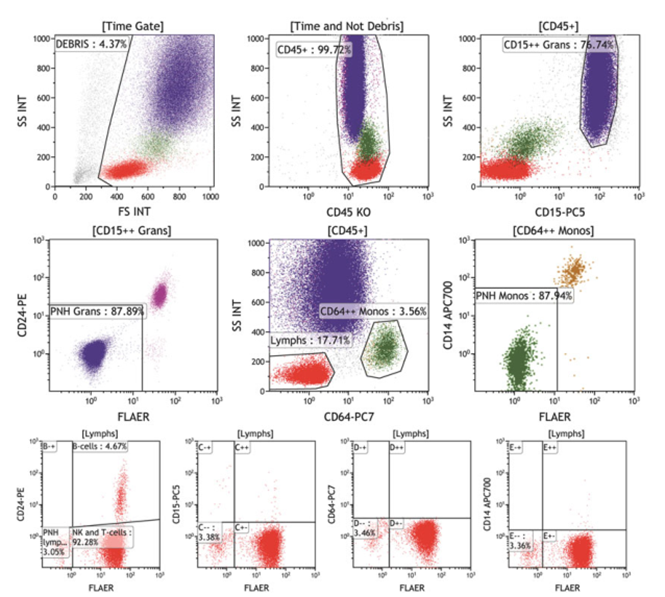
图7,以FLAER /CD24/ cd14为基础的WBC检测,中性粒细胞和单核细胞中存在PNH克隆。样品用FLAER -Alexa 488/CD24-PE/CD15-PC5/CD64-PC7/CD14-APC700/CD45-KrO染色。
△点击放大图片
五色和六色WBC检测(中性粒细胞和单核细胞)推荐染色方案及仪器设置
建议样品在新鲜或在4℃下最大存储时间为48小时后进行染色。具体方案如下:
1. 使用反向移液,将100 μl新鲜外周血小心地移入试管底部,不要接触试管的侧面。
2. 在试管底部直接向血液中加入适量预混并经过验证的混合物,按照上述RBC检测方法,轻柔但彻底地混合。
3.在黑暗中孵育20分钟(已验证孵育时间可达60分钟)。
4. 使用合适的裂解剂裂解红细胞。注含有固定剂的裂解液可能比那些不含的能更好地保持细胞完整性。
5. 裂解后,用PBS清洗细胞一次,在1ml PBS中重悬并在上机。注意:应立即采集样品,因为延迟会引起光散射变化,特别是在使用无固定物裂解剂时。
6.至少收集50,000个中性粒细胞和5000个单核细胞用于临床测试样本。
7. 如果观察到少量GPI缺陷细胞,则应增加收取次数,直到获得统计上可靠的“PNH表型”数量(20-50个细胞)。
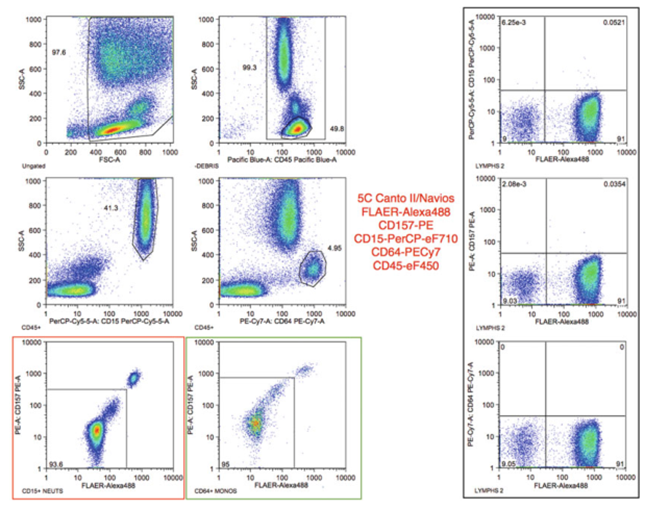
图8,CD157和基于flayer的跨平台检测,PNH克隆存在于中性粒细胞和单核细胞中。样品用fler - alexa 488/CD157-PE/CD15PerCPeFluor710/CD64-PECy7/CD45-eFluor450染色。
△点击放大图片
微小PNH克隆(Minor PNH Clones)
无论谱系如何,当不到1%的目标人群是gpi缺陷时(见图9),PNH克隆大小在历史上被称为“小”。在AA患者和MDS的一些亚群中经常遇到如此小的gpi缺陷细胞群。在临床上,这些患者通常不表现出溶血症状,但AA中存在少量克隆与免疫抑制治疗的更好反应有关。AA患者必须在特定的时间间隔内进行监测,以确定可能的克隆大小扩大,以确定进展为临床PNH的患者。从技术角度来看,相同的PNH RBC和WBC试剂面板可用于筛选所有患者样本。然而,对于那些只包含少量PNH表型的人,公认的最小事件数需要可再现地检测PNH群体并确定检测极限(LOD)为20个PNH事件,可重复量化PNH群体并确定量化下限(LLOQ)的普遍接受的最小事件数是50个PNH事件。
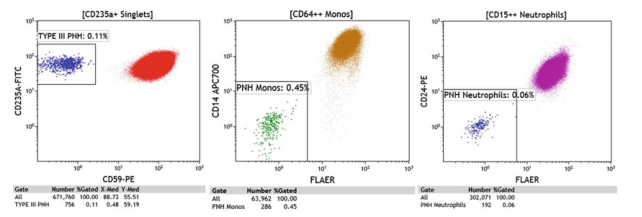
图9. 所有三个谱系的小克隆均显示可量化的PNH克隆(>50个PNH细胞)
△点击放大图片
参考文献
[1] Borowitz MJ, Craig FE, DiGiuseppe JA et al(2010) Guidelines for the diagnosis and moni-
toring of paroxysmal nocturnal hemoglobin-uria and related disorders by flow cytometry.Cytometry B Clin Cytom 78B:211–230 16
[2] Sutherland DR, Richards SJ, Keeney M et al(2015) High-sensitivity detection of PNH red
blood cells, red cell precursors and white bloodcells. Curr Protoc Cytom 72(Unit 6.37):1–29 23
[3] Parker CJ (2007) The pathophysiology of paroxysmal nocturnal hemoglobinuria. ExpHematol 35:523–533
[4] Oni SB, Osunkoya BO, Luzzatto L (1970)Paroxysmal nocturnal hemoglobinuria: evidence for monoclonal origin of abnormal redcells. Blood 36:145–152
[5] Young NS, Calado RT, Scheinberg P (2006)Current concepts in the pathophysiology and
treatment of aplastic anaemia. Blood 108:509–519
[6] Kordasti S, Marsh J, Al-Khan S et al (2012)Functional characterization of CD4+ T cells in
aplastic anemia. Blood 119:2033–2043
[7] Solomou EE, Rezvani K, Mielke S et al (2007)Deficient CD4+CD25+FOXP3+ T regulatory
cells in acquired aplastic anemia. Blood110:1603–1606
[8] Kordasti SY, Afzali B, Lim Z et al (2009)IL-17-producing CD4 (1) T-cells, proinflammatory cytokines and apoptosis are increased inlow-risk myelodysplastic syndrome. Br J Hae-matol 145:64–72 6
[9] Sugimori C, Mochizuki K, Qi Z et al (2009)Origin and fate of blood cells deficient in
glycosylphosphatidylinositol-anchored proteinamong patients with bone marrow failure. Br J
Haematol 147:102–112
[10] Hill A, Rother RP, Wang X et al (2010) Effect of eculizumab on haemolysis-associated nitric
oxide depletion, dyspnoea, and measures of pulmonary hypertension in patients with par-
oxysmal nocturnal haemoglobinuria. Br J Hae-matol 149:414–425
[11] Socie G, Mary JY, de Gramont A et al (1996)Paroxysmal nocturnal haemoglobinuria: long-term follow-up and prognostic factors. FrenchSociety of Haematology. Lancet 348:573–577
[12] Sugimori C, Chuhjo T, Feng X et al (2006)Minor population of CD55-CD59- blood cells
predicts response to immunosuppressive therapy and prognosis in patients with aplastic anemia. Blood 107:1308–1314
[13] Sutherland DR, Keeney M, Illingworth A(2012) Practical guidelines for the high-sensitivity detection and monitoring of paroxysmal nocturnal hemoglobinuria clones by flowcytometry. Cytometry B Clin Cytom82:195–208. and Supplementary Data
[14] Herna´ndez-Campo PM, Almeida J, Sa´nchez ML et al (2006) Normal patterns of expression
of glycosylphosphatidylinositol-anchored pro-teins on different subsets of peripheral blood cells: A frame of reference for the diagnosis ofparoxysmal nocturnal hemoglobinuria. Cytometry B Clin Cytom 70:71–81