外泌体(Exosomes)是细胞分泌到胞外的一种囊泡(Extracellular Vesicles,EVs),其大小为30-150nm,具有双层膜结构和茶托状形态,含有丰富的内含物(包括核酸、蛋白和脂质等),参与细胞间的分子传递。
2013年,诺贝尔生理学或医学奖授予了三位科学家,表彰其在细胞间囊泡运输调控机制领域作出突出贡献,将外泌体研究的热度推向高潮。
外泌体(Exosome)是由大多数细胞分泌的小膜泡。内泡由细胞室向内出芽形成,称为多泡体(MVB)。当MVB与质膜融合时,这些内部的囊泡被释放为外泌体,外泌体可以将DNA、RNA和蛋白质转移到远处的受体细胞,并影响细胞行为和生理的各个方面。
外泌体广泛存在于细胞培养上清以及各种体液中,包括血液、淋巴液、唾液、尿液、精液、乳汁等,同时也存在于组织样本中,如脑组织、肌肉组织、脂肪组织等。
一 外泌体的生成

图片来源于《Chemical reviews》
△点击放大图片
微泡是由质膜的出芽形成的,膜双层通过磷脂的不对称分布来维持脂质的“多面性”。外层富含磷脂酰胆碱和鞘磷脂,而内层主要由磷脂酰丝氨酸和磷脂酰乙醇胺形成。然而,胞质Ca2+的内流可以破坏这种不对称性,导致磷脂跨膜双层的重新分配,促进膜起泡。依赖Ca2+的蛋白水解同时降解膜相关的细胞骨架,促进出芽过程。
△点击放大图片
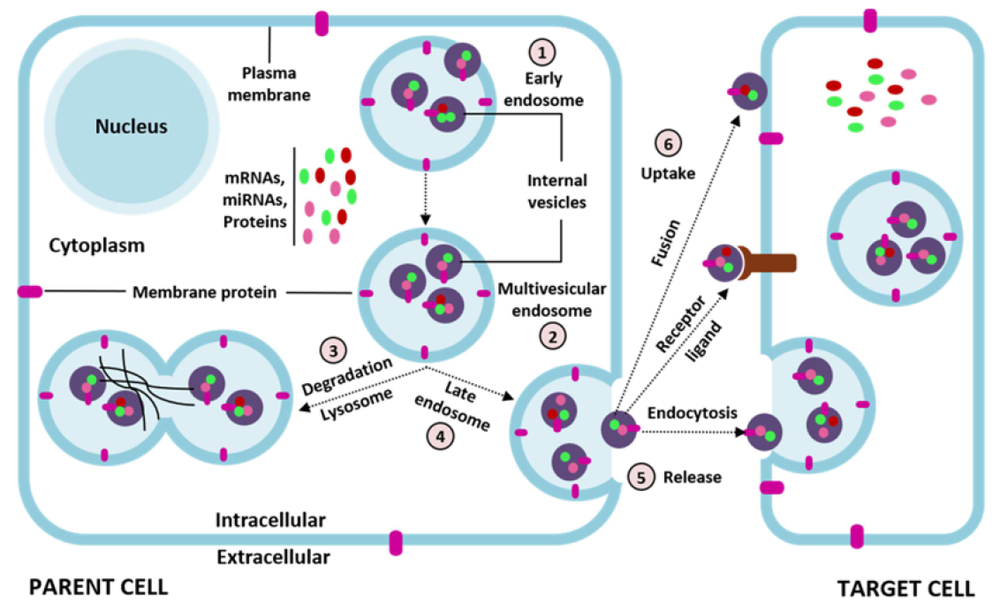
在外泌体形成过程中,首先,MVE(多囊体)向内芽形成小泡,内含来自细胞质的货物(蛋白质、mRNA和miRNAs)。然后,MVE要么与细胞膜融合释放外泌体(内囊泡),要么与溶酶体融合降解MVE含量。到达目的地后,外泌体通过内吞途径或与靶细胞膜融合,将其内容物释放到细胞质中。细胞的膜的囊泡也可以直接从细胞膜上萌发,携带活性蛋白、RNA和其他化合物。
二 不同类型的细胞外囊泡
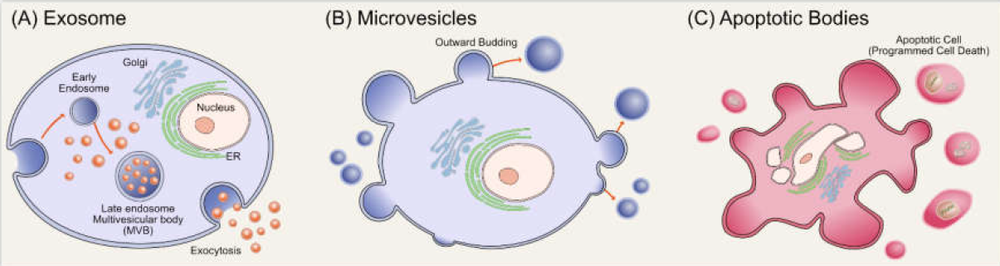
根据其释放机制和大小,EVs分为以下三种类型:外泌体(直径小于150 nm)、MVs/脱落颗粒(100~1000 nm)和凋亡小体(500~4000 nm)。外泌体是细胞外膜囊泡,是细胞外纳米级膜囊泡的一个子集,直径为30 - 150nm。
△点击放大图片
三者如何区分呢?特征上有何区别?

△点击放大图片
三 外泌体的分泌来源
人体中几乎所有类型的细胞均能产生外泌体,包括免疫细胞、神经细胞和干细胞等。

△点击放大图片

△点击放大图片

△点击放大图片
四 外泌体的组成&成分
△点击放大图片
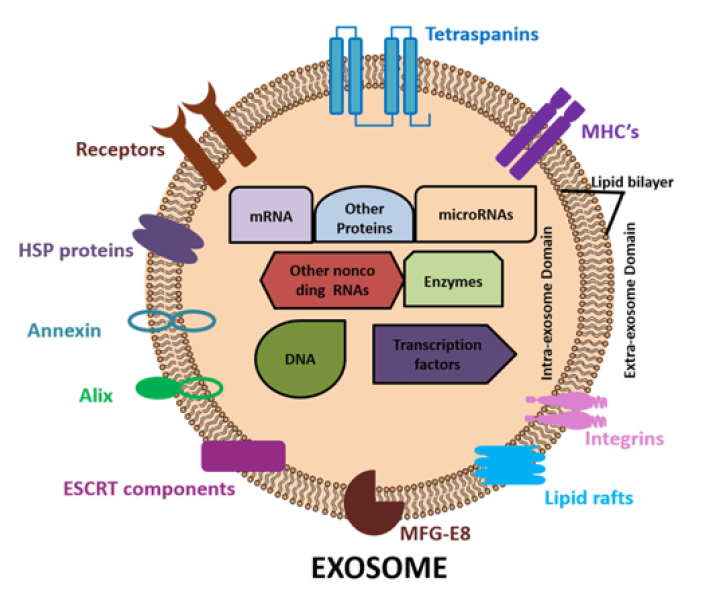
外泌体成分取决于来源、宿主健康和细胞外刺激。外泌体成分可以从原细胞转移到靶细胞。外泌体包含多种细胞成分,包括mRNA、miRNAs、HSP90和HSP70等。
五 外泌体结构特性
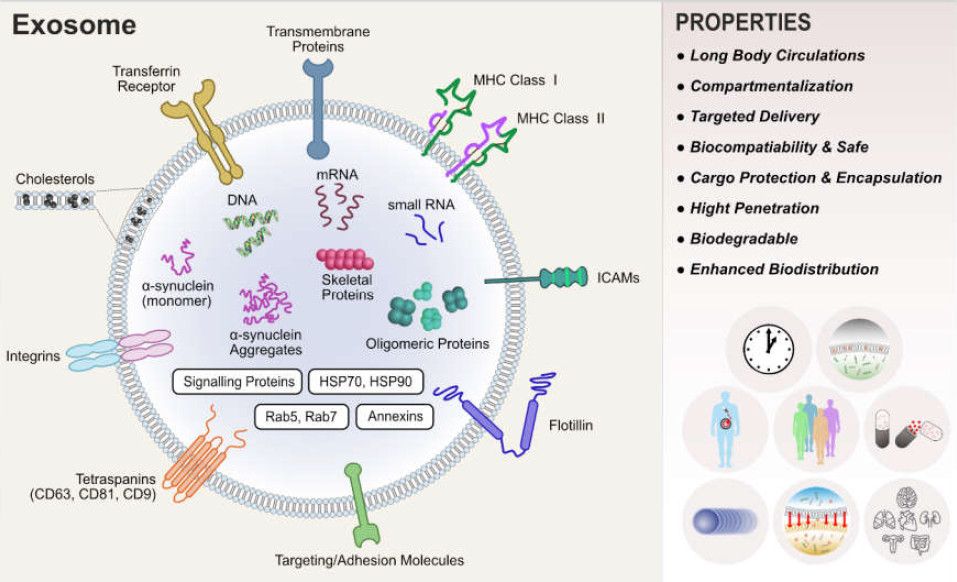
△点击放大图片
细胞外囊泡(EVs)是一个包含细胞“货物”的宝库。微囊泡的膜组成与它们的生物发生相一致,最能反映亲本细胞的质膜。相反,在外泌体中发现了一种特定的内泌体蛋白质亚群,表明外泌体发育过程中存在分选机制。转运所需的内体分选复合物(ESCRT)被广泛认为是调控和引导特定分子进入MVBs腔内囊泡的途径。ESCRT,其4个主要复合物(ESCRT 0, I, II,和III)负责传递用于溶酶体降解和蛋白质回收的泛素化蛋白。最近的研究表明,特异性ESCRT家族蛋白的缺失可以改变外泌体的蛋白质含量和细胞释放外泌体的速率。更有趣的是,ESCRT系统的组件,如TSG101和Alix,被发现富集于外泌体,因此被用作外泌体鉴定的标记物。
外泌体的生物学功能取决于起源细胞和起源组织或细胞在外泌体产生时的状态。先前的研究表明,外泌体可能像细胞垃圾袋一样,排出多余和/或无功能的细胞成分。此外,内吞囊泡还参与细胞表面蛋白和信号分子的循环。最近的研究表明,外泌体在不同的生物过程扮演重要的角色, 如血管生成、抗原表达、细胞凋亡、凝固、细胞内稳态,炎症和细胞间信号。这些角色归因于能力转移核糖核酸,蛋白质,酶和脂质,从而影响生理和病理过程的各种疾病,包括癌症、神经退行性疾病、感染和自身免疫性疾病。
六 外泌体分离&鉴定方法overview

△点击放大图片
分离纯外泌体对于理解它们的作用机制和它们在生物医学科学中的应用是至关重要的。一些实验室已经成功地利用诸如超离心法、超滤法、层析法、基于聚合物的沉淀法和抗体偶联磁珠的亲和捕获等技术分离外泌体。已有研究表明,密度梯度离心法可以分离出最纯净的外泌体。(我们会在第二期外泌体实验解决方案中做详细介绍,请大家继续follow关注哦)
七 外泌体的主要应用
1983年外泌体首次于绵羊网织红细胞中被发现,但人们一直认为它只是一种细胞的废弃物。然而最近几年,人们发现这种微小膜泡中含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能。这些发现点燃了人们对细胞分泌膜泡的兴趣。最近的研究发现外泌体在很多生理病理上起着重要的作用。

△点击放大图片
外泌体由细胞在正常和病理条件下释放。携带几种类型的货物分子,如核酸和蛋白质,因此,被认为是至关重要的生物标志物的发现对于临床诊断。载有肿瘤特异性RNA的外泌体被用作癌症诊断的生物标志物,外泌体蛋白被认为是多种疾病的潜在生物标志物,包括癌症、肝脏疾病和肾脏疾病。它们含有多种生物标志物,如TSG101、带电荷的多泡体蛋白2a (CHMP2A)、RAS相关蛋白Rabb - 11b (RAB11B)、CD63和CD81蛋白和脂类,包括胆固醇、鞘磷脂、神经酰胺和磷脂酰丝氨酸。
外泌体的大分子成分在细胞功能和病理状态中发挥重要作用,如炎症、免疫反应、血管生成、细胞死亡、神经退行性疾病和癌症。
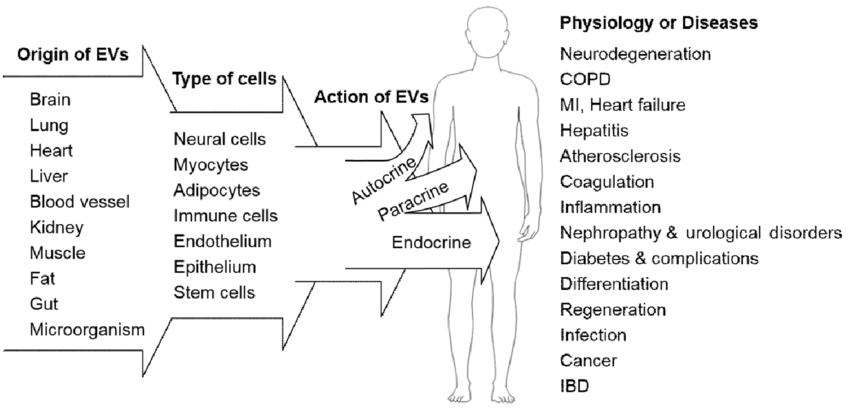
△点击放大图片
细胞外囊泡(EV)作为调节正常细胞功能或疾病发病机制的多功能效应器。它起源于大多数组织,由各种类型的细胞分泌,这些细胞与邻近的细胞(自分泌和旁分泌作用)或远端的(循环因子)细胞进行信息“交流”。除了调节相邻或远端细胞的生理功能外,通过循环的细胞间通信可能有助于疾病的发展和进程,疾病的缓解或保护组织免受损伤。因此,外泌体及其在体液中的分子含量可能是候选的疾病生物标志物或治疗靶标。比如COPD(慢性阻塞性肺疾病);MI(心肌梗塞);IBD(炎症性肠病)。
01.癌症

△点击放大图片
受体细胞中缺氧肿瘤微环境(TME)衍生的外泌体

△点击放大图片
缺氧TME刺激肿瘤细胞分泌外泌体,从而调节多种细胞类型。摄取包含各种RNA(如microRNAs和长基因间非蛋白编码RNA,重编程调节器[linc-RoR])和蛋白质(如缺氧诱导factor-1α)促进上皮-间质转化、侵袭和转移。缺氧来源的外泌体也调节免疫细胞,如巨噬细胞、骨髓来源的抑制细胞、树突状细胞和淋巴细胞的功能。内皮细胞和成纤维细胞对缺氧外泌体的内吞作用分别促进血管生成和癌症相关的成纤维细胞表型分化。
02.诊断和治疗

△点击放大图片
外泌体的诊断和治疗应用
外泌体在癌症、神经退行性疾病、肝脏和肾脏疾病以及多种心肺疾病的预后和诊断中发挥着重要作用,最近的研究表明,外泌体也是一种新型的治疗试剂。来自间充质干细胞的外泌体已在各种疾病模型中进行了测试,如呼吸系统、心血管、神经系统、肌肉骨骼、肝脏、胃肠道、皮肤和肾脏疾病。
MSC来源的外泌体通过抑制促炎细胞因子的表达来发挥抗炎作用,并通过增强细胞外基质重塑来促进组织再生, 同样,由诱导的多能干细胞、胚胎干细胞和心脏祖细胞分泌的外泌体具有类似于MCS来源的外泌体的治疗效果。
03.免疫治疗&细胞修饰
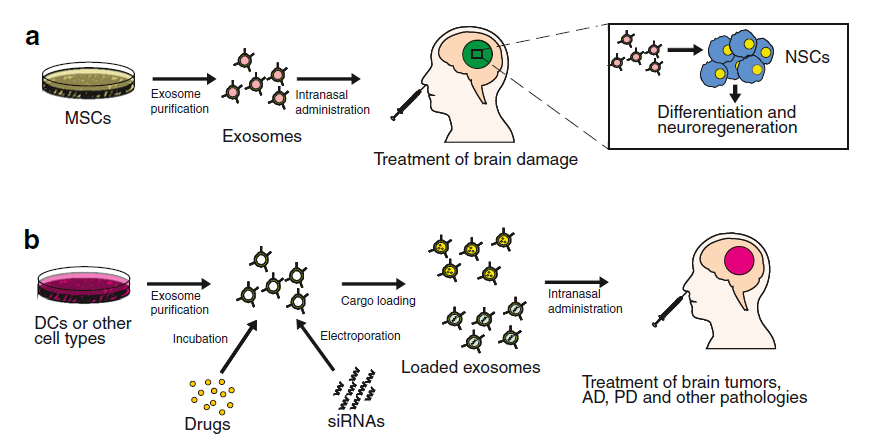
△点击放大图片
外泌体用在MSC和DC治疗
a. 外泌体从培养的间充质干细胞上清中纯化,并通过鼻内途径给予。外泌体与神经干细胞(NSC)融合,从而诱导NSC的分化,可能导致神经再生。
b. 从树突状细胞(DC)或其他类型的细胞上清纯化的外泌体可分别通过孵育或电穿孔的方式装载药物或siRNAs。经修饰的外泌体可用于鼻内治疗脑肿瘤、阿尔茨海默病(AD)或帕金森病(PD)等疾病。
04.药物加载载体
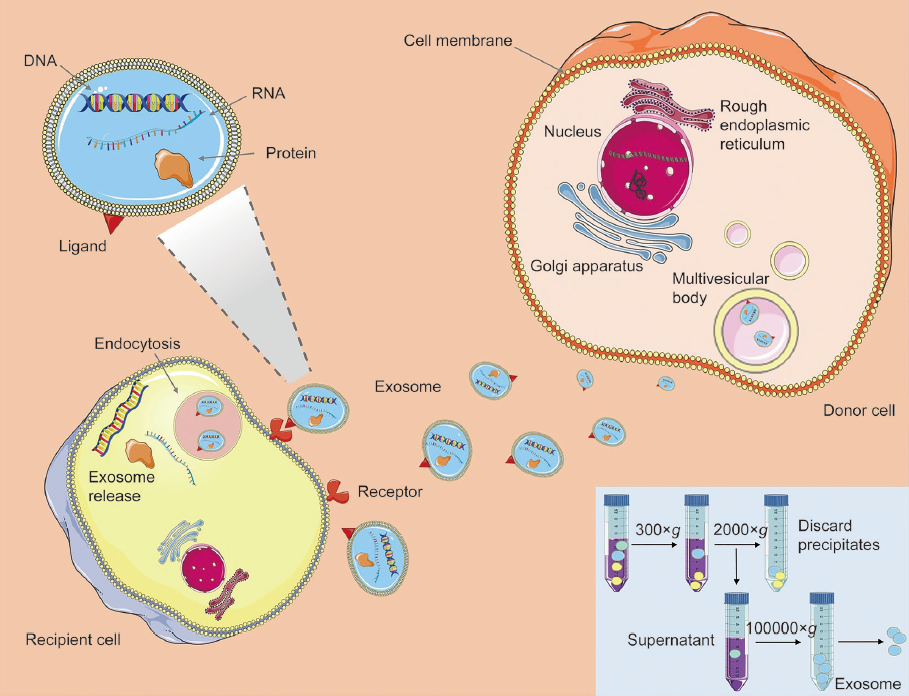
△点击放大图片
细胞外囊泡(EVs)作为具有生物活性的在细胞间进行物质传递的系统,具有成为治疗;药物载体的巨大潜力,此外,它们还可以用于递送特定的物质,或通过工程学手段进行;改造增加其被摄取的能力。
八 相关文献
01.超全细胞外囊泡研究方法综述

△点击放大图片
该综述发表在Chemical reviews 杂志上,该综述对于细胞外囊泡的研究方法总结得非常全面,包含EVs形成、特理特征、分析、临床应用等。全文34页,参考文献近300篇。无论你是外泌体小白还是老司机,这篇综述绝对值得一读!
02.细胞外囊泡与血管形成

△点击放大图片
来源于各种细胞类型的EVs有可能向内皮细胞传递复杂的信息,并诱导促血管形成抑或抑制血管形成的信号。作为动态系统,根据局部微环境的变化,EVs所包含的物质会相应改变以调整血管形成的过程。该文对目前关于不同细胞来源的微泡和外泌体在血管生成中的作用进行综述,特别强调了其基本机制,并对其治疗应用存在的主要挑战和先决条件进行了讨论。
03.小细胞外囊泡在癌症中不断发展的转化应用能力

△点击放大图片
重点介绍了癌症sEV领域在生物标志物发现和验证,以及基于sEV的治疗方面所取得的进展,强调了我们正在面临的挑战,并指出了我们的知识差距,这些差距目前阻碍了我们充分发挥sEV用于癌症诊断和治疗的潜力。
04.药物递送--细胞外囊泡vs合成纳米颗粒

△点击放大图片
市场上大多数纳米药物是简单的脂质体。尽管脂质体在临床上用于递送多种治疗剂,但实现纳米递送以改善患者预后的真正潜力仍在等待更复杂的多功能设计的实现。细胞外囊泡(EVs)是细胞释放的天然纳米颗粒。EVs的大小、形状和结构类似于脂质体,但具有更复杂的双层结构。EVs可以从培养细胞的条件培养基中或从生物组织或液体中获得,并且各种方法(例如电穿孔、挤压和超声处理)已用于将治疗剂加载到EVs中。然而,由于EV分离和表征方面的挑战,EV在药物递送中的潜力仍然不确定,这阻碍了基础研究和转化研究。尤其是,EV类型之间的异质性以及其他具有重叠特征的生物纳米颗粒的存在使EV的分离变得困难。此外,就生物相容性和部位特异性递送而言,应谨慎过早将EV描述为优于合成纳米颗粒的药物载体。
05.外泌体携带siRNA靶向KRAS治疗胰腺癌
Sushrut Kamerkar et al. Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer. Nature, 2017.doi:10.1038/nature22341
KRAS的突变是胰腺癌的关键驱动因素,是一个潜在治疗靶点。外泌体是由所有细胞产生的细胞外囊泡,并且天然存在于血液中。与小鼠体循环里的脂质体相比,外泌体更容易在循环中保存,这是因为CD47介导的外泌体能够避免单核细胞和巨噬细胞的吞噬作用。正常成纤维细胞样的间充质细胞分泌的外泌体被工程化,并包裹KRAS G12D突变体的siRNA或shRNA。与脂质体相比,工程化的外泌体(称为iExosomes)能够靶向KRAS G12D,并且CD47对其有增强效果。在胰腺癌的多种小鼠模型中,通过iExosomes的治疗可以抑制肿瘤,并显着增加总生存期。研究人员的研究结果表明使用iExosomes是一种直接和特异性靶向癌基因KRAS的方法,从而治疗胰腺癌。