细胞外囊泡( (EVs) )是一种异质膜结合小泡,在细胞通讯中起着至关重要的作用并介导多种生理和病理过程,有潜在的治疗和诊断作用。
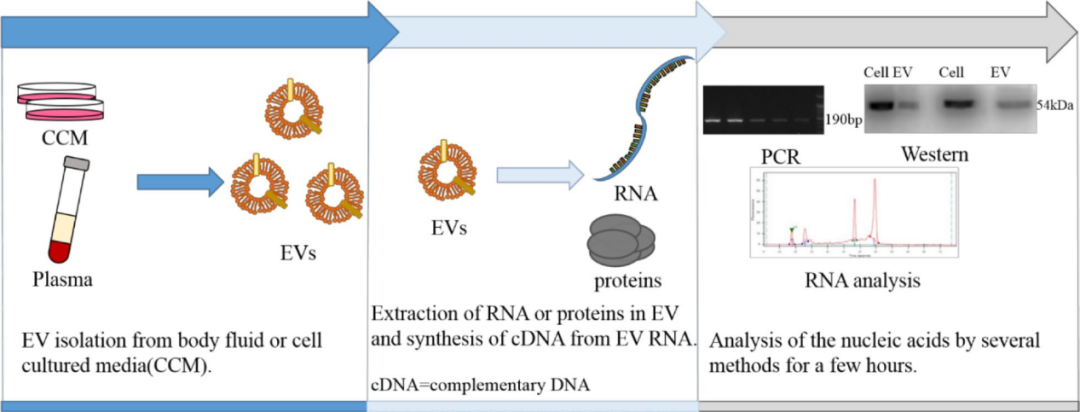
(外泌体实验workflow)
△点击放大图片
随着 EVs特性和功能研究增多,已经开发了许多 EVs的分离和纯化方法,包括基于尺寸大小、密度、电荷和亲和力等分离纯化EVs技术。由于单一技术的局限性,组合或联用技术已被用于 EVs的分离纯化,以产生最佳质量的 EVs。今天小编就和大家一起看看常见的 EVs分离和纯化方法。

△点击放大图片
1:Differential centrifugation:差速离心
2:Density-gradient centrifugation:密度梯度离心
3:Size exclusion:尺寸排阻
4:Magnetic activated :磁珠分选
5:Polymer-Based: 多聚物依赖
6:Immunological Methods:免疫学方法
7、Microfluidics:微流控
8、ExoCap Kit:外泌体提取试剂盒
一 超速离心(Ultracentrifugation)
超速离心(UC)是一种经典的方法,使用强大的离心力来分离EVs。EVs因离心力下沉并聚集在超速离心管底部。超速离心根据分离原理可以分为差速超速离心和密度梯度超速离心。

Fig.1 差速超速离心和密度梯度离心。超速离心需要超高速离心力,是一种普遍的分离EVs的方法;相对而言,密度梯度离心分离可以分离出较少杂质的EVs。
△点击放大图片
二 免疫亲和(Immunoaffinity)
免疫亲和是利用抗体和 EVs表面蛋白之间的相互作用来分离EVs。常见的方法包括:流式法、磁珠法、试剂盒法等。
EVs表面蛋白(如CD9、CD81、CD63、TSG101、Alix) 与特异性偶联抗体结合,从而捕获EVs。基于免疫亲和力分离的 EVs可以区分 EVs的亚群。例如,T淋巴细胞特异性抗体在免疫亲和中很常见;用抗CD81抗体的酶联免疫吸附试验已被用于定量肺癌患者血浆中的EGFR水平。

Fig. 2 使用抗体结合磁珠的分离方法。在EV中与抗体和表面蛋白的相互作用是免疫亲和性的关键因素。免疫亲和方法能够鉴定包括EV阳性标记在内的蛋白质
△点击放大图片
免疫亲和法提取的EVs比超速离心法产率、纯度高,但是抗体价格较贵,不适合大样本,且EVs从磁珠分离这一步可能会损坏EVs。单一的免疫亲和不能对EV分类,如外体、微泡、凋亡小体等,膜上都有EpCAM,在这些囊泡中检测到相同的外体标记,但是它们具有不同的特征。未来的研究应开发免疫亲和方法,将表面蛋白的同一性与EVs的功能和特性联系起来。
三 过滤和色谱
过滤和色谱是利用EVs尺寸大小(Size exclusion)差异来分离EVs。
过滤是在膜上捕获EVs,同时允许蛋白质等其他颗粒物通过。这种方法需要适当选择孔径。过滤通常与超速离心分离或其他分离方法结合使用,如压力驱动方法、电泳或超速离心 。
尺寸排阻色谱(SEC)使用填充有带孔的小珠的色谱柱,小珠上孔径小于EVs。比孔径小的颗粒进入它们并缓慢移动,而比孔径大的颗粒绕过珠子并迅速离开柱子。含有样品的级分按由大到小递减的顺序依次洗脱。使用SEC分离时,蛋白质和EVs的聚合产物最小,EVs的功能通常不受影响。但基于成分大小的过滤或SEC分离方法很难区分大小相似但特性不同的颗粒。

Fig.3 用(a)过滤器和(b)色谱法进行尺寸排阻。通过大小排除对目标大小的EVs进行排序。(a)过滤分离方法需考虑大小囊泡的孔径。(b)色谱分离。EVs小颗粒进入孔隙并缓慢移动,而大颗粒快速通过柱子。收集含EVs的溶液。
△点击放大图片
四 沉淀-聚合沉淀
目前已经开发了多种使用聚合物的方法来简化分离过程并减少分离时间。
双水相系统(ATPS)已用于分离EVs(图6)。样品与双水相溶液(聚乙二醇和葡聚糖)完全混合后,混合物以3000×g离心10-30分钟。EVs向葡聚糖相移动。ATPS快速简单,不需要任何培养过程。在几种生物液体中,ATPS显示出比超速离心更高的EVs回收率。但由于EVs是在含葡聚糖的溶液中分离的,因此需要去除葡聚糖。ATPS在大约15分钟内就可以分离出无聚合复合物污染的高质量EVs。
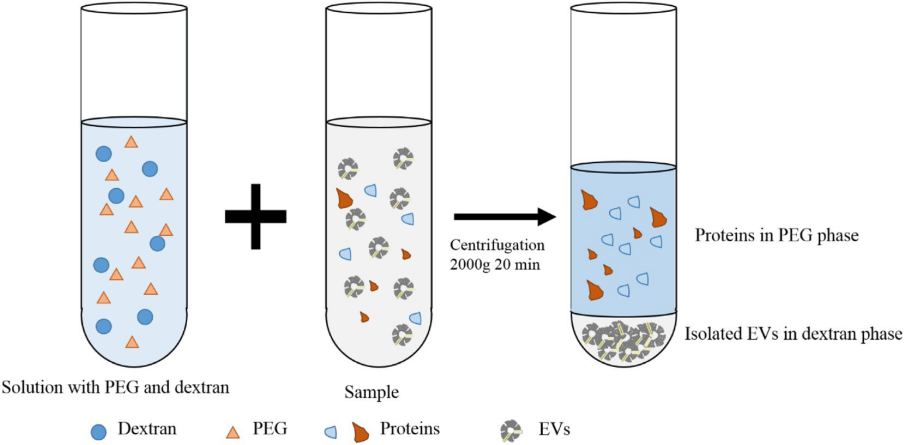
Fig.4 双水相系统(ATPS)分离方案。EVs进入葡聚糖相,其表面特性对EVs有利。ATPS根据样品的沉淀特性提纯EVs,无需昂贵的设备或大型样品。
△点击放大图片
五 蛋白质有机溶剂沉淀(PROSPR)
蛋白质有机溶剂沉淀是一种使用有机溶剂(丙酮、氯仿、三氯乙酸)快速沉淀EVs的方法。生物体液包含大量蛋白质、可溶性因子和脂蛋白。从生物流体中去除蛋白质是EVs分离的重要要求。具有亲水和疏水区域的蛋白质在水溶液中具有一定电介质强度。有机溶剂被相反电荷的氨基酸残基吸引并促进蛋白质聚集。离子对效应有助于PROSPR的沉淀效率。此外,含有盐的有机溶剂可以提高蛋白质的去除率。PROSPR相对超速分离法,蛋白质污染较少,并且可以避免高转速导致的外泌体损失。
六 微流控技术
微流控装置可以在微小的通道内诱导液体流动从而可分离EVs。微流控装置很小,只需要少量样品,降低了成本、处理时间和试剂消耗,分离产物纯且分离速度更快,还能保持EVs形态。微流控技术通过免疫亲和、网筛或在多孔结构中捕获EVs。微流控装置已经与免疫亲和方法结合来检测诊断标记物。涂覆在装置表面的抗体提高了EVs捕获的效率。带有滤膜的微流控装置可以去除细胞和细胞碎片,从而纯化EVs(图7b)。过滤可分为压力驱动或电泳驱动。压力驱动过滤使用注射泵;通常使用孔径为500纳米的过滤膜,因为如果孔径小于500纳米,EVs会堵塞过滤器。电泳驱动的过滤利用EVs的负电荷磷脂膜来移动它们穿过过滤膜,而蛋白质或其他分子由于氨基酸的侧链而具有不同的电荷。EVs穿过滤膜并被分离到收集溶液中。
微流控系统分离EVs仍处于发展的早期阶段,但是许多微流控装置已经证明这是分离EVs的有效方法。

Fig.5 微流控系统。微流控技术分为免疫亲和法、EVs筛分法和多孔结构EVs捕获法。EVs的捕获是通过结合通道上的特异性抗体来实现的。带有抗体的装置提高了EVs捕获效率。b .过滤孔径约500纳米的微流控分离游离的EVs。EVs有带负电荷的磷脂膜,因此可以穿过过滤膜。
△点击放大图片
小结
EVs分离方法各有特点,根据实验目的,选择合适的分离方法可以提高分离的有效性。例如,免疫亲和可以检测特定的EVs,但不适用于大容量样本。在急性临床应用中,该方法必须快速且廉价,以便在紧急情况下使用。此外,纯化过程必须分离完整的EVs。EVs中的遗传信息通常是不稳定的,因此受损的EVs可能在精确的实验中没有用。许多研究已经在疾病诊断、疾病监测和预测跟踪中使用了EVs。使用EVs进行诊断的优势在于,它们可以通过微创活检从体液中分离出来。最小化侵入性诊断优于导致出血和疼痛的传统侵入性诊断,EVs还可以用作疾病治疗中药物输送的载体。干细胞分泌的 EVs可以作为一种无细胞方法诱导组织再生。
综上所述,EVs分析的临床应用将会扩大,不断探索基于EV的诊断和预后生物标志物,将提高对疾病发病机制的理解。后续我们会针对不同的分离&纯化方法给出具体的操作步骤Protocol,欢迎持续关注我们~
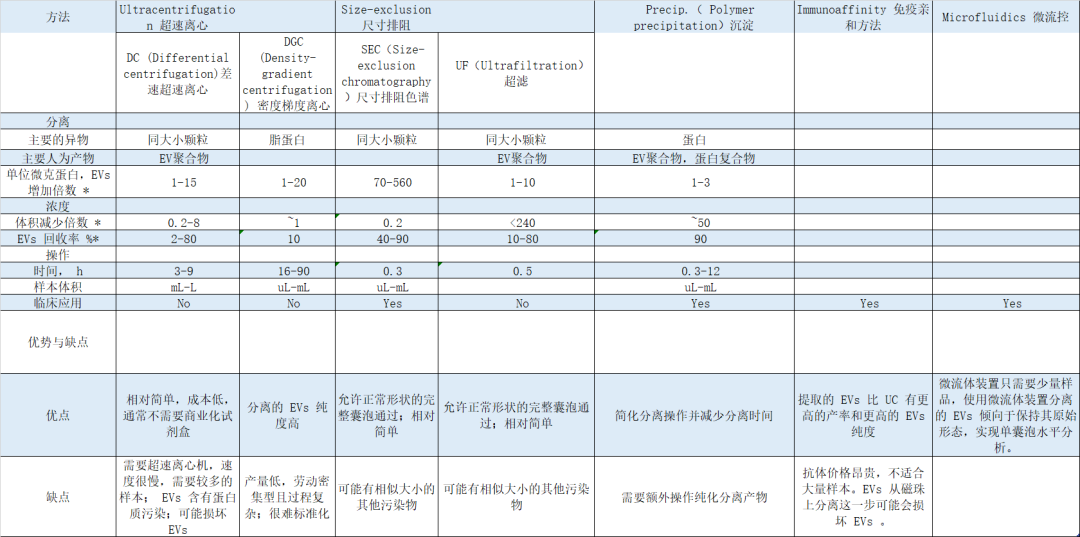
Table 1. 不同分离纯化外泌体方法比较
△点击放大图片
参考文献
1. Kang H , Kim J , Park J . Methods to isolate extracellular vesicles for diagnosis[J]. Micro & Nano Systems Letters, 2017, 5(1):15.
2. Liangsupree T , Multia E , Riekkola M L . Modern isolation and separation techniques for extracellular vesicles[J]. Journal of Chromatography A, 2020.
3. M. Mathieu, L. Martin-Jaular, G. Lavieu, C. Théry, Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication, Nat. Cell Biol 21 (2019) 9–17, doi: 10.1038/s41556- 018- 0250- 9
4. D. Povero, H. Yamashita, W. Ren, M.G. Subramanian, R.P. Myers, A. Eguchi, D.A. Simonetto, Z.D. Goodman, S.A. Harrison, A.J. Sanyal, J. Bosch, A.E. Feldstein, Characterization and Proteome of Circulating Extracellular Vesicles as Potential Biomarkers for NASH, Hepatol. Commun 4 (2020) 1263–1278, doi: 10.1002/hep4.1556 .
5. E.A. Mol, M.J. Goumans, P.A . Doevendans, J.P.G. Sluijter, P. Vader, Higher functionality of extracellular vesicles isolated using size-exclusion chromatography compared to ultracentrifugation, Nanomedicine Nanotechnology, Biol. Med 13 (2017) 2061–2065, doi: 10.1016/j.nano.2017.03.01 1 .
6. I.M. Rood, J.K.J. Deegens, M.L. Merchant, W.P.M. Tamboer, D.W. Wilkey, J.F.M. Wetzels, J.B. Klein, Comparison of three methods for isolation of urinary microvesicles to identify biomarkers of nephrotic syndrome, Kidney Int 78 (2010) 810–816, doi: 10.1038/ki.2010.262 .