01介绍
外泌体(Exosome),是由多种类型的细胞,如T、B、NK细胞、以及肿瘤细胞等分泌的一种囊泡状结构,直径在30-100nm之间,又称膜外小体(Extracellular Vesicles, EVs)。外泌体常携带其起源细胞的多种生物分子,包括蛋白质、脂类和核酸,因此,外泌体参与了多种生物学过程,包括免疫监控、血液凝固、神经传递、干细胞维护和组织修复等。
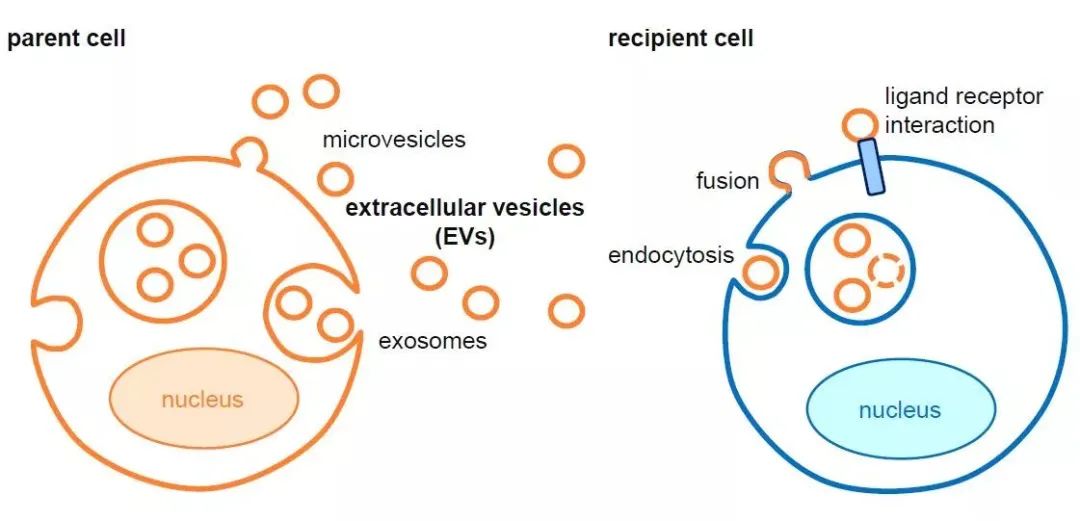
外泌体形成和作用方式示意图
△点击放大图片
上期小编和大家一起看了常见的EVs分离和纯化方法。本期专门讲解磁珠分选方法对外泌体纯化和分析,帮助大家梳理实验流程,能够轻松快速的分离和纯化外泌体,希望对大家有所帮助。
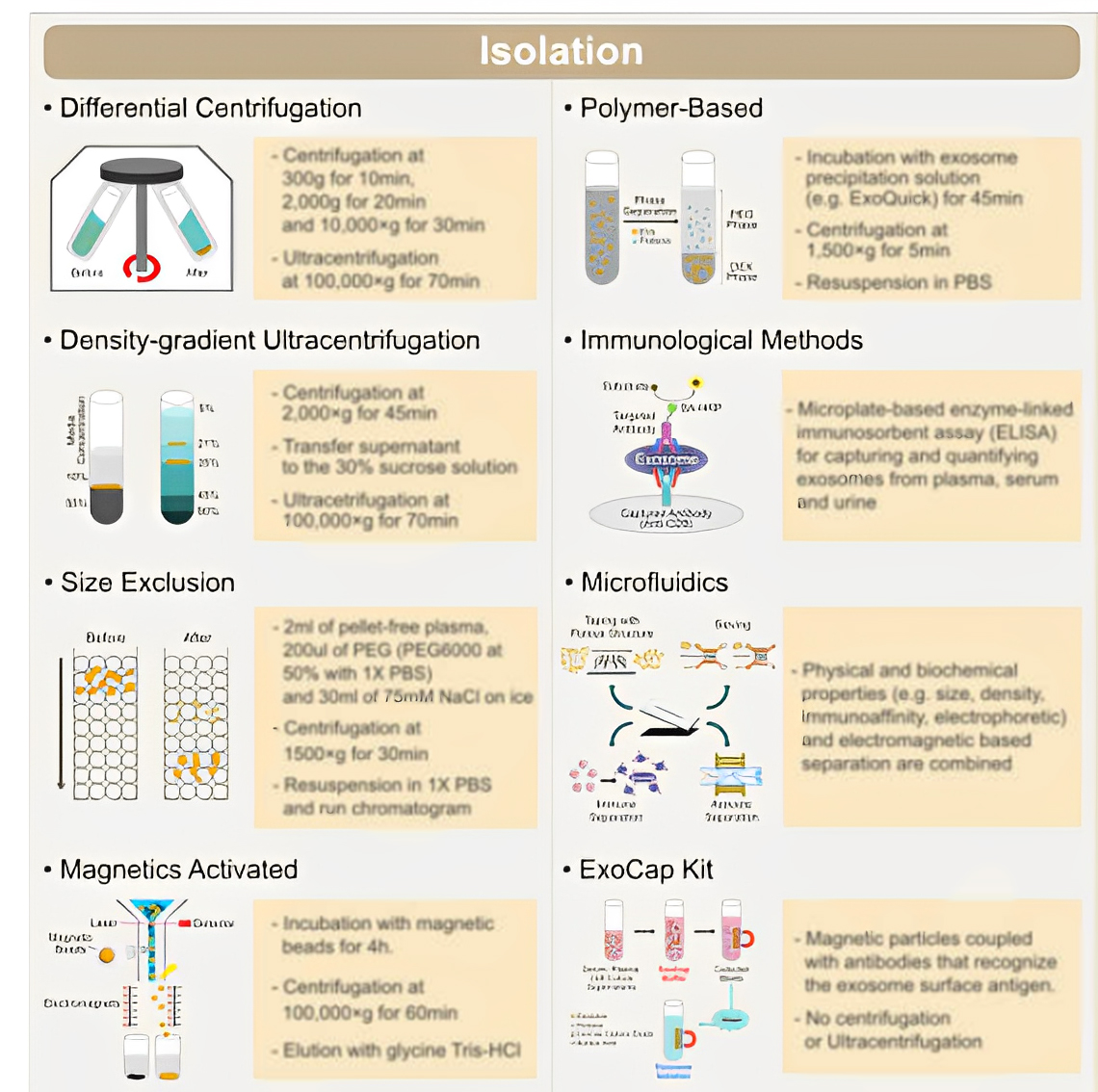
磁珠分选
△点击放大图片
02外泌体分离纯化研究
外泌体纯化:难
调查发现,约有56%的实验室采用超速离心法分离外泌体,但该方法有其局限性:
·耗时耗力:需8-30个小时
·处理样本少:每次最多处理6个样品
·需要大量的起始材料
·产量不高
外泌体的磁珠分离
基于美天旎的MACS技术,利用外泌体表面常见的四次跨膜蛋白CD9、CD63和CD81,分别研发了四款磁珠试剂盒,用于阳性分选外泌体,简单三步(磁珠孵育、磁场分离、洗脱),省时省力,无需进行超速离心,且样本体积最小可至0.5mL。
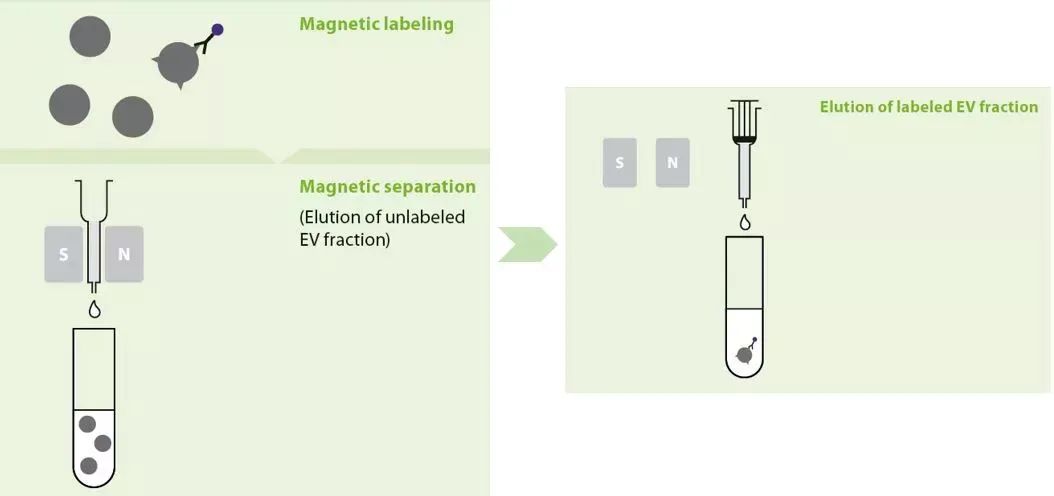
利用美天旎Exosome isolation kit,简单三步(磁珠孵育、磁场分离、洗脱),1.5h内完成外泌体的纯化。
△点击放大图片
03Protocol分享
3.1样本制备
外泌体分离试剂盒可用于预先清除的细胞培养上清液或预先清除的体液,如血浆、腹水或尿液,以及从EV制备中分离携带相应标记的外泌体,例如,从超离心法或密度梯度离心法。
预先分离细胞培养上清
1 在无血清培养基中孵育目标细胞12–72小时,具体取决于细胞系。调整孵化率条件下细胞凋亡率低于5%。
2 依次通过300xg离心10分钟,2000xg离心30分钟,10000xg离心45分钟连续离心,清除细胞、细胞碎片和较大的囊泡。分别取上清液,进行下一步的离心。
3 (可选)用0.22µm尼龙网过滤上清液。
预分离血浆
1 将血液加入EDTA或柠檬酸盐管中。
2 在1,000×g离心10分钟分离血浆。
3 用等体积的PBS稀释血浆。
4 依次通过2000×g离心30分钟,10,000×g离心45分钟连续离心,去除细胞碎片和较大的囊泡。分别取上清液,进行下一步的离心。
预先分离尿液或腹水
1 依次通过300×g离心10分钟,2000×g离心 30分钟,10,000×g离心45分钟的连续离心,去除细胞、细胞碎片和较大的囊泡。分别取上清液,进行下一步的离心。
2 (可选)用0.22µm尼龙网过滤上清液。
3.2 磁性标记
注:以下给出的磁标记容量为2ml含外泌体的样品,如预先清除的细胞培养上清,血浆,尿液,腹水等。
1 将50µL的外泌体分离微珠加入到含外泌体的样品中并涡流。
2 室温孵育1小时。
3 进行磁选(3.3)。
3.3磁选
注:
·在继续进行下一步之前,始终要等待,直到分选柱储池为空。
·使用前预热平衡缓冲液和隔离缓冲液至室温。
1 在μMACS Separator分选器上放置μ柱。
2 用100µL的平衡缓冲液制备分选柱。
3 用3×100 µL隔离缓冲液冲洗分选柱。当分选柱储池为空时才添加新的缓冲液。
4 将磁性标记的样品上柱,使其通过。
5 洗涤分选柱用4×200µL的隔离缓冲。当分选柱储池为空时才添加新的缓冲液。
6 (可选)用移液器尖端接触柱尖端,去除柱尖端上的任何残留液滴。
7 进行外泌体的洗脱(3.4)。
3.4洗脱
用磁选器外柱洗脱外泌体,获得完整的囊泡。
洗脱完整的外泌体
注:洗脱后的外泌体仍然附着在微珠上,可能会干扰下游分析,如纳米颗粒跟踪分析或电子显微镜,外泌体和微粒,将被分析。
从磁选机中取出柱,将柱放置在1.5 mL的试管上。加入100µL隔离缓冲液冲柱,并立即用柱塞冲出磁标记囊泡。
相关产品
| 产品名称 | 货号 | 规格 |
| Exosome lsolation Kit CD9, human | 130-110-913 | 20 isolations |
| Exosome lsolation Kit CD63, human | 130-110-918 | 20 isolations |
| Exosome lsolation Kit CD81, human | 130-110-914 | 20isolations |
| Exosome lsolation Kit Pan, human | 130-110-912 | 20 isolations |
04小结
想不到吧,一个试剂盒简单搞定外泌体的分离研究,让您遇到困难不用怕,后续我们会针对不同的分离&纯化方法给出具体的操作步骤Protocol,欢迎持续关注我们~
参考文献
1. Raposo, G. and Stoorvogel, W. (2013) Extracellular vesicles: exosomes,microvesicles, and friends. J. Cell Biol. 200 (4): 373–383.
2. Caby, M. P. et al. (2005) Exosomal-like vesicles are present in human bloodplasma. Int. Immunol. 17 (7): 879–887.
3. Aalberts, M. et al. (2012) Identification of distinct populations of prostasomesthat differentially express prostate stem cell antigen, annexin A1, and GLIPR2 in humans. Biol. Reprod. 86 (3): 82.
4. Pisitkun, T. et al. (2004) Identification and proteomic profiling of exosomes in human urine. Proc. Natl. Acad. Sci. U. S. A. 101 (36): 13368–13373.
5. Ogawa, Y. et al. (2011) Proteomic analysis of two types of exosomes in human whole saliva. Biol. Pharm. Bull. 34 (1): 13–23.
6. Admyre, C. et al. Exosomes with immune modulatory features are present in human breast milk. J. Immunol. 179 (3): 1969–1978.
7. Andre, F. et al. (2002) Malignant effusions and immunogenic tumour-derived exosomes. Lancet 360(9329): 295–305.
8. Street, J. M. et al. (2012) Identification and proteomic profiling of exosomes in human cerebrospinal fluid. J. Transl. Med. 10: 5.
9. Thery, C. et al. (2009) Membrane vesicles as conveyors of immune responses. Nat. Rev. Immunol. 9 (8): 581–593.
10. Thery, C. et al. Exosomes: composition, biogenesis and function. Nat. Rev. Immunol. 2 (8): 569–579.
11. Koliha, N. et al. (2016) A novel multiplex bead-based platform highlights the diversity of extracellular vesicles. J. Extracell. Vesicles 5: 29975.
12. Koliha, N. et al. (2016) Melanoma affects the composition of blood cell-derived extracellular vesicles. Front. Immunol 7: 282.