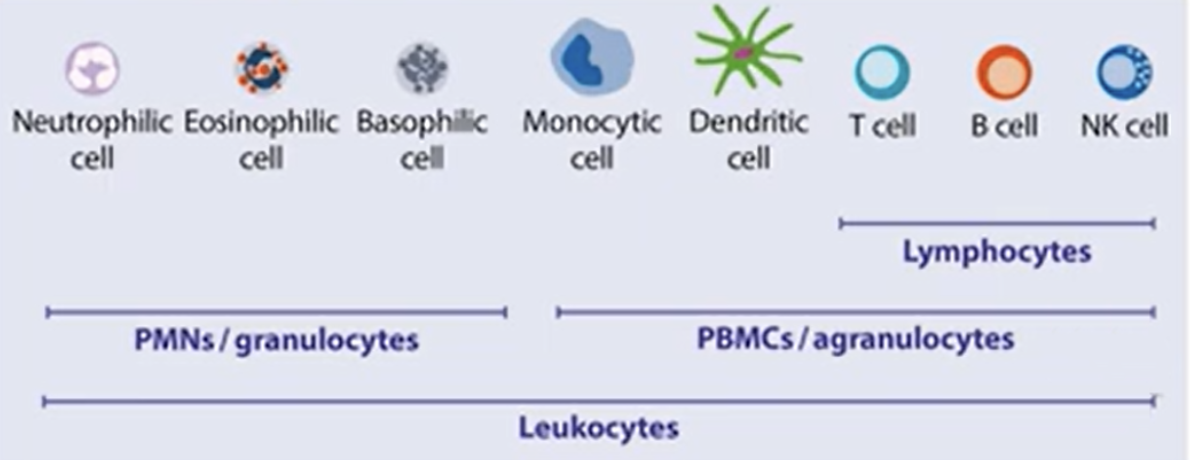
外周血单个核细胞(PBMC)是免疫学中最常用的生物标本之一[1] , 主要由几类免疫细胞组成,包括 T 细胞 (~70%)、B 细胞 (~15%)、单核细胞 (~5%)、树突状细胞 (~1%) 和自然杀伤 (NK) 细胞 (~ 10%)。[2][3]
△点击放大图片
图1:细胞类型划分
PBMC也是ELISPOT/FluoroSpot检测中使用最多的样本类型,主要采用密度梯度离心(Ficoll)法进行分离,制备好的PBMC样本可立即使用,也可进行冷冻保存。本期和大家分享PBMC样本分离、冻存及复苏的操作流程,期待能对大家优化实验样本质量有所帮助!

图2:PBMC样本特点
△点击放大图片
一、分离
对于全血的采集,市面上有多种含有不同抗凝血剂的血液采集管,其中肝素管和柠檬酸盐管最适合ELISPOT(EDTA通过钙螯合抑制凝血,钙螯合在抗原特异性再刺激期间会损害细胞因子诱导),采集后的样本应在室温(20-26℃)条件下,储存不超过8小时。

图:3:肝素钠采血管(左)&柠檬酸盐采血管(右)
△点击放大图片
材料准备
1. 血液样本(全血或血白膜层);
2. Ficoll-Paque试剂(无菌);
3. 常温离心机;
4. 移液管(无菌,塑料材质玻璃材质);
5. 自动移液器和无菌吸头;
6. PBS,无菌或无血清的培养基(例如RPMI1640);
7. 聚丙烯离心管:15/50ml,无菌;
确保所有试剂温度与室温一致,在无菌条件下工作
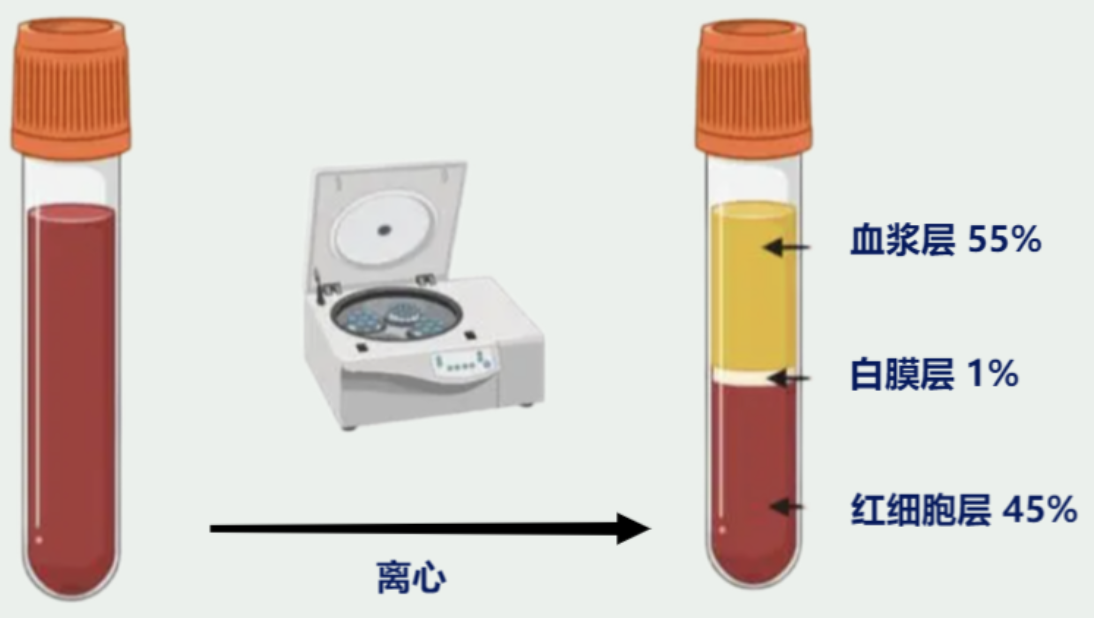
图4:白膜层制备及分布
△点击放大图片
操作步骤
1.全血:用PBS 2倍稀释;
2.白膜层:与全血相比,白膜层中的细胞密度更大,因此应该稀释更多(约3倍);
3.准备装有Ficoll-Paque试剂的离心管(考虑总体积选用15/50ml试管,15ml试管加入5mlFicoll试剂,50ml试管加入15mlficoll试剂);
4.沿着试管壁(15ml),在ficoll上层轻轻加入8ml稀释的血液,50ml试管加入25ml稀释血液;
5.离心(400g,30min,RT);
6.离心后,直接用移液管小心收集PBMC(或者先移去上层血浆再进行收集)到新的离心管,用PBS或;不含血清的培养基填充新试管;
7.离心(400g,10min),去上清,加入PBS或不含血清的培养基重悬(重复两次);
8.标记体积,取小部分进行细胞计数;
9.离心(400g,10min);
10.即刻使用:去上清,重悬;亦可冻存;
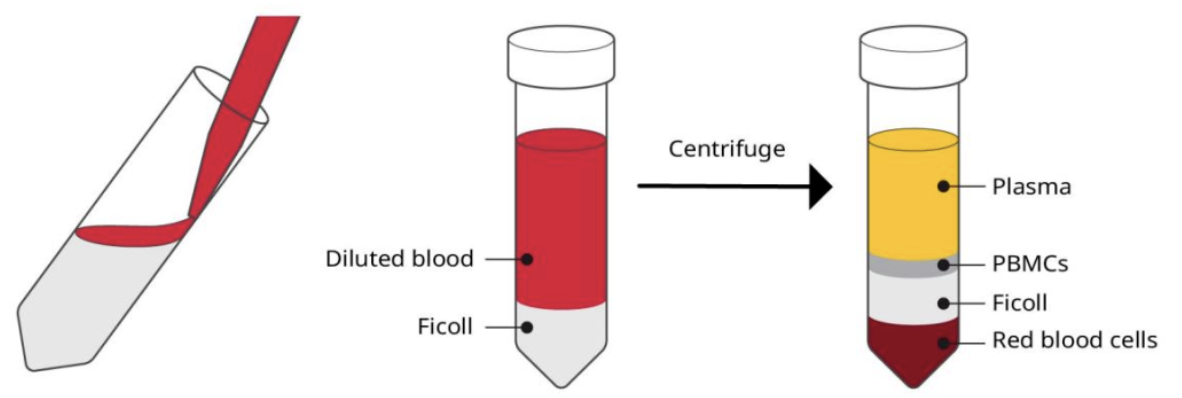
图5:PBMC制备流程图
△点击放大图片
梯度密度离心法制备PBMC效果为什么总是不好?
二、冻存
材料准备
1.冷冻培养基:RPMI1640(含2mM 左旋谷酰胺)+20% FCS和10% DMSO。如果细胞适合无血清培养基,则使用7% DMSO;
2.冷冻容器,聚丙烯离心管(15/50ml,无菌);
3.自动移液器,无菌吸头;
4.冷冻管(例如1.8ml);
5.-80℃冰箱、-150℃冰箱/液氮罐;
在开始冷冻操作前,贴好相应冷冻管标签,防止冷冻培养基在室温下放置过长时间,否则会影响细胞活力
操作步骤
1.将经过离心的PBMC去上清,加入冷冻培养基,将细胞浓度稀释至5-25X106个/ml(无血冷冻培养基稀释至1X106个/ml),转移至冷冻管(eg.1ml),并转移到冷冻容器中,确保细胞悬浮。
2.迅速将冷冻容器放入-80℃的冷冻设备中,保存时间建议在4小时~1周之间。
3.将冷冻管从冷冻容器中转移到-150℃的冷冻设备中进行长期储存。
对于1.8ml冷冻管,可加入1ml细胞悬液进行冷冻保存,若使用其他尺寸的冷冻管,要确保加入的细胞悬液小于最大体积,防止液体在冷冻过程中膨胀溢出。
三、复苏
材料准备
1.细胞培养基:RPMI 1640(含2mML-谷氨酰胺)+10%FCS,10mM HEPES和100µg/mL青霉素+ 100µg/mL链霉素
2.37℃水浴设备
3.聚丙烯离心管:50 ml和/或15 ml,无菌
4.移液器+吸头
5.自动助吸器+移液管
6.常温离心机
7.37℃CO2培养箱
开始前,水浴锅预热到37℃,预热培养基,后续洗涤步骤可在室温下进行。
操作步骤
1. 将冻存管从冷冻储藏室中迅速转移到37℃的水浴中,解冻直至管中仅存细小冰晶;
2. 缓慢向冷冻管中加入0.5-1ml细胞培养基,重悬后将悬液转移到15ml试管中,用1ml细胞培养基填充;
3. 冻存管并转移到15ml试管,用细胞培养基填充;
4. 离心(300g 10min),去上清,轻拍管体使细胞排列松散。加入1ml的细胞培养基,以移液器吹打、重悬,加培养基至体积为15ml;
5. 离心(300g 10min),去上清,加入1ml的细胞培养基,根据预期细胞浓度添加培养基;
6. 将细胞放入CO2 培养箱中,培养1h,盖子稍留缝隙(可利用此间隙来进行ELISPOT/Fluorospot板的预处理与封板);
如果一次需处理多个冷冻管,要尽快进行,冷冻培养基中的DMSO可能会影响细胞活性。
7. 孵育结束后,重悬,静置1min使聚集的细胞碎片沉淀。将没有沉淀的细胞悬液小心地转移到新的15ml试管中;
8. 细胞计数,确定细胞活性:计数可以采用自动细胞计数仪或显微镜下台盼蓝染色进行,要尽可能排除死细胞和即将凋亡的细胞,因为实验中仅有活细胞才能在刺激后分泌细胞因子。如果细胞活性和浓度低于要求,则需再次离心,重悬并稀释至正确的体积。
参考
[1]. Díaz I. Rules of thumb to obtain, isolate, and preserve porcine peripheral blood mononuclear cells. Vet Immunol Immunopathol. 2022 Sep;251:110461. doi: 10.1016/j.vetimm.2022.110461. Epub 2022 Jul 16. PMID: 35870231.
[2]. Autissier, P., Soulas, C., Burdo, T. H., and Williams, K. C. (2010). Evaluation of a 12-color flflow cytometry panel to study lymphocyte, monocyte, and dendritic cell subsets in humans. Cytometry A. 77, 410–419. doi: 10.1002/cyto.a. 20859
[3]. Kleiveland, C. R. (2015). “Peripheral blood mononuclear cells,” in The Impact of Food Bioactives on Health, eds K. Verhoeckx, P. Cotter, I. López-Expósito, C. Kleiveland, T. Lea, A. Mackie, T. Requena, D. Swiatecka, H. Wichers (Springer), 161–167.