一、CAR-T背景介绍
Chimeric antigen receptor (CAR) T cells ,嵌合抗原受体T细胞免疫疗法were recently approved by the Food and Drug Administration (FDA) and are poised to enter the practice of medicine for the treatment of leukemia and lymphoma.

△点击放大图片
淋巴瘤,起源于淋巴造血系统的恶性肿瘤, 主要表现为无痛性淋巴结肿大,肝脾肿大, 全身各组织器官均可受累。
白血病,一种造血系统的恶性肿瘤。病源是由于细 胞内脱氧核糖核酸的变异形成的骨髓中造血 组织的不正常工作。
二、常见的免疫机制及热点研究目标
CAR-T常见的热门靶标
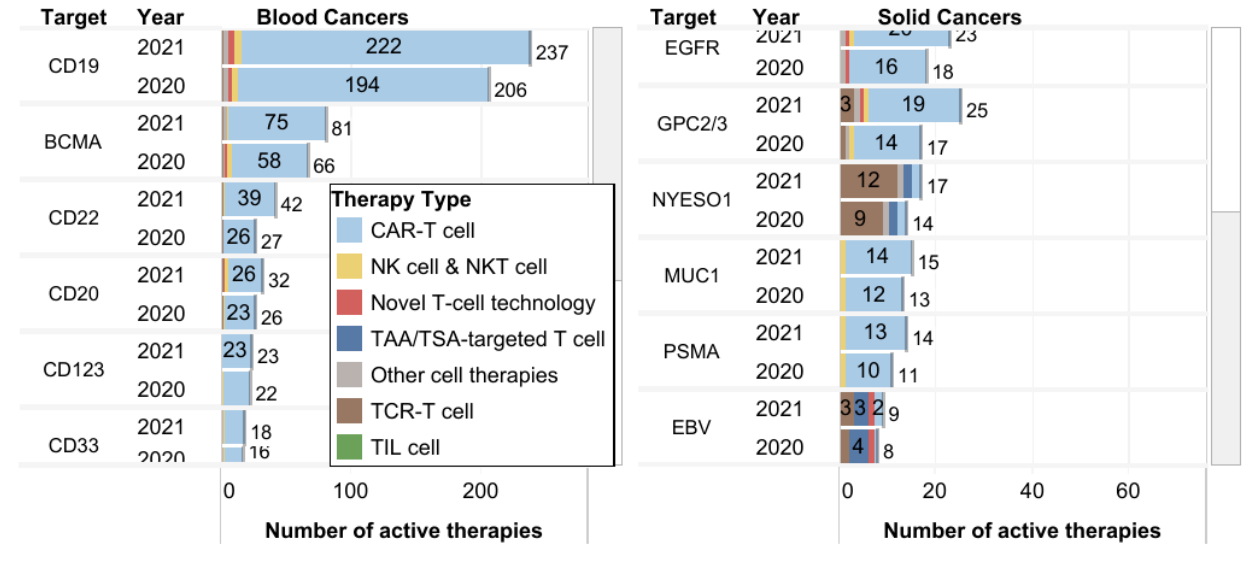
△点击放大图片
CAR-T上市产品

表1:FDA批准上市的CAR-T疗法
△点击放大图片
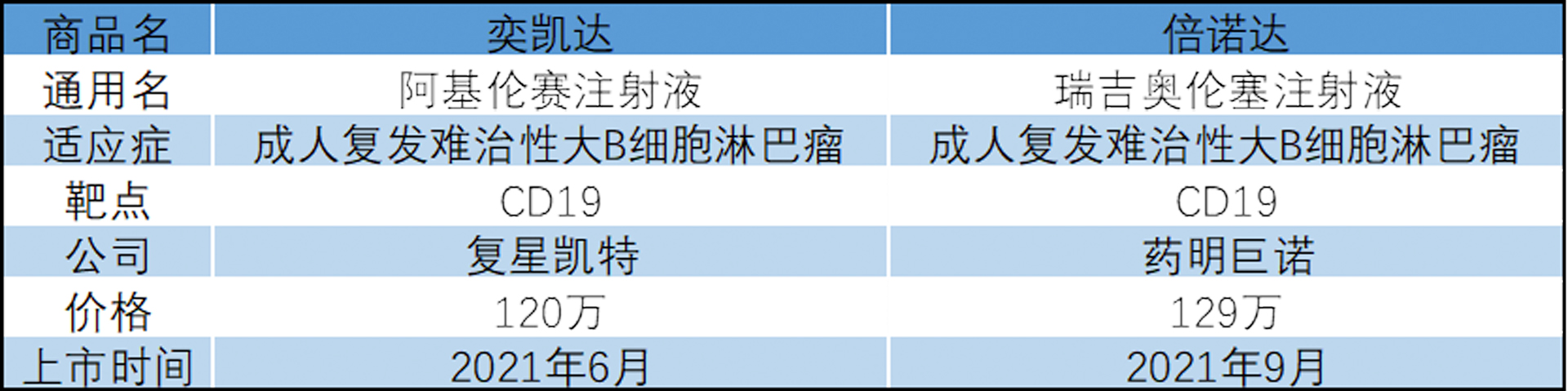
表2:中国上市的两款CAR-T
△点击放大图片
目前CAR - T细胞治疗的障碍
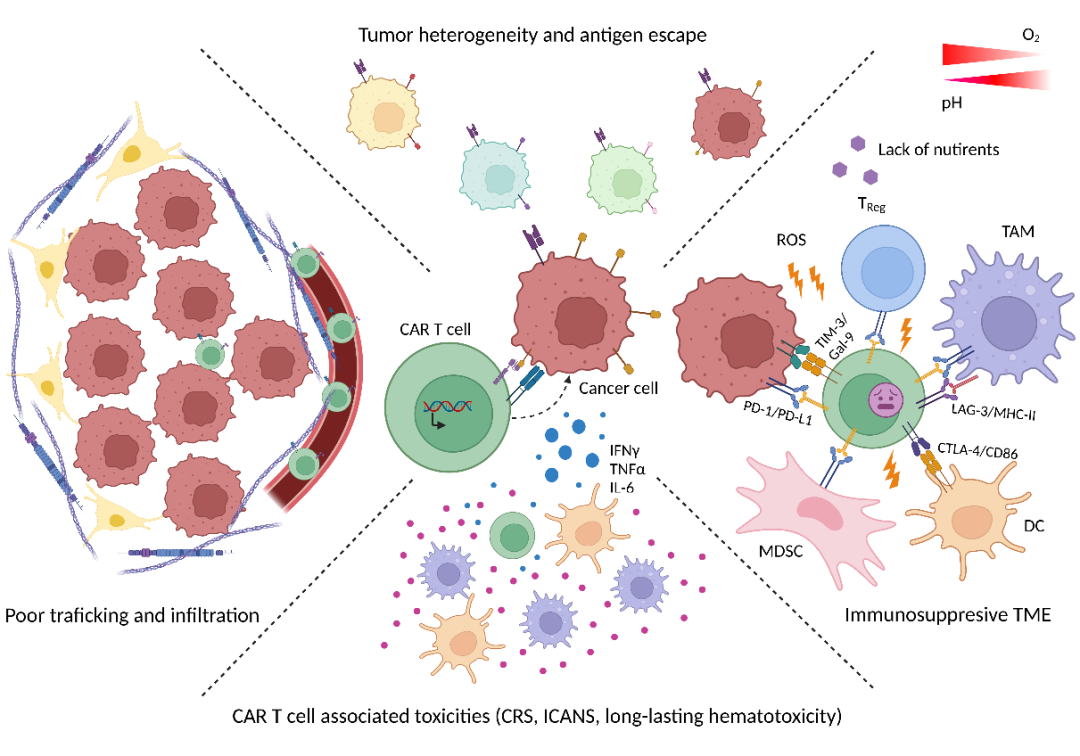
△点击放大图片
(1) 肿瘤的异质性会导致其表面不携带目标抗原的变异。免疫检查点分子(例如,肿瘤细胞上的PD-L1和/或间质细胞上与CAR - T细胞上的PD-1结合)可以减缓抗肿瘤活性。
(2) immunosuppressive TME (Tumor cells and their microenvironment):免疫抑制TME,如骨髓源性抑制细胞(MDSCs),肿瘤相关巨噬细胞(TAM)或treg和不适宜的代谢条件(即缺氧,酸中毒,氧化应激,关键营养物质消耗等)。
(3) 渗透障碍,因为TME和其中的肿瘤细胞运输不良导致肿瘤组织浸润不足。
(4) CRS:CAR - T细胞的(过度)激活可能导致严重的和潜在的危及生命的毒性细胞因子释放(CRS):免疫效应细胞相关神经毒性综合征(ICANS)和持久的血液毒性最为常见。
CAR-T 整体流程及切入点
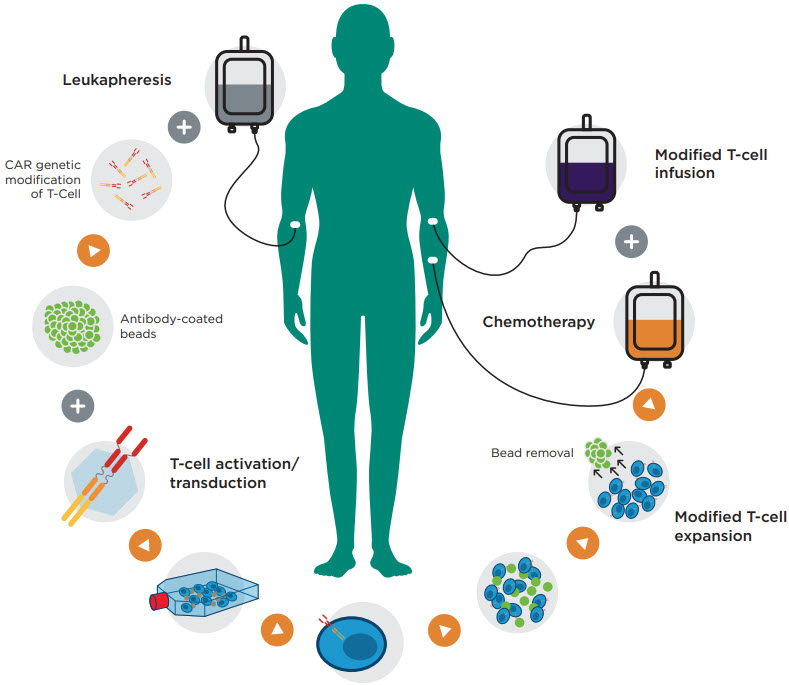
△点击放大图片
(1) PBMC制备
(2) T细胞分选
(3) 转染修饰
(4) 扩增、培养
(5) T细胞质控(活力、数量、分型、内毒素、杀伤力)
(6) 动物监测
(7) 志愿者监测
(8) 免疫应答评估
(9) 细胞因子风暴
(10) 细胞耗竭
(11) MRD(Minimal Residual Disease)检测
三、CAR-T常见的免疫机制及研究方法学
1、通过单细胞测序监测CAR基因修饰
案例:单细胞RNA测序方法监测CD19-CAR基因通过慢病毒载体(LVs)的传递,比较CAR - T细胞中转导和未转导的细胞差异。
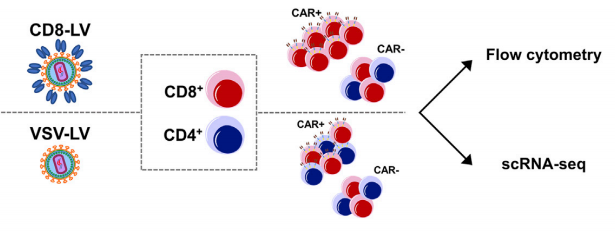
△点击放大图片
通过单细胞RNA测序(scRNA-seq)的方法,监测CD19-CAR基因通过慢病毒载体lentiviral vectors (LVs)的传递
慢病毒载体:the conventional vesicular stomatitis virus (VSV)-LV ;the CD8-targeted CD8-LV
细胞来源:Human donor peripheral blood mononuclear cells (PBMCs);
细胞激活后,incubated with CD8-LV / VSV-LV / untransduced(control);
(IL)-7/IL-15存在下培养6天,进行后续分析。
通过单细胞转录组学,帮助绘制细胞图谱
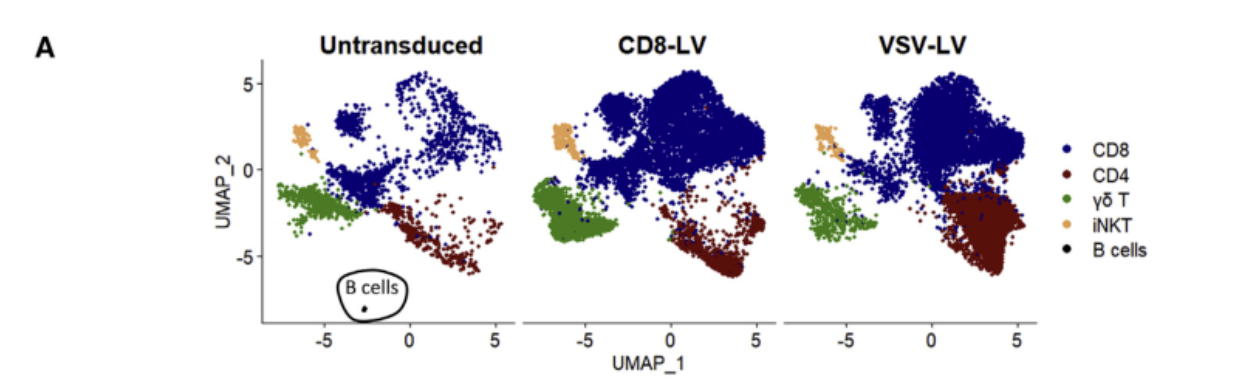
△点击放大图片
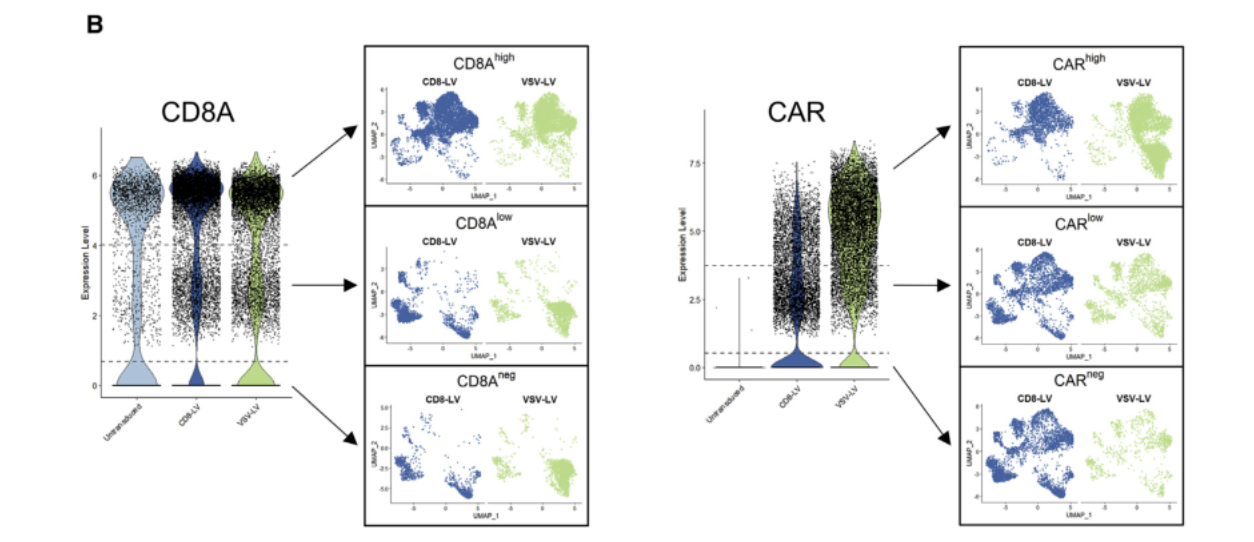
CAR - T细胞亚群:
△点击放大图片
(A)三个样本的UMAP图被标记基因表达确定的主要免疫细胞亚型着色,scRNA测序证实了CD8-LV的高选择性。
(B)基于CD8A和CAR基因高表达、低表达和负表达细胞分布的亚组策略,并将其投射到UMAP图中,用于细胞群体和纯度评估。
通过单细胞转录组学,进行细胞亚群表达分析
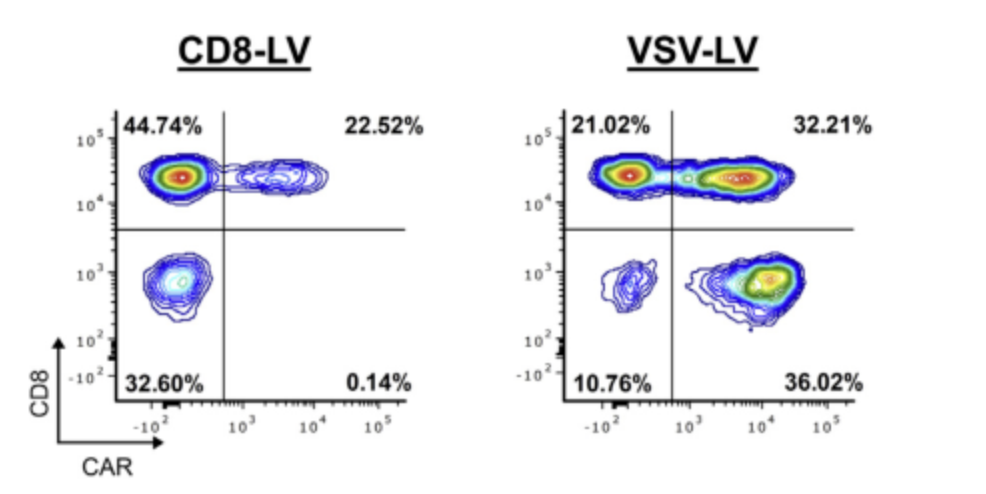
△点击放大图片
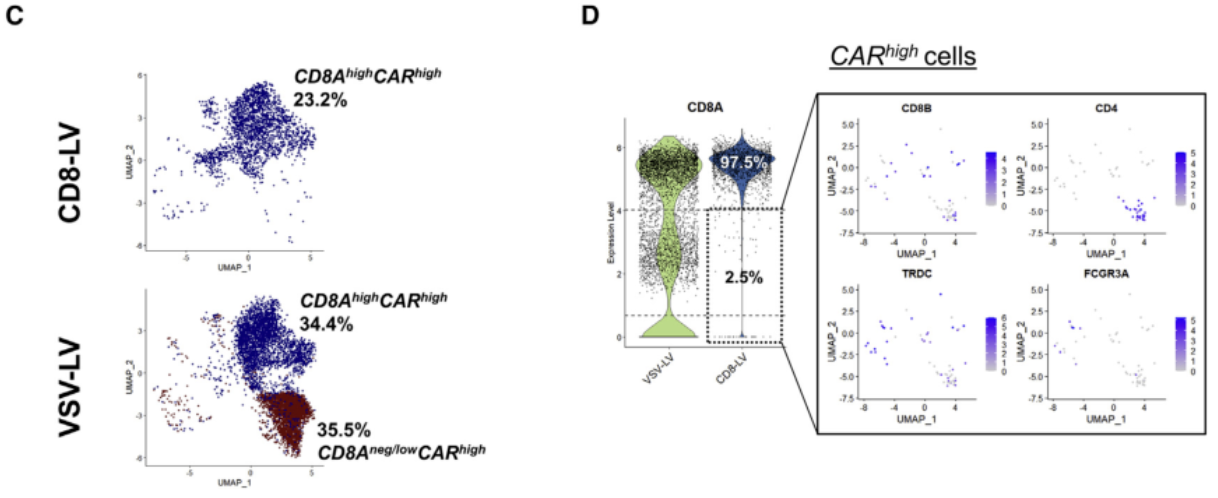
△点击放大图片
(C)基于多模态亚组策略的scRNA测序中鉴定的CAR - T细胞频率与流式结果一致
(D) CARhigh细胞在LV-暴露样品中的CD8A表达(左)。分析在CD8- LV样本中鉴定的CD8Aneg/low/CARhigh细胞的CD8、CD4和TCRγδ表达。
通过单细胞转录组学,进行差异分析
a.所有比较组161个调控基因显著差异的热图:
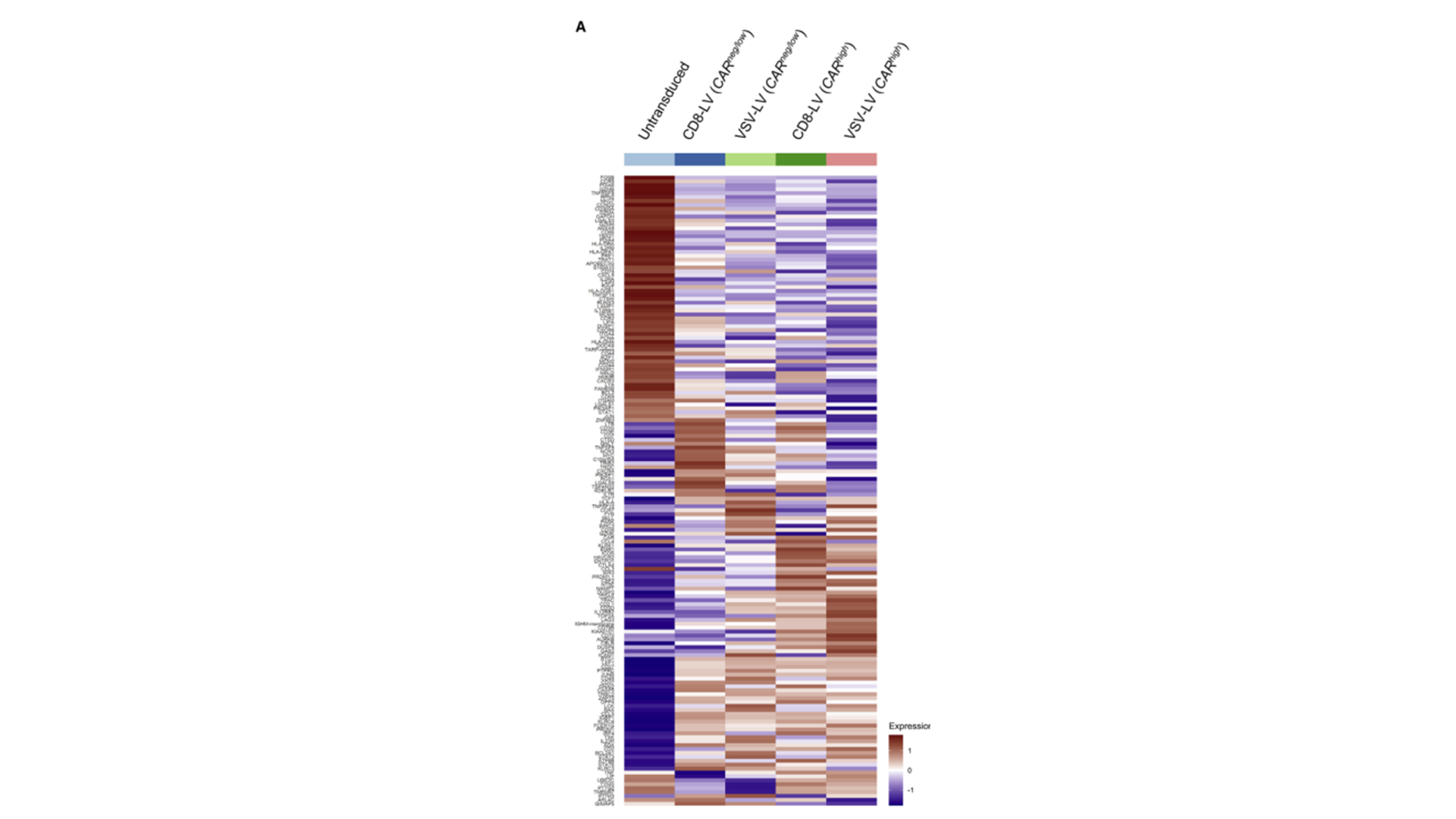
△点击放大图片
b.所有比较组免疫检查点,记忆亚型等表达差异:
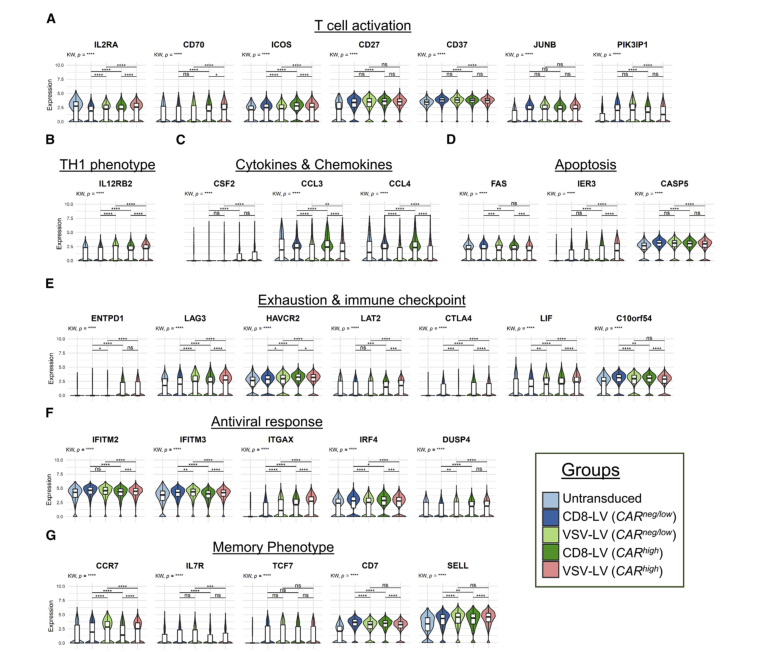
△点击放大图片
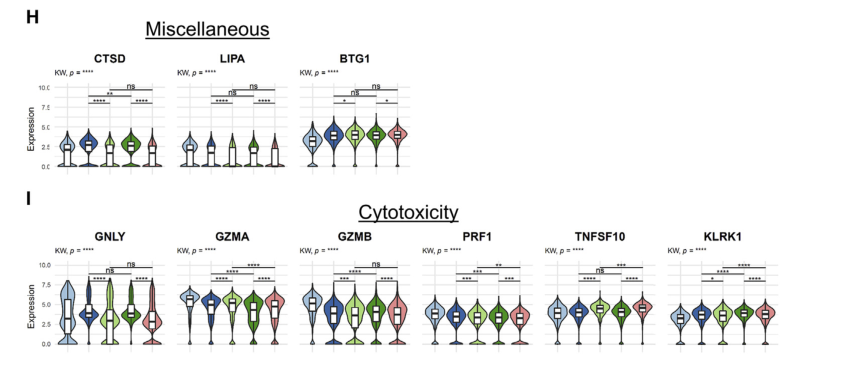
△点击放大图片
高通量单细胞测序可以解决什么问题?

△点击放大图片
2、CRS细胞因子风暴的定量检测
炎症因子定量检测:TNF、IFN gamma、GM-CSF、IL-1beta、IL-2、IL-6、IL-8、IL-12、IL-18、CRP等。
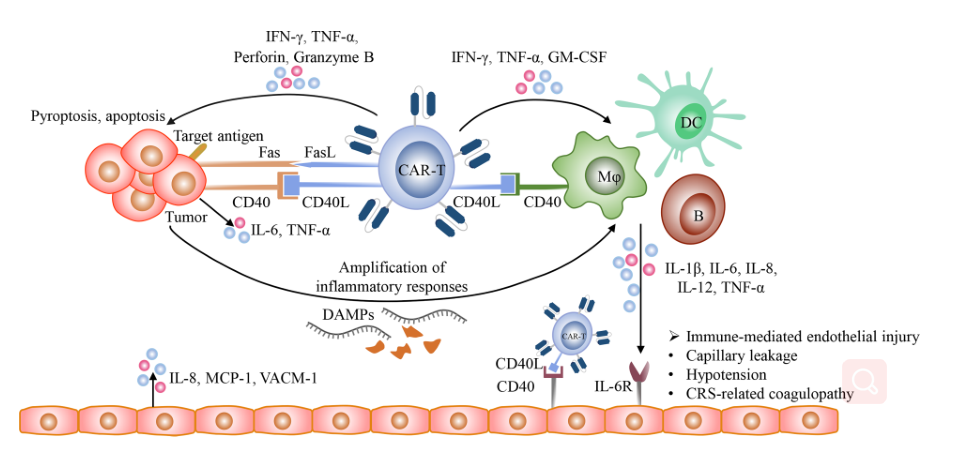
△点击放大图片
CRS的作用机制:
CAR - T细胞识别目标抗原后,迅速增殖并释放颗粒酶、穿孔素、IFN-g、TNF-a等多种细胞毒分子,上调CD40L和Fas配体(FasL)的表达,最终诱导肿瘤细胞焦亡和凋亡。
活化免疫细胞释放的细胞因子可与内皮细胞上的受体结合,介导内皮功能障碍,导致毛细血管渗漏,促凝因子释放。
炎症因子定量检测

△点击放大图片
patients achieved a complete remission (CR),
very good partial response (VGPR),
or partial response (PR)
All blood samples were stored at 4 °C until centrifugation at 5000 rpm for 6 min.
The supernatant liquids were quantified with the BD Cytometric Bead Array Human Th1/Th2/Th17 Cytokine Kit.
CBA:流式液相多重蛋白定量技术

△点击放大图片
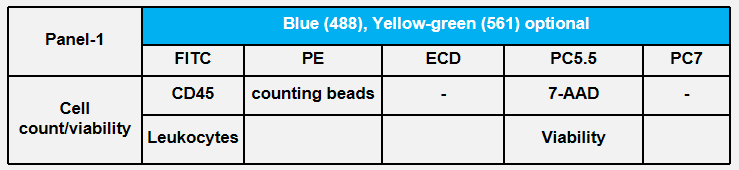
CBA产品推荐
| 指标 | 货号 | 品名 | 规格 | Beads位置 |
| IFN-Y | 558269 | (CBA) Human IFN-y Flex Set | 100 Tests | E7 |
| IL-2 | 558270 | (CBA) Human IL-2 Flex Set | 100 Tests | A4 |
| IL-4 | 558272 | (CBA) Human IL-4 Flex Set | 100 Tests | A5 |
| TNF | 558273 | (CBA) Human TNF Flex Set | 100 Tests | D9 |
| IL-6 | 558276 | (CBA) Human IL-6 Flex Set | 100 Tests | A7 |
| IL-8 | 558277 | (CBA) Human IL-8 Flex Set | 100 Tests | A9 |
| IL-lp | 558279 | (CBA) Human IL-lp Flex Set | 100 Tests | B4 |
| MCP-1 | 558287 | (CBA) Human MCP-1 Flex Set | 100 Tests | D8 |
| FGF | 558327 | (CBA) Human basic FGF Flex Set | 100 Tests | C5 |
| VEGF | 558336 | (CBA) Human VEGF Flex Set | 100 Tests | B8 |
| TGF-pl | 560429 | (CBA) Human TGF-pi Single Plex Flex Set | 100 Tests | B6 |
CBA检测细胞因子的优势
CBA法的优势——适合flower操作者:
(1)单管多指标:单个标本最少10ul可同时检测5-75个指标,样本需要量大大少于ELISA方法;
(2)实验时间短:单次实验时间(<3.5h)较单次ELISA所需时间短,且操作简便;
(3)自动化定量:每个因子独立标准曲线,软件自动分析 10分钟出结果。
(4)流式微球法(CBA法)仪器随处可见:可在包括BD FACSCalibur、FACSCantoII,贝克曼nervous、FC500等在内的多型号流式细胞仪上使用,Luminex法仪器也比较普及。
3、CAR-T分型检测&immune cell response&CAR的检测
案例:CAR-T细胞免疫监测应用的先进流式细胞术分析
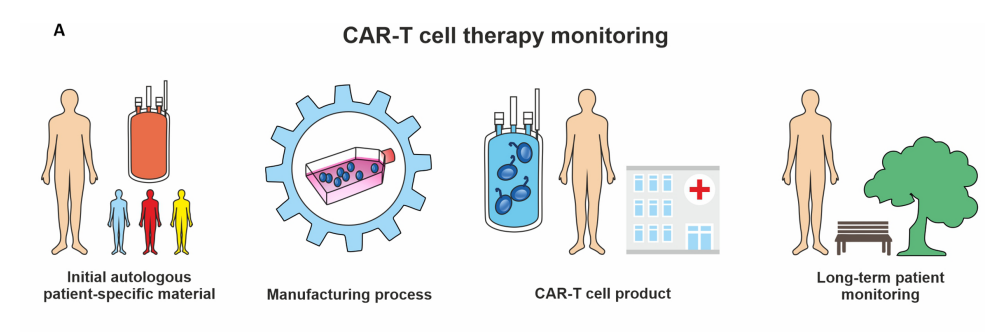
△点击放大图片
CAR-T细胞生产和治疗的免疫监测分析
需要监测的CAR-T细胞治疗的关键步骤包括分析初始白细胞分离患者材料、制造工艺、CAR-T细胞产品释放和长期患者随访。
主要包括抗CD19 CAR-T细胞和残余CD19+ B细胞的存在,T细胞室的激活状态,共刺激信号分子和细胞毒性药物(如穿孔素和颗粒酶B)的表达。
(1)细胞活力与细胞绝对定量计数
△点击放大图片

△点击放大图片
结果解读
健康个体和接受抗 CD19 CAR-T 细胞治疗的患者外周血中白细胞的总数和活力。在健康对照(a-d)和 CAR-T 细胞回输后 9 天的患者(A-D)中,流式细胞仪鉴定白细胞(a, A)和通过Bead进行细胞计数。死细胞(b,B)和珠双峰(d,D)被排除在外。
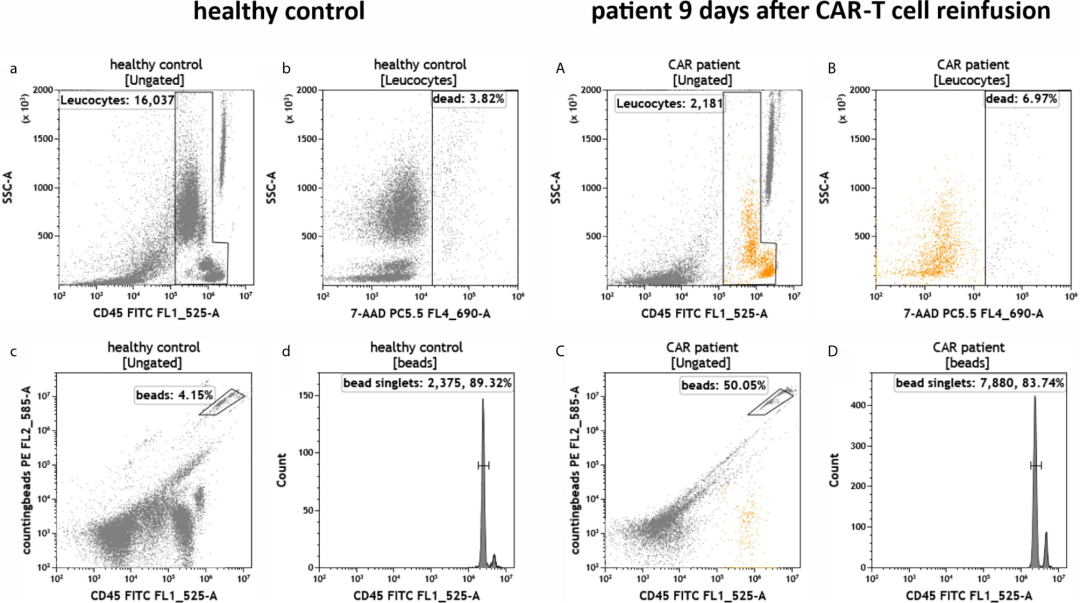
△点击放大图片
通过SSCA/H去除粘连细胞;
通过CD45获得白细胞;
通过绝对技术管对CD45白细胞进行绝对计数和定量。

△点击放大图片
(2)TN/TE/TCM/TEM/活化T分型-方案设计
△点击放大图片
结果解读
△点击放大图片
与健康供体(a - m)相比,CAR-T细胞回输(A-M) 9天后患者的流式细胞术门控策略和抗CD19 CAR-T细胞的表型:
将T细胞分为抗CD19 CAR-和CAR+细胞(e, E)
CAR-和CAR+T细胞进一步分为CD4+和CD8+细胞(g, G1和G2),
随后在CD4+T细胞群(i, I1和I2)中鉴定CD127dimCD25+ Treg。
通过CD45RA和CCR7表达来评估CAR-T细胞和正常T细胞的成熟阶段(f, F)。
在naïve区室中,评估CD127+CD95+细胞以鉴定干细胞样T细胞记忆类型(h, H),包括CD4和CD8的表达(j, J)
检查点CD137和激活标记CD69和CD25的表达通过来自健康供体的T细胞与患者CAR+和CAR- T细胞的重叠图进行比较。(kK-mM)。健康对照组没有抗cd19 CAR-T细胞。
(3)炎症型蛋白颗粒酶、穿孔素、IFN的表达
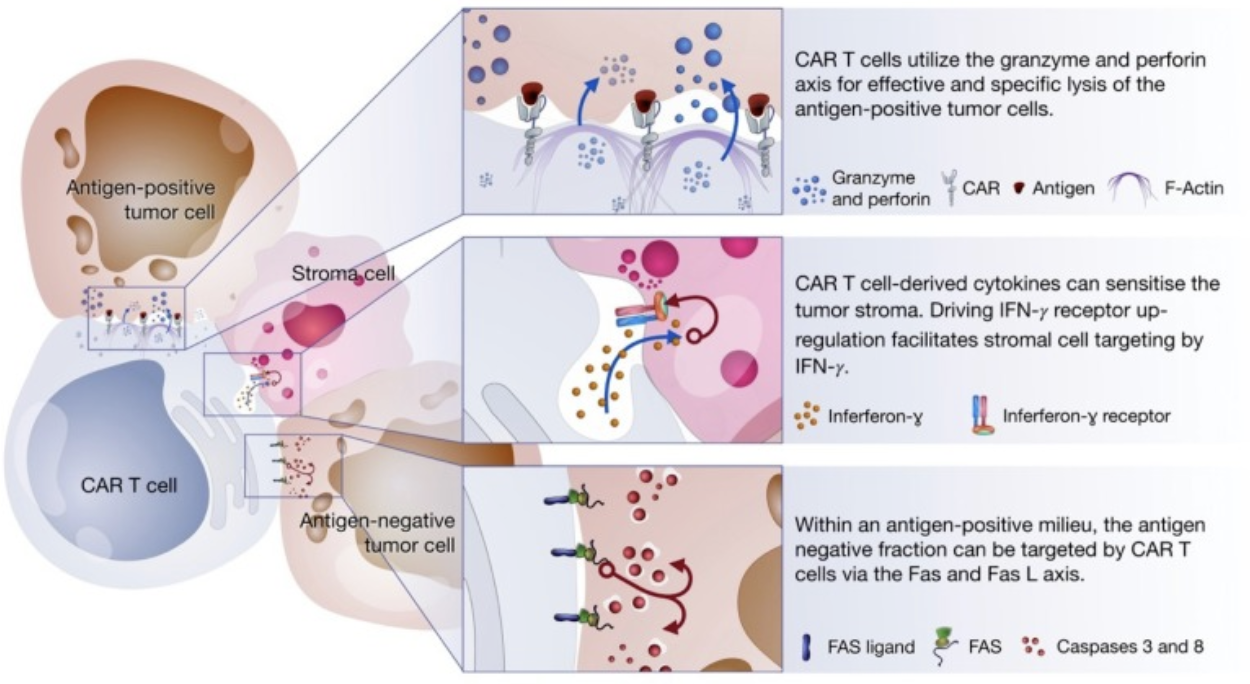
△点击放大图片
CAR-T细胞杀伤肿瘤的机制
第一,CAR-T细胞分泌穿孔素和颗粒酶,穿孔素可以在肿瘤细胞表面“打洞”,随后颗粒酶被输送到肿瘤细胞内部,直接通过物理作用对肿瘤细胞进行杀伤或者诱导肿瘤细胞发生凋亡;
第二,CAR-T细胞还会分泌特定的细胞因子,这些细胞因子可以促进CAR-T的活性,改变肿瘤微环境,进一步增强其抗肿瘤活性。
第三,CAR-T细胞表面还会高表达TNF配体,这些配体可以诱导肿瘤细胞凋亡;
方案设计
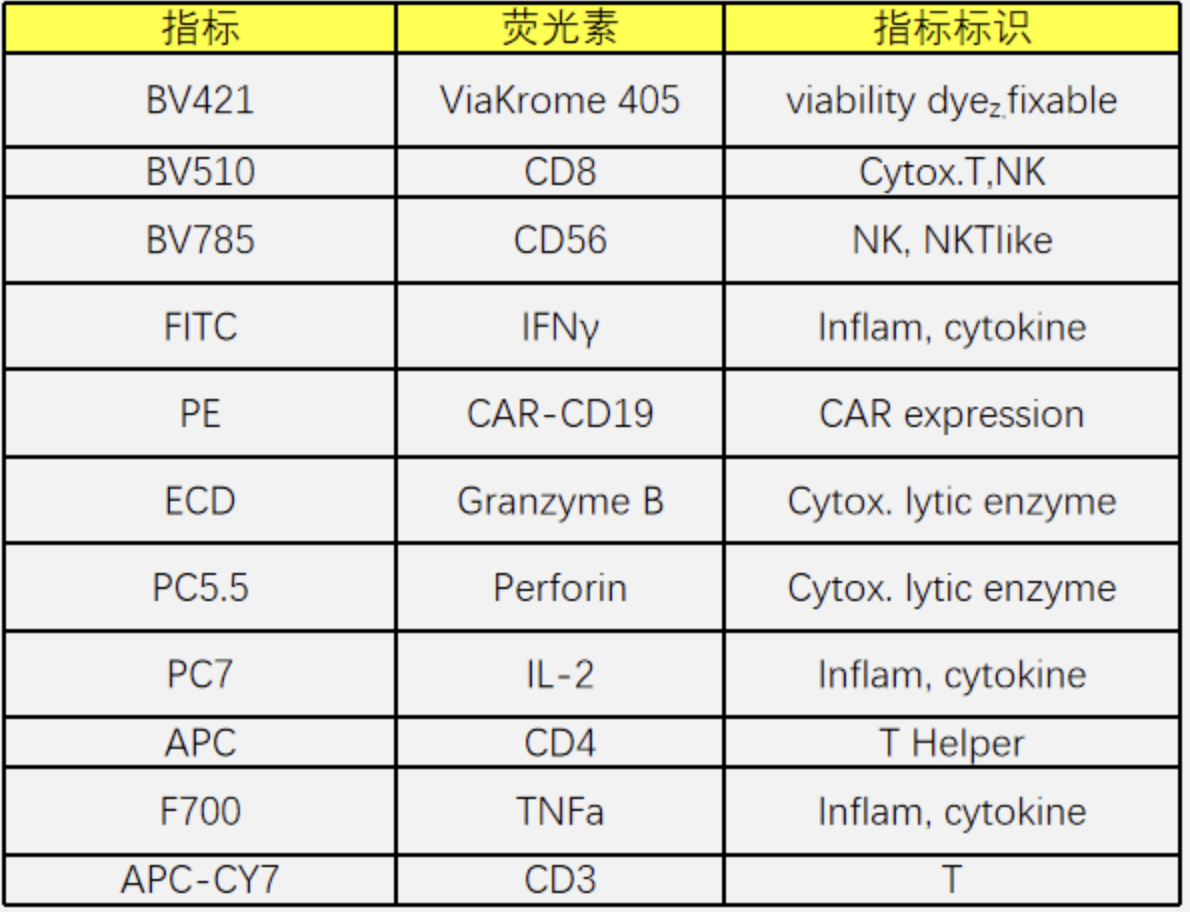
△点击放大图片
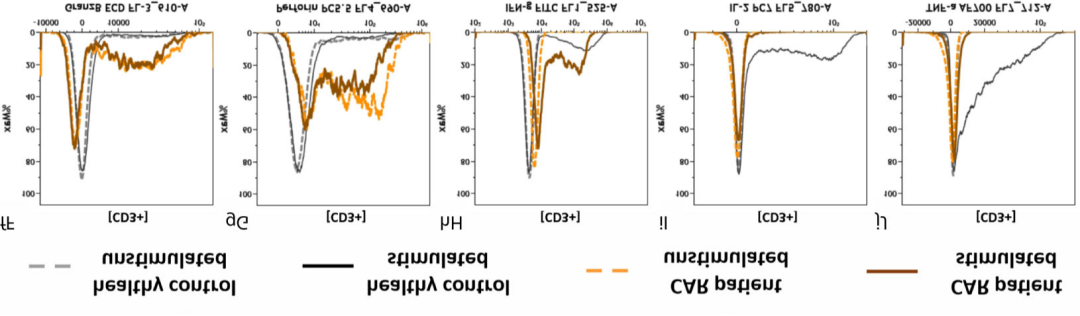
结果解读
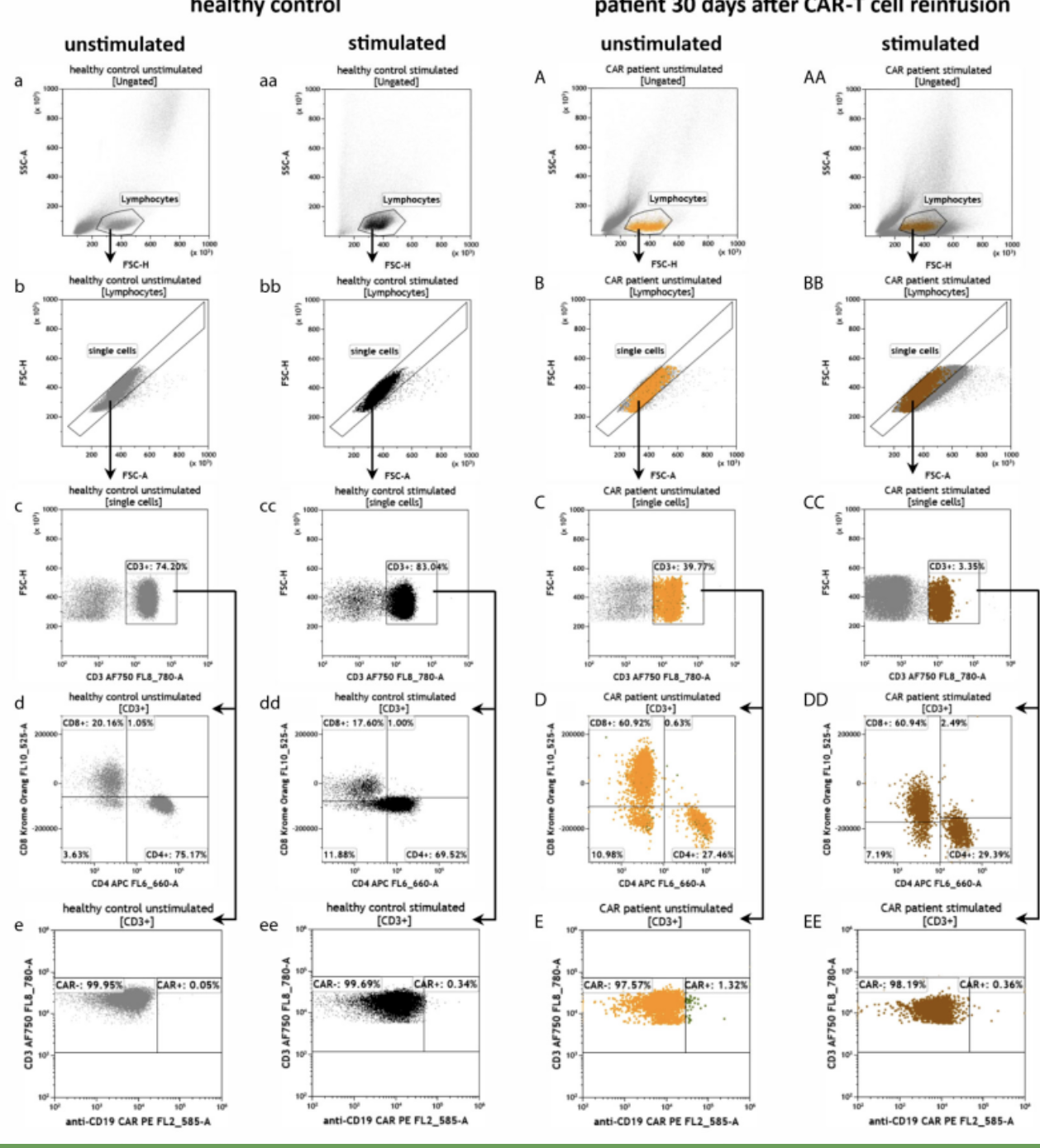
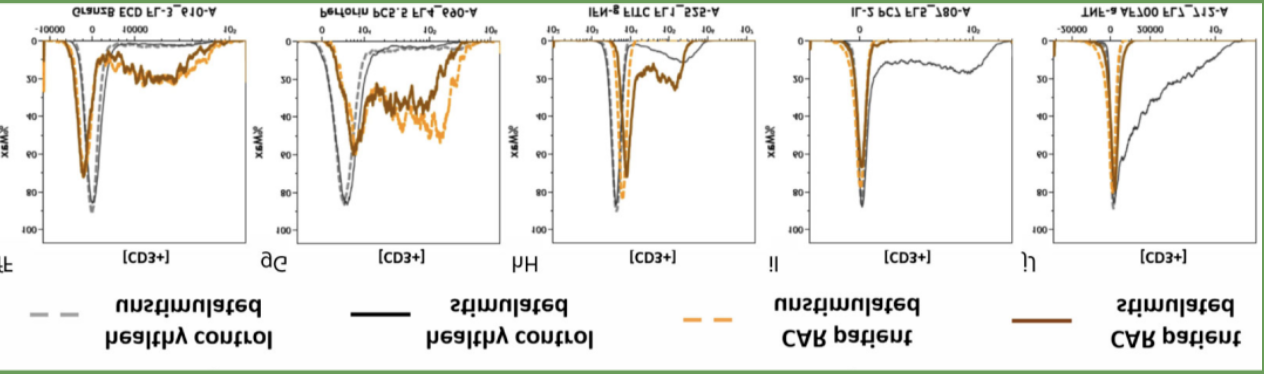
△点击放大图片
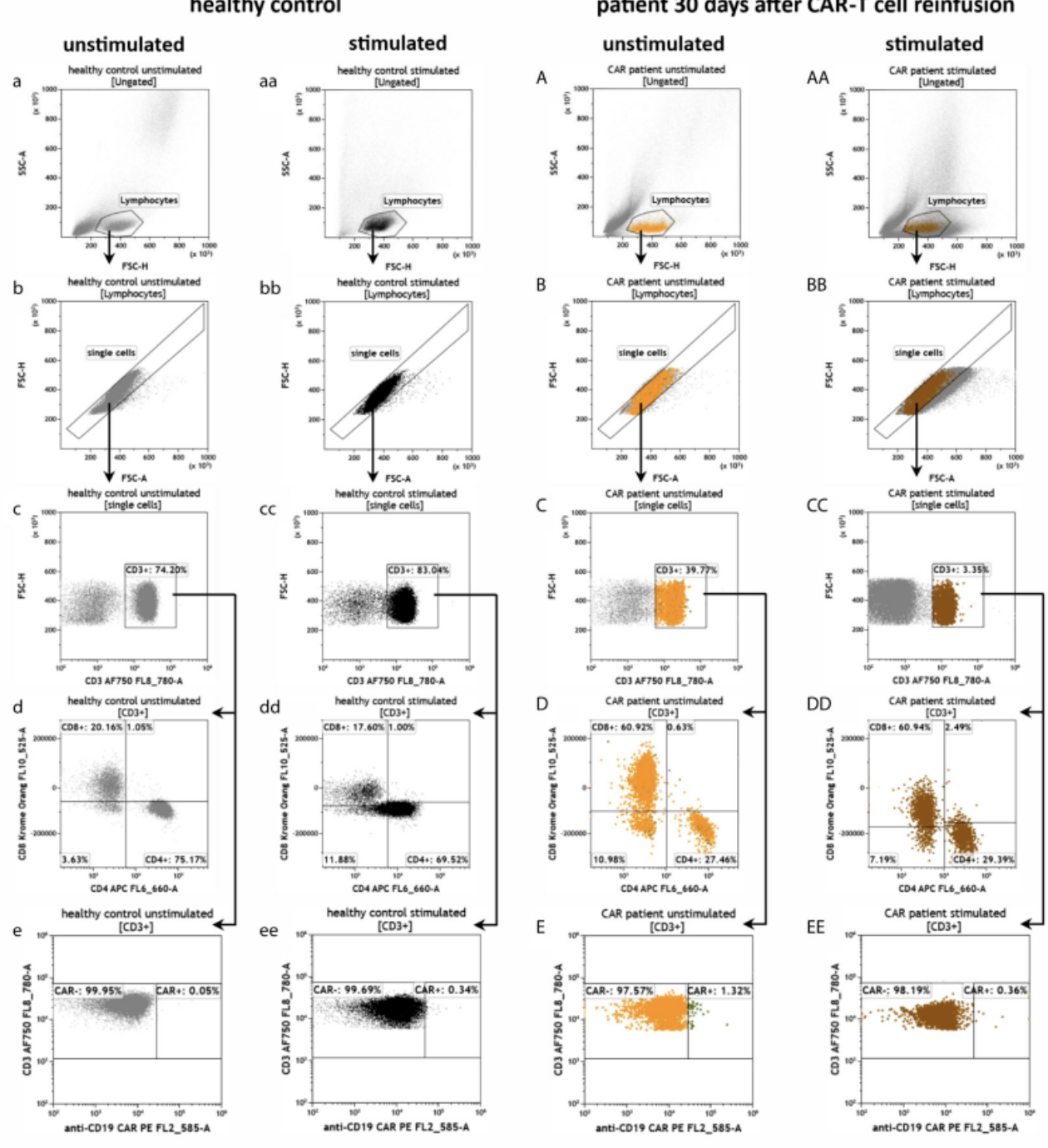
用于CAR-T细胞治疗的患者外周血中抗cd19 CAR-T细胞的效应潜力
与健康供体(a - j)相比,CAR-T细胞回输注(A-J)后30天患者的抗cd19 CAR-T细胞或PMA/Ionomycin刺激的细胞(aa-j, aa-j)的流式细胞术门控策略和细胞外和细胞内染色的表型:
鉴定T细胞(c-CC),并进一步分裂为CD4+和CD8+ T细胞(d-DD)以及CAR-和CAR+ T细胞(e-EE)。
通过叠加图比较来自健康供体和抗CD19 CAR-T细胞治疗患者的未刺激和刺激T细胞之间颗粒酶B (fF)、穿孔素(gG)、ifn - γ (hH)、IL-2 (iI)和TNF-a (jJ)的细胞内表达。
(4)Immune Checkpoint Molecules在T细胞上的分型-方案设计
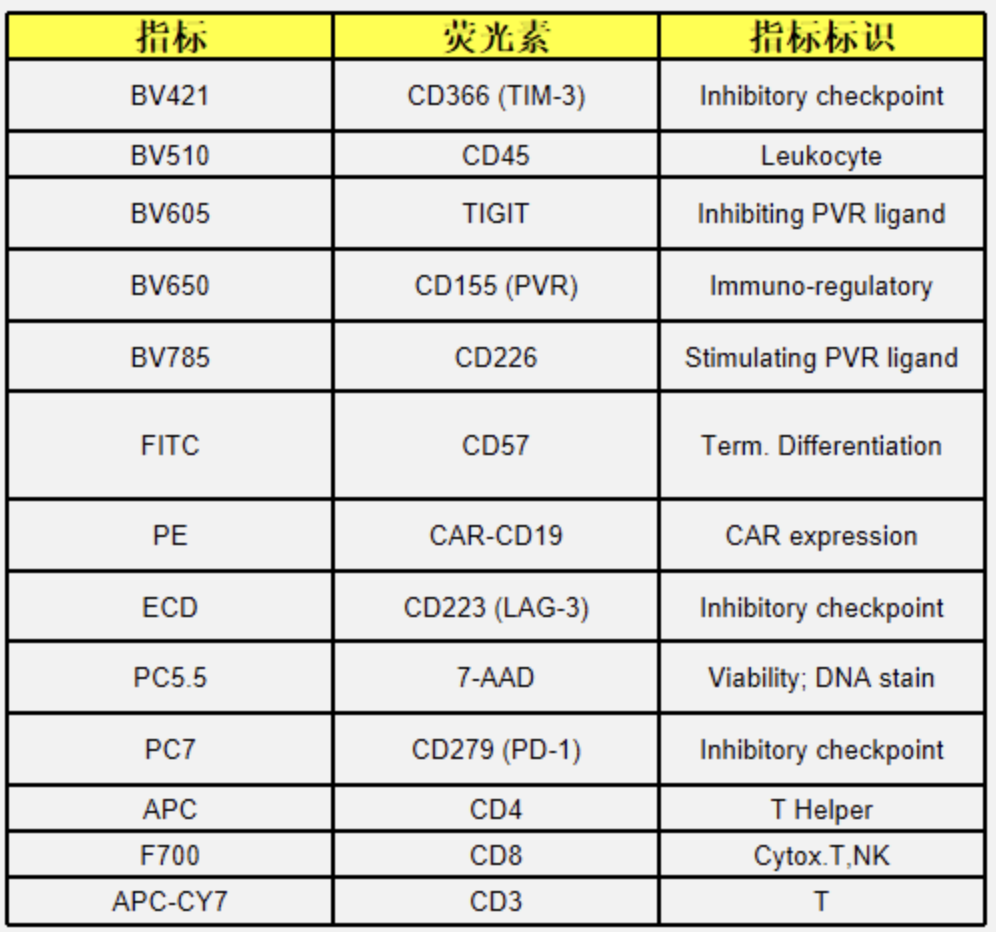
△点击放大图片
结果解读
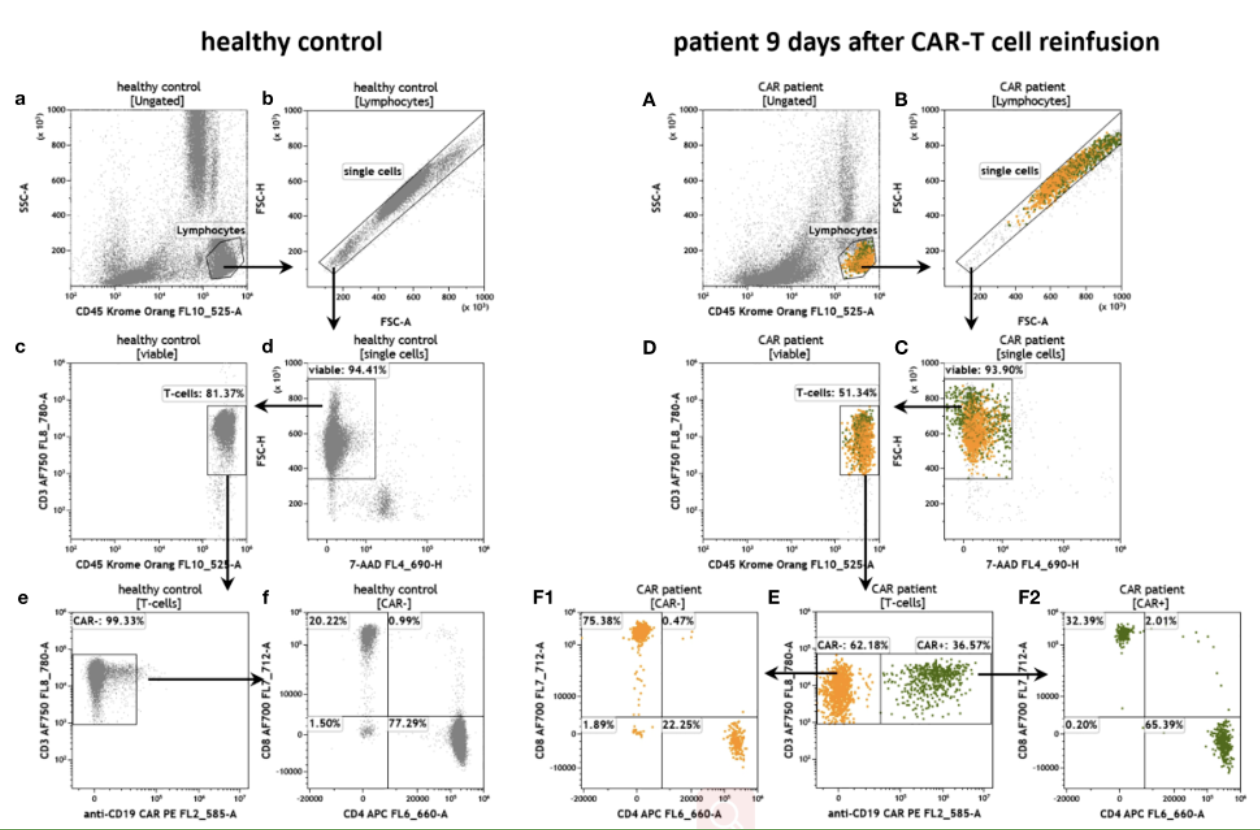
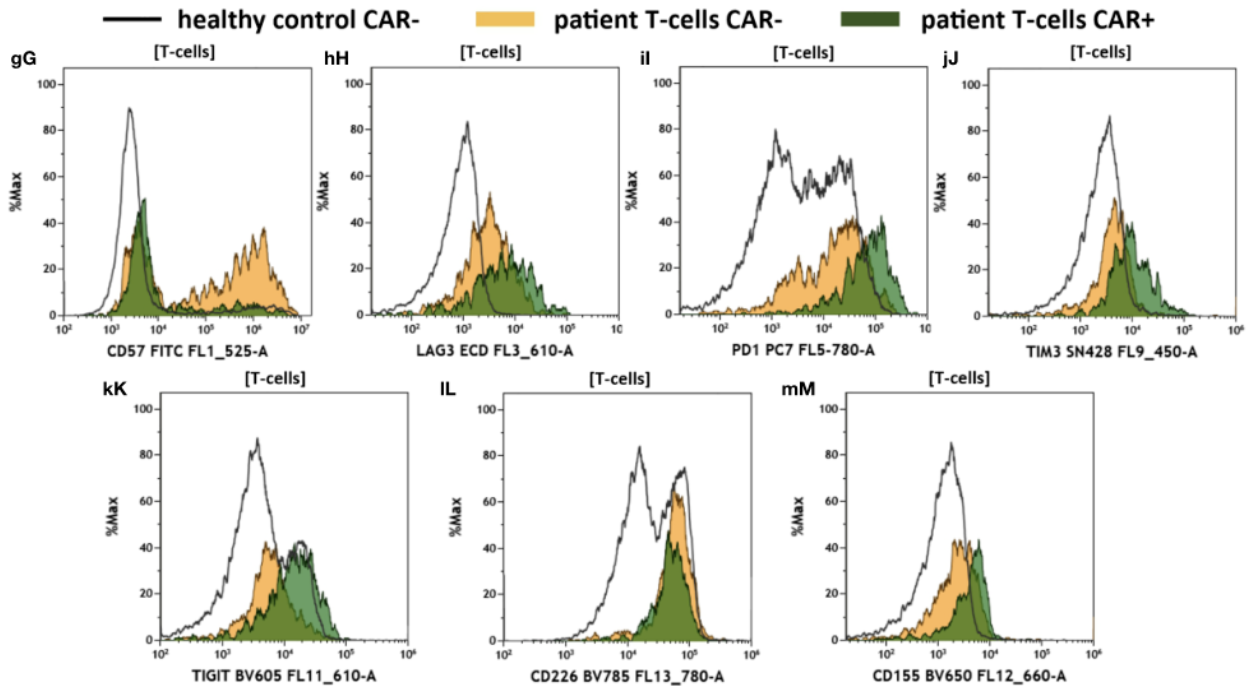
△点击放大图片
用于CAR-T细胞治疗的患者外周血中抗cd19 CAR-T细胞的适应性。与健康对照个体(a - m)相比,CAR-T细胞回注(A-M)后9天患者的流式细胞门控策略和抗CD19 CAR-T细胞的表型:
鉴定出活的(c, c) T细胞(d, d)。
T细胞分别分化为抗cd19 CAR-和CAR+细胞(e, e), CAR-和CAR+ T细胞进一步分化为CD4+和CD8+细胞(f, F1, F2)。
通过对健康供体和患者CAR-和CAR+ T细胞的T细胞叠加图,比较末端分化标记CD57 (gG)、检查点LAG3 (hH)、PD-1 (iI)、TIM3 (jJ)以及免疫调节TIGIT (kK)、CD226 (lL)和CD155 (mM)的T细胞表达。健康对照组没有抗CD19 CAR-T细胞。
Workflow:CAR - T细胞在患者来源的胶质母细胞瘤异种移植模型中的临床前测试
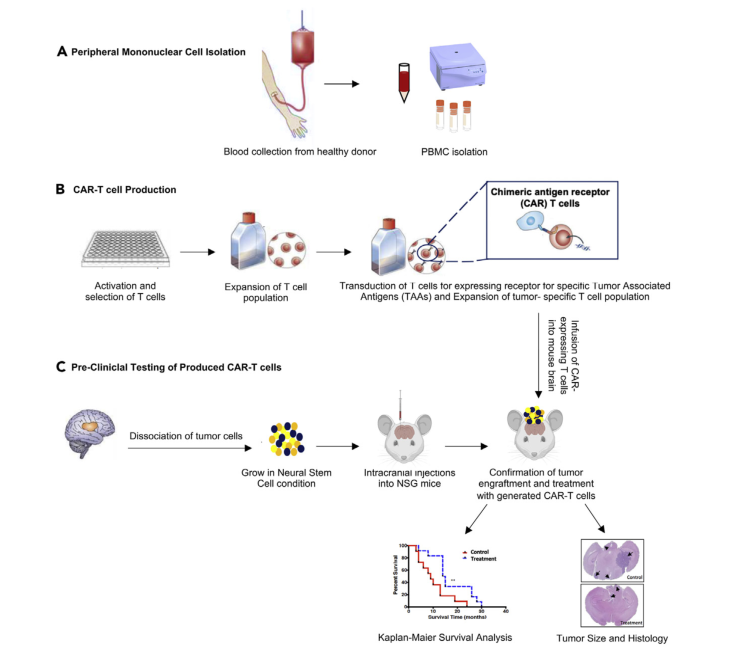
△点击放大图片
胶质母细胞瘤(GBM)是最常见的恶性成人脑肿瘤,对标准治疗有耐药性。
该方案展示了如何从健康供体中分离出外周血单个核细胞PBMC,并为感兴趣的抗原生成CAR - T细胞,以及如何将CAR - T细胞颅内注射到患者来源的GBM异种移植小鼠模型中。
四、优宁维提供的产品解决方案

Reference:
1.June CH, Sadelain M. Chimeric Antigen Receptor Therapy. N Engl J Med. 2018 Jul 5;379(1):64-73. doi: 10.1056/NEJMra1706169. PMID: 29972754; PMCID: PMC7433347.
2.Rial Saborido J, Völkl S, Aigner M, Mackensen A, Mougiakakos D. Role of CAR T Cell Metabolism for Therapeutic Efficacy. Cancers (Basel). 2022 Nov 4;14(21):5442. doi: 10.3390/cancers14215442. PMID: 36358860; PMCID: PMC9658570.
3.Charitidis FT, Adabi E, Thalheimer FB, Clarke C, Buchholz CJ. Monitoring CAR T cell generation with a CD8-targeted lentiviral vector by single-cell transcriptomics. Mol Ther Methods Clin Dev. 2021 Oct 5;23:359-369. doi: 10.1016/j.omtm.2021.09.019. Erratum in: Mol Ther Methods Clin Dev. 2022 Jan 24;24:207-209. PMID: 34729382; PMCID: PMC8546366.
4.CAR-T cell therapy-related cytokine release syndrome and therapeutic response is modulated by the gut microbiome in hema_x0002_tologic malignancies. https://doi.org/10.1038/s41467-022-32960-3
5.Zhang X, Zhu L, Zhang H, Chen S, Xiao Y. CAR-T Cell Therapy in Hematological Malignancies: Current Opportunities and Challenges. Front Immunol. 2022 Jun 10;13:927153. doi: 10.3389/fimmu.2022.927153. PMID: 35757715; PMCID: PMC9226391.
6.Advanced Flow Cytometry Assays for Immune Monitoring of CAR-T Cell Applications Front. Immunol. 12:658314. doi: 10.3389/fimmu.2021.658314
7.doi: 10.3390/ijms20061283.