1. 背景介绍
红斑狼疮(lupus erythematosus-LE)是一类慢性、反复发作的自身免疫性疾病的总称,其特征是存在许多异常免疫细胞和大量自身抗体和免疫复合物,导致多个器官受到损害,如皮肤、肾脏和大脑。
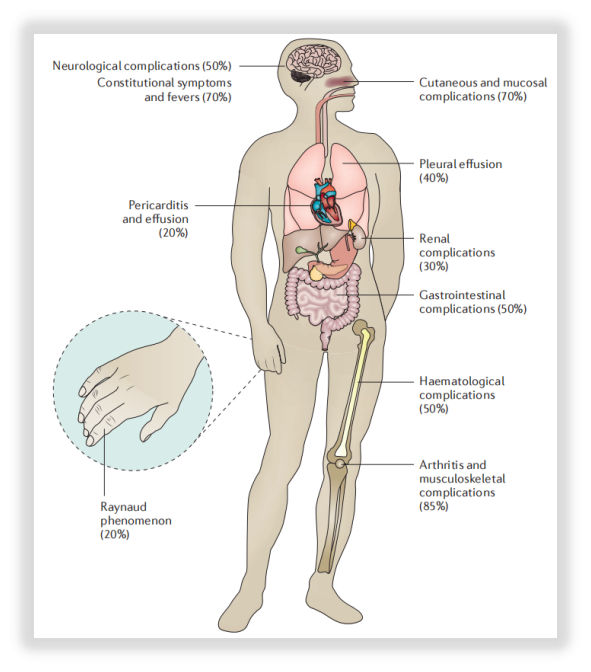
图1:SLE的临床异质性[1]
△点击放大图片
在临床上,LE主要分为两种类型:皮肤红斑狼疮(CLE)、系统性红斑狼疮(SLE),CLE主要表现为皮肤损伤,不涉及全身损伤;SLE则涉及全身性表现,包括皮肤、呼吸系统、肾脏、心血管疾病等症状。盘状红斑狼疮(DLE)是皮肤红斑狼疮(CLE)的主要类型,约占CLE病例的50%~85%。
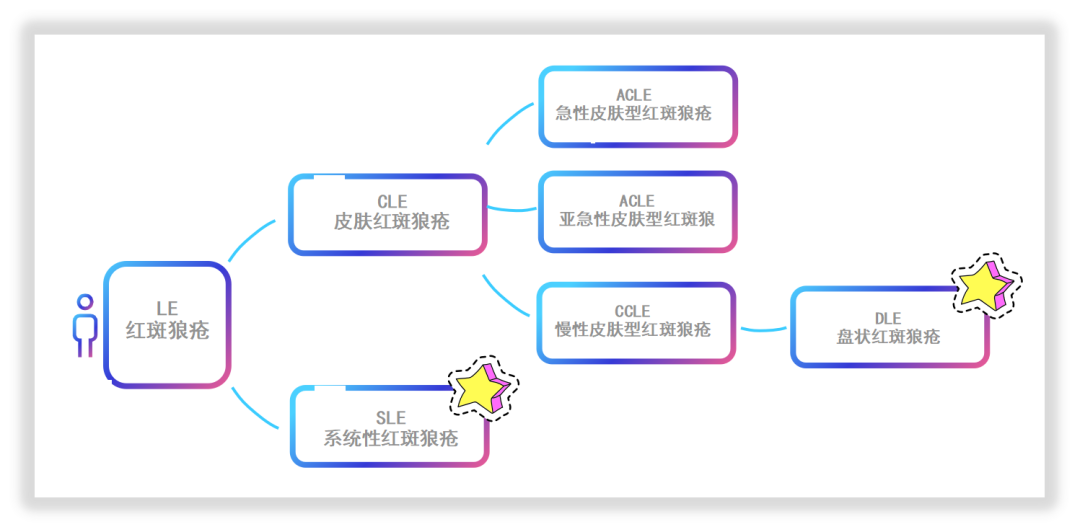
图2:SLE(系统性红斑狼疮)与DLE(盘状红斑狼疮)归属划分
△点击放大图片
单细胞测序是拆解“疾病黑箱”的新兴技术手段:
在单细胞和多细胞生物中,单个细胞之间的差异可能引起深远的后果,即使来自看似同质的群体,单个细胞在基因表达和蛋白质水平上也可能表现出显著差异。单细胞基因组测序技术可以弥补传统的整体基因组测序方法的缺陷,从而对这些复杂和多样化的生物现象进行高度特异性的研究[3]。
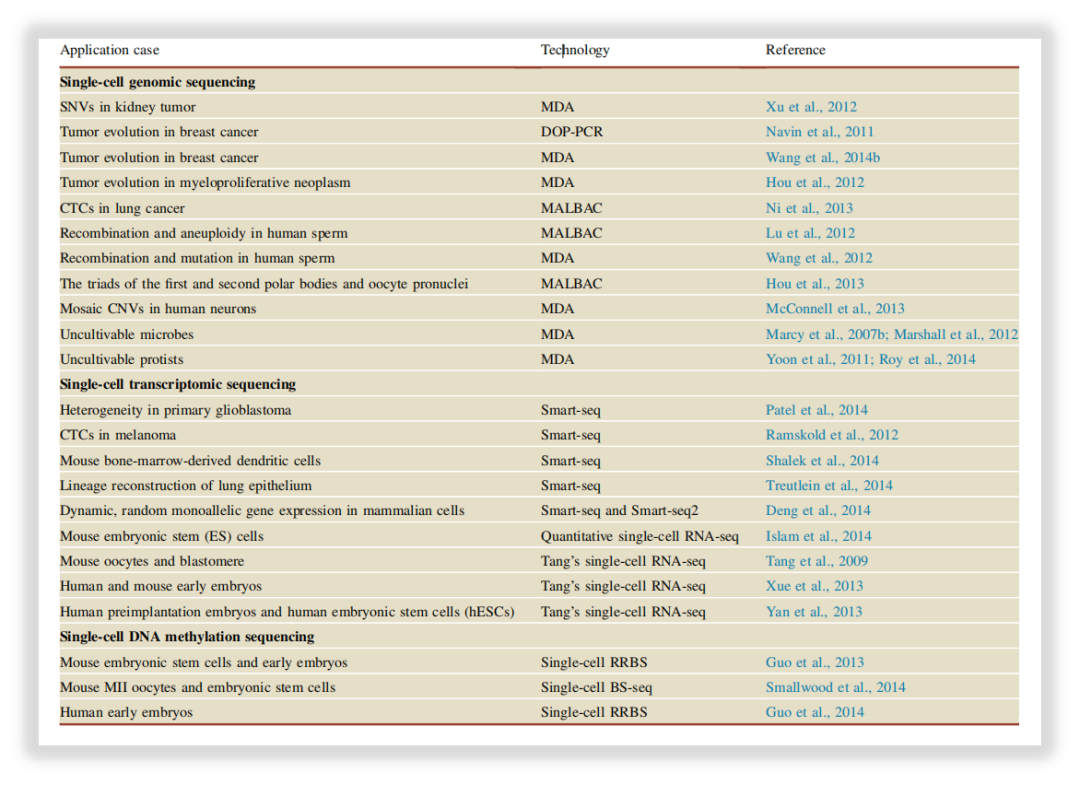
图3:单细胞测序技术的代表性应用总结[3]
△点击放大图片
2. 文献详情
题目:Single-cell sequencing shows cellular heterogeneity of cutaneous lesions in lupus erythematosus[4]
发表期刊:Nature communications (IF:17.694)

△点击放大图片
3. 研究设计
样本类型:
23个临床活检样本,其中8例为DLE患者样本(年龄40.4±11),10例为SLE患者样本(年龄41.4±12.3),5例为健康对照样本(年龄32.4±6)。为了避免由于表皮、真皮细胞直径差异引起的系统捕获的偏好性,作者又将这些样本分为了表皮组与真皮组。
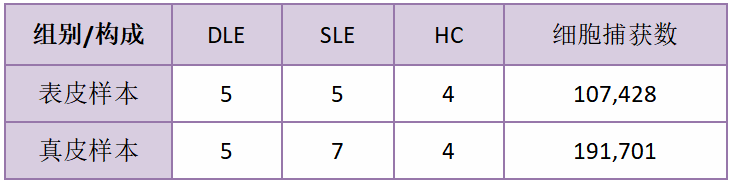
△点击放大图片
方法学:
单细胞测序、免疫荧光(与测序分析结果进行相互验证)
研究目的:
表皮与真皮的细胞分群差异
HC与SLE/DLE的细胞分群差异
关键差异细胞分群的特征靶标
4. 研究结果
·细胞组成差异
作者通过t-随机邻域嵌入(t-SNE)聚类和差异表达基因(DEGs)的分析,鉴定细胞的聚类,发现在表皮、真皮样本中,细胞组成类型存在差异——表皮样本主要有6种细胞类型,其中角质细胞占比较高,而真皮样本中主要有8中细胞类型,其中成纤维细胞占比较高。
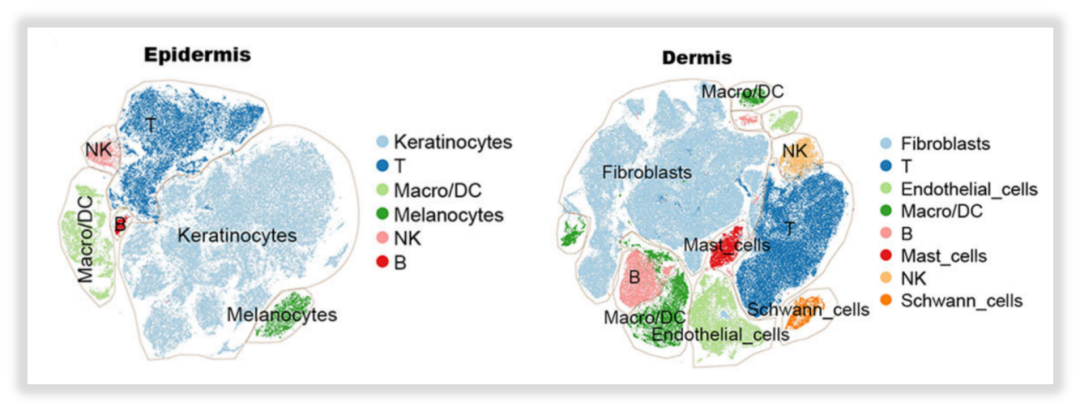
△点击放大图片
图4:表皮样本(左)、真皮样本(右)细胞分群
·免疫细胞占比差异
作者发现:表皮组中,T、B、NK及巨噬/单核等免疫细胞的比率在DLE、SLE患者样本中高于HC样本;真皮组中,这些细胞的比率在DLE样本中高于SLE样本、高于HC样本。
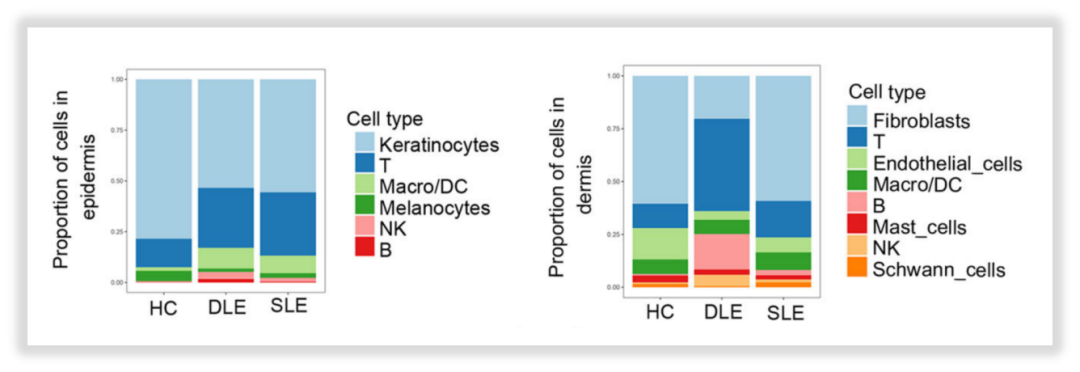
△点击放大图片
图5:表皮组与真皮组中细胞占比
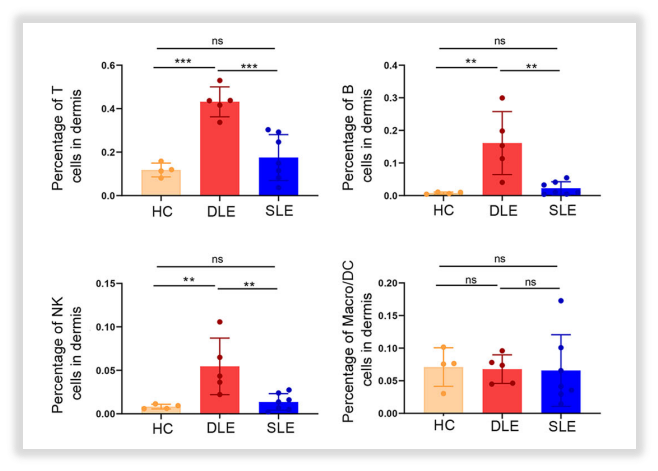
△点击放大图片
图6:真皮组中T、B、NK、巨噬/单核细胞占比
作者在独立实验中使用免疫荧光染色技术对以上结论进行验证(如图7),免疫荧光染色结果与单细胞测序结果显示出一致性。
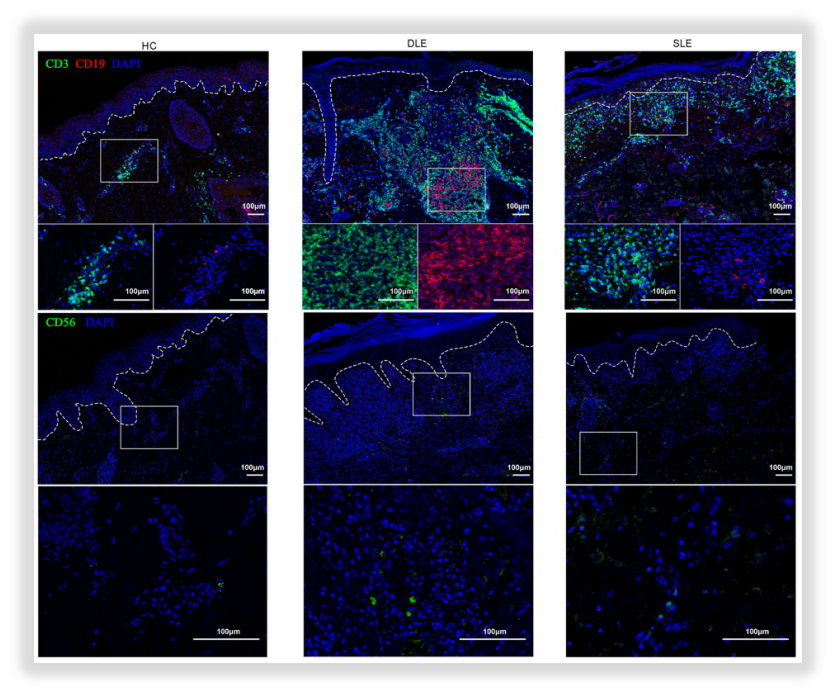
图7:虚线为真皮-表皮的交界处,
CD3 (green)/CD19 (red) → T细胞/B 细胞,;CD56 (green) →NK细胞
△点击放大图片
·细胞类型的精细分群
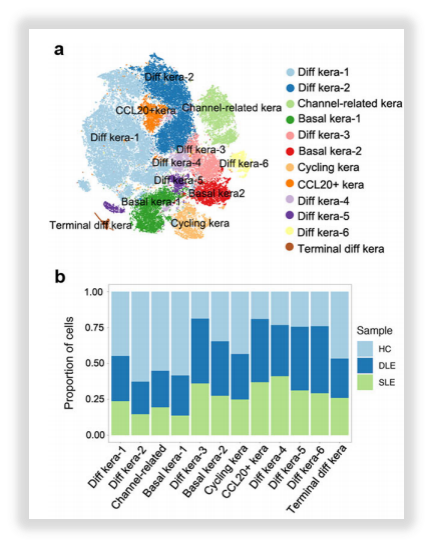
△点击放大图片
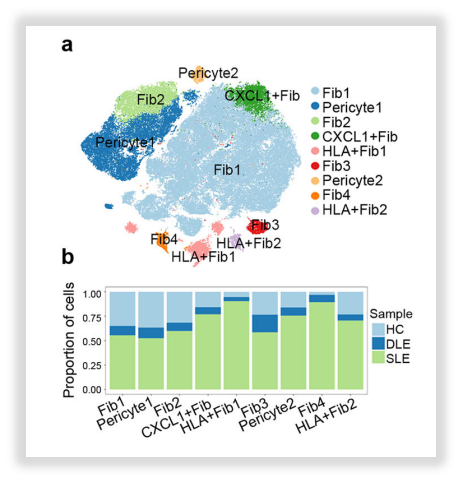
△点击放大图片
图8:角质形成细胞亚聚类分析(上)&成纤维细胞亚聚类分析(下)
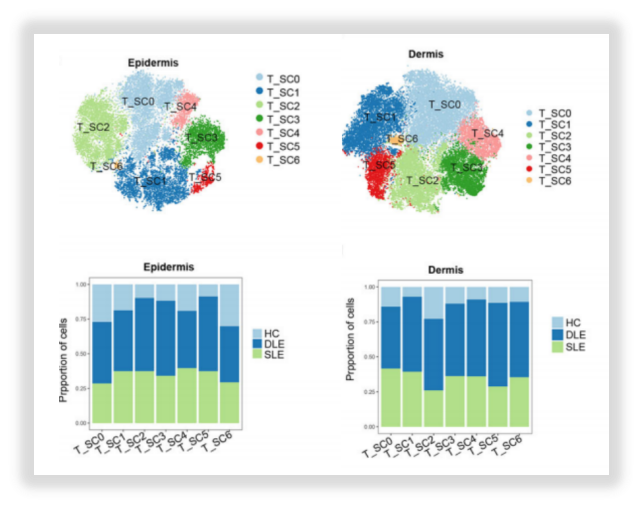
△点击放大图片
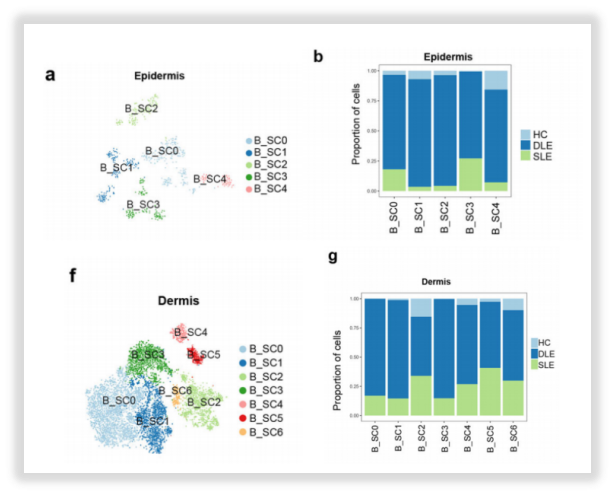
△点击放大图片
图9:T细胞亚聚类分析(上)B细胞亚聚类分析(下)
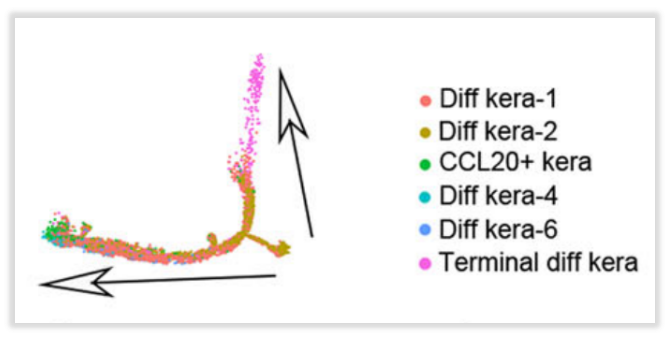
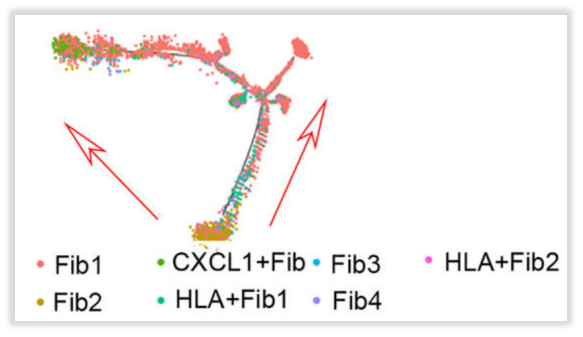
·角质细胞、成纤维细胞分化轨迹
作者在进行亚聚类分析时发现,DLE和SLE组的角质细胞以Diff kera-3, CCL20+ kera, Diff kera-4, Diff kera-5 and Diff kera-6为主,这些细胞占比在75%以上,因此作者又采用拟时序分析的方式来探究这些富集细胞类型之间的分化关系。分析结果提示:狼疮病变皮肤中角质形成细胞有潜在的分化方向,对成纤维细胞进行的拟时序分析也显示了潜在的分化轨迹。
△点击放大图片
△点击放大图片
图10:角质细胞(上)、成纤维细胞(下)拟时序分析结果
·细胞间通讯的探究
通过对细胞受体、配体对数量的分析,作者进行了细胞间通讯机制的探究,结果表明:DLE和SLE患者表皮中角质细胞和Macro/DCs细胞的细胞通讯评分较高;DLE中角质形成细胞、Macro/DCs和黑素细胞通讯评分较高;DLE真皮中内皮细胞、成纤维细胞和Macro/ DCs的细胞通讯评分较高。这表明,在DLE和SLE的皮肤病变中,角质形成细胞、内皮细胞、成纤维细胞和Macro/DCs在免疫微环境中可能存在联系。
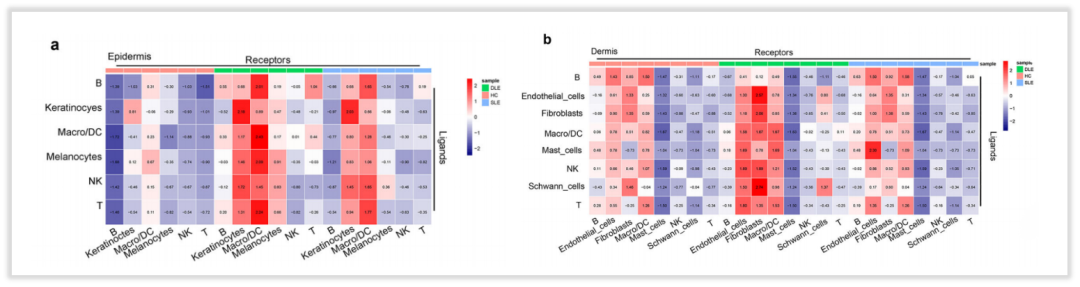
图11:表皮和真皮层中的细胞-细胞相互作用
△点击放大图片
引用文献:
[1]. Kaul A, Gordon C, Crow MK, Touma Z, Urowitz MB, van Vollenhoven R, Ruiz-Irastorza G, Hughes G. Systemic lupus erythematosus. Nat Rev Dis Primers. 2016 Jun 16;2:16039. doi: 10.1038/nrdp.2016.39. PMID: 27306639.
[2]. Kolodziejczyk AA, Kim JK, Svensson V, Marioni JC, Teichmann SA. The technology and biology of single-cell RNA sequencing. Mol Cell. 2015 May 21.
[3]. Liang J, Cai W, Sun Z. Single-cell sequencing technologies: current and future. J Genet Genomics. 2014 Oct 20.
[4]. Zheng M, Hu Z, Mei X, Ouyang L, Song Y, Zhou W, Kong Y, Wu R, Rao S, Long H, Shi W, Jing H, Lu S, Wu H, Jia S, Lu Q, Zhao M. Single-cell sequencing shows cellular heterogeneity of cutaneous lesions in lupus erythematosus. Nat Commun. 2022 Dec 5.